摘 要: 本文应用分子理论,研究盐离子对蛋白质带电特性的影响,理论模型考虑蛋白质与阴离子的结合作用.研究发现,由于蛋白质与阴离子的结合,距离蛋白质表面附近处的阴离子被吸附在了蛋白质表面,在距离蛋白质表面附近区域,阴离子分布较少.通过计算体系中的静电势,我们发现,在距离蛋白质表面附近,静电势呈现了较大的负值,带正电荷的阳离子感受到静电吸引,会出现在距离蛋白质表面附近的区域,这会使得在距离蛋白质表面附近的区域,阳离子数目增多.这样,在不同阴离子浓度、以及阴离子与蛋白质不同结合能条件下,阴离子会在不同程度上影响蛋白质的带电特性、影响体系中的静电特性.通过考察不同结合能条件下,蛋白质表面电荷面密度随阴离子浓度的变化关系还发现,较大的结合能会使得阴离子与蛋白质结合增快,蛋白质表面会呈现从正电荷态向负电荷态的转变.理论结果符合实验观测,由此表明,盐离子与蛋白质的结合导致蛋白质表面带电特性的改变,是盐离子影响蛋白质带电特性的本质.
关键词: 盐离子; 蛋白质; 带电特性;
Abstract: Using a molecular theory,we investigate the effect of salt ions on the charging properties of proteins.Our model takes bonding interaction between protein and anions.We found that because of the bonding of protein and anion,the anion near the protein surface is adsorbed on the protein surface,and the anion distribution is less in the area near the protein surface.We calculated electrostatic potential of the system,and found that the electrostatic potential presents a negative value.Cations can be attracted by electrostatic attractions,which appear in the area near the surface of the protein,and increase the number of cations in the area near the protein.In this way,under different conditions of anion concentration and different binding energies between anion and protein,the anion will affect the charged properties of the protein and the electrostatic properties in the system to varying degrees.By investigation on the relationship between the surface charge density of a protein and the anion concentration under different binding energy conditions,it can also be found that a larger binding energy between anion and protein will make the anion and protein bind faster,and the charged surface density of the protein will present a transition from a positively charged state to negative charge state.Our theoretical results agree with experimental observations,demonstrating that the bonding between salt ions and proteins leads to changes in the charge of proteins,and is the essential characteristics of salt ions that affect the charge properties of proteins.
Keyword: Salt ions; Protein; Charge properties of proteins;
1 、引言
一百多年前,Hofmeister发现可以使用不同的盐来调节蛋白质的溶解度[1],并且,带相同电荷的不同离子与蛋白质的结合能力遵循Hofmeister序列(Hofmeister Series)(例如:HPO42->SO42->F->Cl->Br->NO3->I->CLO4->SCN-),此即Hofmeister效应.多年来,诸多的研究者对于Hofmeister效应给予了大量的研究[2,3,4,5,6,7,8],发现了许多新颖而重要的结果.目前已经发现,Hofmeister效应在化学、生物中成为了一类普遍存在的现象[5,9,10],为了深刻理解并解释Hofmeister效应,经典的理论模型已经揭示了一些特定的Hofmeister效应的物理机理[5,11,12,13].但是,由于蛋白质的多样性与蛋白质体系中溶剂分子、盐离子和p H等各种组分间的相互作用是极其复杂的,各种相互作用的强度在不同环境下呈现多样性,导致蛋白质呈现出各种复杂的特性,因此,Hofmeister效应的研究,一直是化学生物设计领域具有挑战性的课题之一[14,15],并且新的实验结果[15,16,17,18,19,20]报道了一个个全新的盐离子影响蛋白质带电特性的新结果,这些体系中呈现的新特性为实验和理论研究提出了新思考.
Medda等人[15]应用电位滴定(PT)和电泳光散射(ELS)研究了牛血清白蛋白(BSA)与特定盐离子的结合效应,研究发现在0.1 M的生理浓度下,特定的盐阴离子可以与蛋白质表面结合,并且特定盐离子与蛋白质结合符合Hofmeister序列(Cl-<Br-<NO3-<I-<SCN-).Lim等人[16]通过对本体相中吸光度的测定,确定了复合凝聚层的界面张力和接触角,很好地解释了Hofmeister离子对基于蛋白质-多糖系统的复杂凝聚材料性能的影响.Yin等人[17]的工作给出了Hofmeister系列中不同无机盐水溶液的X射线发射光谱,获得了离子与水分子的直接相互作用,揭示了盐与水相互作用的一般性质.Okur等人[19]发现,离子在溶液中将蛋白质析出的能力有所不同,证明了将Hofmeister效应解释为独立的阳离子和阴离子贡献的局限性,深刻理解特定的盐离子与蛋白质的结合,对于化学生物设计是非常重要的.Zhao等人[20]研究了Hofmeister盐离子与四种单体球状蛋白之间的相互作用.结果表明,结构稳定的盐对蛋白质施加正的L-vd W压力,而结构不稳定的盐对蛋白质施加负的L-vd W压力.虽然之前的理论[5,11,12,13]在研究盐离子的Hofmeister效应方面已经取得了重要的成果[15,16,17],但其更多是侧重研究盐离子和溶剂分子的相互作用,而忽视了盐离子与蛋白质分子的结合效应,也没有相关理论或模拟研究蛋白质与特定盐离子对蛋白质带电特性的影响,并且新的实验结果不断呈现[19,20].在本文中,将应用分子理论[21,22]研究盐离子对蛋白质带电特性的影响,分析盐离子对蛋白质带电特性的影响,考察盐离子改变对蛋白质带电特性的本质,为设计生物纳米材料提供理论依据.
2 、分子理论模型
为了创建盐离子对蛋白质带电特性影响的理论模型,考虑蛋白质为球形粒子,半径为R=100nm,蛋白质的球心定为坐标原点,建立球坐标系,沿半径方向标记为r轴.体系中除了蛋白质还有三种组分,分别为:阴离子(-)、阳离子(+)、和水分子(w),三种分子的体积近似可取值为vi=0.03 nm3(i=-,+,w),假定各种分子不均匀分布仅在径向(r方向)上.
图1 盐离子影响蛋白质带电特性示意图。
Fig.1 Schematic representations of effect of salt i-ons on the charging properties of proteins.
考虑蛋白质与阴离子的结合特性,阴离子(-)、阳离子(+)、和水分子(w)的平动熵,以及体系中各种相互作用,体系Helmholtz自由能可表示为
式中β表示1/kBT.
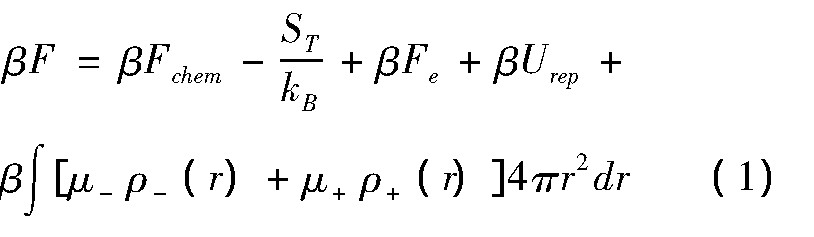
方程(1)右边第一项表示阴离子与蛋白质结合反应平衡时的化学自由能,可由下式给出为
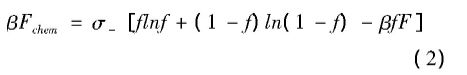
式中σ-为蛋白质表面处阴离子电荷面密度,f表示阴离子与蛋白质的结合分数,式中F表示阴离子与蛋白质表面结合的自由能,F包括能量的获取和熵的损失:-βF=βE-ΔS[23,24].E是阴离子与蛋白质表面结合的结合能,ΔS是阴离子与蛋白质表面结合的熵损失.为了很好地符合实验结果[12],根据文献[25,26]中数据,选取熵的损失为ΔS=-29 (JK-1mol-1).F决定着阴离子与蛋白质表面的结合,较大的F意味着阴离子与蛋白质表面易于结合,较小的F意味着单个阴离子与蛋白质表面难以结合.
方程(1)右边第二项表示阴离子(-)、阳离子(+)、和水分子(w)的平动熵,可以表示为
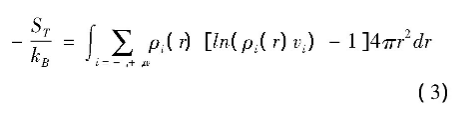
式中ρi(r)(i=-,+,w)是各种分子距离蛋白质表面r位置处的定域分子数密度[27],vi为各分子的体积.
方程(1)第三项表示体系中各带电体间的静电相互作用,可由下式给出为
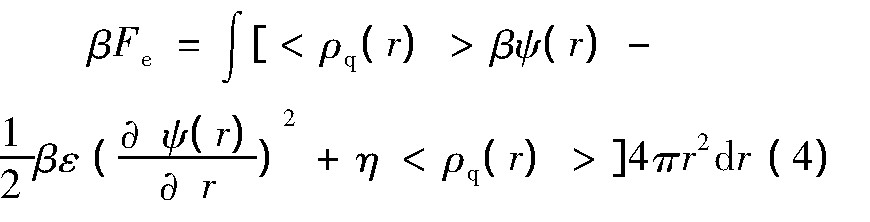
式中ψ(r)是静电势,ε是水的介电常数,η可由体系电中性约束条件确定,<ρq(r)>是距离蛋白质表面r位置处的平均电荷量,可以表示为
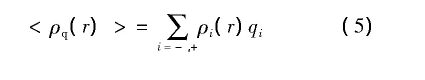
整个系统处于平衡态时,体系总电荷量满足电中性条件,即:
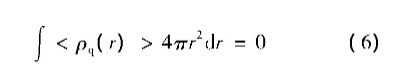
方程(1)右侧的最后一项,表示阴离子、阳离子的化学势对自由能的贡献.式中μ-和μ+是阴离子、阳离子的标准化学势.
方程(1)右侧的第五项表示系统的排斥相互作用,可以由下式给出
式中π(r)表示距离球心r位置处与渗透压相关的排斥作用力场.处于平衡态的系统,满足不可压缩性约束条件:
该约束条件反应了在位置r处所有分子间的相互排斥.
对静电势取变分并最小化自由能,可得到一般形式的Poisson-Boltzmann方程
式中<ρq(r)>已由(5)式给出,静电势在蛋白质表面处边界条件为
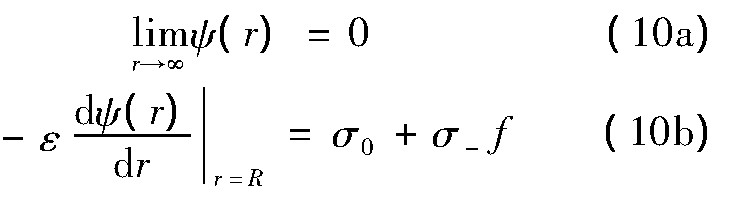
σ0为没有盐离子存在时蛋白质表面的电荷面密度,σ-f表示结合在蛋白质表面单位面积的阴离子电荷量.蛋白质与阴离子结合分数f可通过以下方程确定
阴离子、阳离子和水分子的定域体积分数可表示为
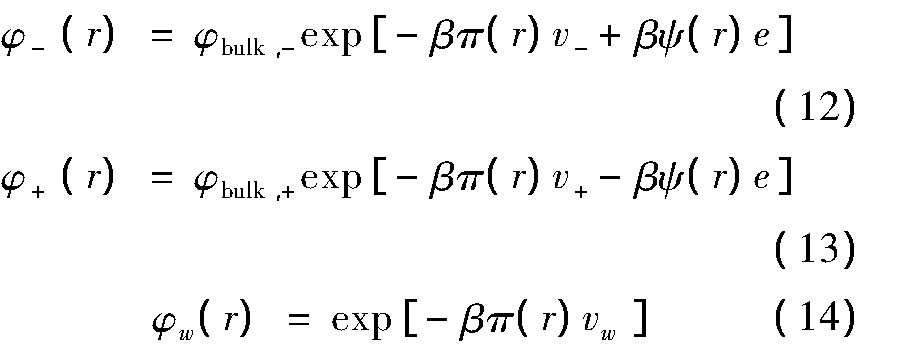
式中,Na是阿伏伽德罗常数.
从方程(12-13)可以看出,在阴离子浓度确定的条件下,阴、阳离子的分布取决于静电势ψ(r)、排斥力场π(r),f是由形成阴离子与蛋白质结合的自由能参数F所决定.以上方程组中的未知量是与位置相关的排斥力场π(r)、静电势ψ(r),将方程(9)-(14)代入约束条件(6)和(8)可解出这两个未知量,详尽的数值求解方案在文献[27,28]已经给出.
3、 结果与讨论
实验研究[12]发现,蛋白质可以与带电量相同的不同种阴离子结合,在p H≈5.0时,可以实现蛋白质对阴离子的吸附,从而改变蛋白质表面的带电特性.为了考察盐离子对蛋白质带电特性的影响,并讨论物理机理,可以先确定蛋白质与阴离子结合过程中,体系中阴离子的分布.
图2a与图2b呈现了在不同阴离子浓度与蛋白质和阴离子的不同结合能条件下,阴离子体积分数距离垂直蛋白质表面方向r处的分布.从图2a可以看出,在不同阴离子浓度条件下,阴离子体积分数随着距离的变化而单调地增加,在距离蛋白质表面处分布较少.这是由于蛋白质与阴离子的结合,使得距离蛋白质表面附近处的阴离子被吸附在了蛋白质表面,进而导致在距离蛋白质表面附近区域阴离子数减少.在不同结合能条件下(图2b),阴离子与蛋白质较大的结合能,可以使得阴离子更容易与蛋白质结合,这样会有更多的阴离子结合在蛋白质表面,因此在距离蛋白质表面附近处的阴离子数体积分数会更小(图2b),由此表明,在距离蛋白质表面附近处的阴离子会优先与蛋白质表面结合,并被吸附于蛋白质的表面层.
图2 阴离子体积分数在垂直蛋白质表面方向(r方向)的分布,σ0=0,σ-=-2.5 e·nm2.
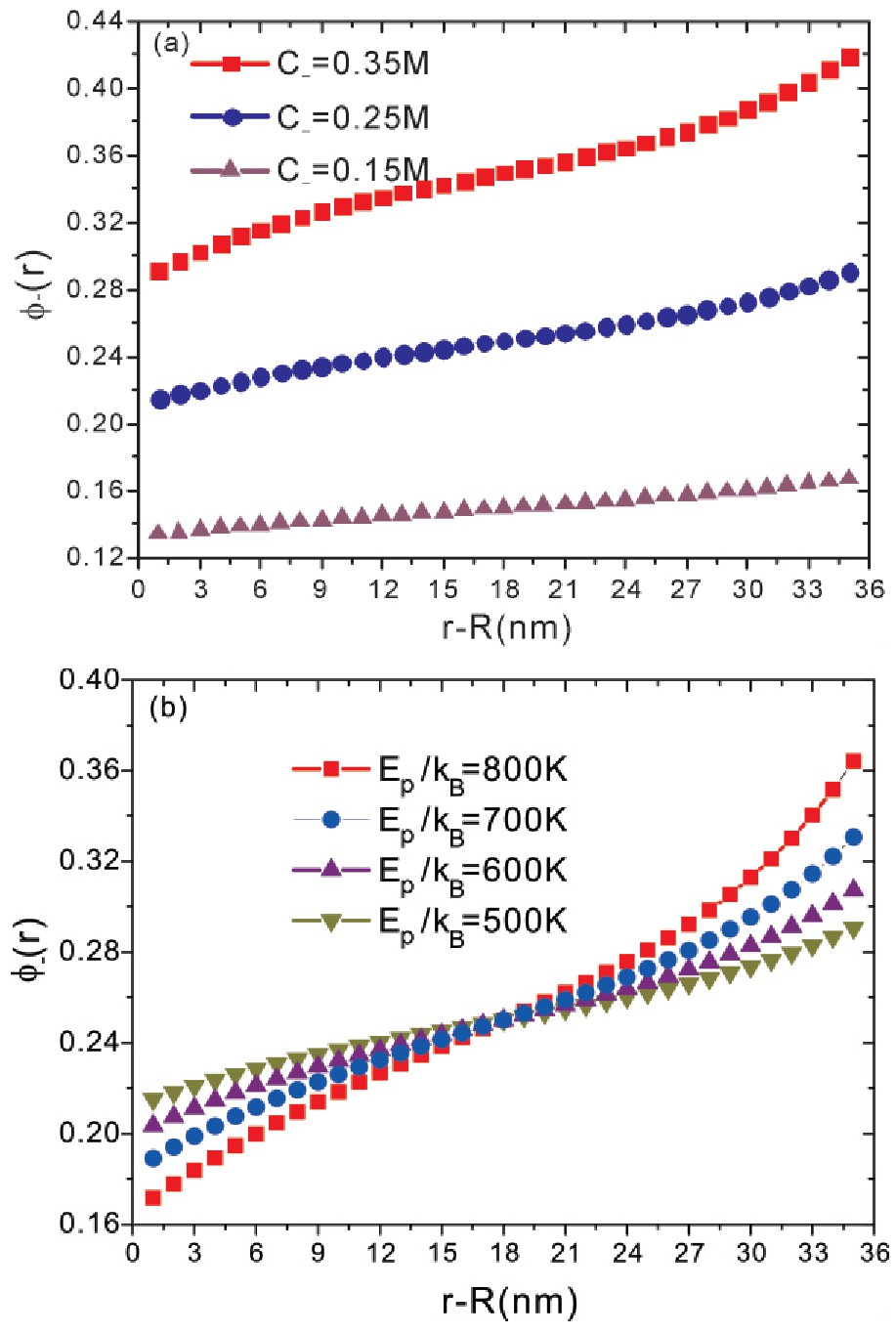
Fig.2 The average volume fraction of the anions as a function of the distance from the protein surface forσ0=0,σ-=-2.5 e·nm2.
为进一步理解上述现象的起源,可以考察体系中的静电势分布.
图3a与图3b呈现了在不同阴离子浓度与蛋白质和阴离子的不同结合能条件下,体系中的静电势距离垂直蛋白质表面的分布.从图3a与图3b可以看出,在不同阴离子浓度与不同结合能条件下,体系中的静电势呈现了负值,并且在蛋白质表面附近处负值变大.较大的阴离子浓度和较大的结合能都会使得有更多的阴离子结合在蛋白质表面,在蛋白质表面附近贡献出较大的静电势.结合在蛋白质表面的负电荷对蛋白质表面附近区域贡献了较多的静电效应,使得空间电势呈现了负值,并且在距离蛋白质表面附近,呈现了较大的静电势,这样,随着结合在蛋白质表面的阴离子增多,空间呈现了较大的负的静电势,带正电荷的阳离子,由于感受到静电吸引,而会出现在距离蛋白质表面附近的区域,这样会使得在距离蛋白质附近的区域,阳离子数目增多.因此,通过阴离子和蛋白质的结合,阴离子不仅可以调节蛋白质表面的带电荷特性,还可以影响蛋白质表面附近区域的静电特性.
图3 体系静电势在距离垂直蛋白质表面方向的分布,参数与图2相同.
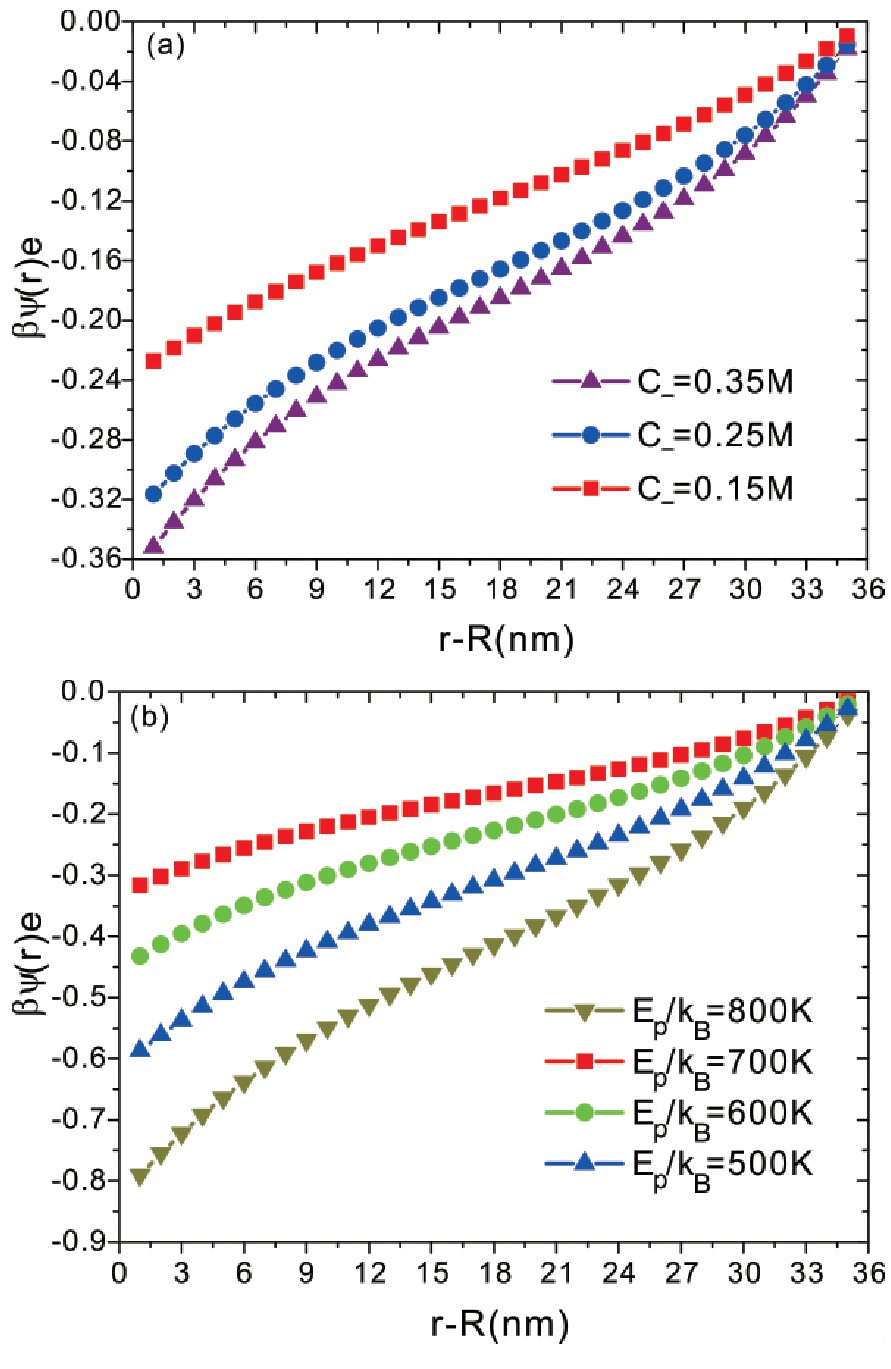
Fig.3 Electrostatic potential as a function of distance from the protein surface.All parameters are the same as those in Fig.2.
图4a与图4b呈现了在不同阳离子浓度和不同阴离子与蛋白质结合能条件下,阳离子体积分数距离垂直蛋白质表面方向r处的分布.从图4可以看出,阳离子体积分数随着距离的变化而单调地降低,在距离蛋白质表面处分布较多,这与阴离子分布相反.这是由于带正电荷的阳离子,由于感受到静电吸引,而会出现在距离蛋白质表面附近的区域,较强的静电吸引则导致较多的阳离子分布于蛋白质表面附近的区域.另一方面,随着阴离子与蛋白质结合能的增加,在距离蛋白质表面附近,会有较多的阴离子结合于蛋白质表面,在距离蛋白质表面附近,由于阴离子数目减少,这样会有更多的阳离子出现在阴离子数目较少的区域.这样,在不同阴离子浓度与不同阴离子结合能条件下,盐离子可以调控蛋白质的带电荷特性和体系中的静电特性.基于这一事实,可以推断,通过特定的盐离子与蛋白质结合,可以灵敏地调控蛋白质的带电荷特性,同时蛋白质表面可以吸附特定的盐离子,这样盐离子通过蛋白质的吸附渗入蛋白质,这就是所谓的“盐渗入(salt-in)效应”,并且带有同种电荷的阴离子由于结合能的差别会出现与蛋白质不同的结合,出现不同的“盐渗入(salt-in)效应”,此即Hofmeister效应,离子渗入蛋白质遵循Hofmeister序列.Medda等人[15]的实验的确报道BAA蛋白质不仅可以吸附阴离子,而且还可以有选择性地吸附,离子渗入蛋白质或与蛋白质的结合遵循Hofmeiste序列HPO42->SO42->F->Cl->Br->NO3->I->CLO4->SCN-.
图4 阳离子体积分数在垂直蛋白质表面方向的分布,参数与图2相同.
Fig.4 The average volume fraction of the cations as a function of the distance from the protein sur-face.All parameters are the same as those in Fig.2.
为了进一步探索阴离子与蛋白质的结合效应,可以考察蛋白质与阴离子的结合分数随阴离子浓度的变化.
图5显示了在不同结合能条件下,阴离子结合分数随阴离子浓度的变化关系.从图5可以看出,在不同结合能条件下,结合分数随阴离子浓度的增大而增加,这是由于随着浓度的增加,阴离子数目增多,增加了阴离子与蛋白质的结合几率.另一方面,较大的结合能,使得阴离子更容易与蛋白质结合,因此,在较大结合能条件下,蛋白质与阴离子结合分数随结合能的变大呈现了增长的趋势.由此可见,阴离子浓度的增加,以及蛋白质与阴离子结合能的变大都会在不同程度上影响蛋白质的带电荷特性.这样,如果阴离子与蛋白质的结合能不同,会导致阴离子与蛋白质的结合不同,此即Hofmeister效应,离子渗入蛋白质遵循Hofmeister序列.
图5 蛋白质与阴离子结合分数随阴离子浓度的变化,参数与图2相同.
Fig.5 The fractions of protein-anion bonds as a func-tion of anion concentration.All parameters are the same as those in Fig.2
Delcroix等人[29]的实验发现,通过改变OH-离子浓度,带负电荷的HAB蛋白质可以被带负电荷的PAA刷吸附,在这里,如果阳离子与蛋白质结合数目增多,这样会使得原本带负电荷的蛋白质带上正电荷,出现蛋白质表面的电荷呈现从带负电荷态向带正电荷态的转变,进而原本带负电荷的HAB蛋白质可以被带负电荷的PAA刷吸附.如果考虑蛋白质表面原本带正电荷,电荷面密度取值为电荷σ0=0.3 e·nm-2,可以获得蛋白质表面电荷面密度的变化.
图6呈现了在不同结合能条件下,蛋白质表面电荷面密度随离子浓度的变化关系.从图6可以看出,随着阴离子浓度的增加,蛋白质表面电荷面密度呈现了从正电荷态向负电荷态的转变,实验研究已经证实[12,29,30]了这种转变特性.并且结合能越大,蛋白质表面电荷面密度从正电荷态向负电荷态的转变越快.较大的结合能会使得阴离子与蛋白质结合增快,这样,结合能越大,蛋白质表面电荷面密度从正电荷态向负电荷态的转变越快.由此可以推断,当蛋白质的电荷呈现从带正电荷态向带负电荷态的转变,原本带正电荷的蛋白质可以被带正电荷的高分子刷吸附[31].同样可以推断,如果出现阳离子与蛋白质结合增加,也会使得蛋白质表面的电荷呈现从带负电荷态向带正电荷态的转变,原本带负电荷的蛋白质可以被带负电荷的高分子刷吸附.Wittemann等人[32]的实验也发现,通过改变盐离子浓度,带负电荷的BLG等蛋白质可以被带负电荷的PAA刷吸附.
图6 蛋白质表面电荷面密度随阴离子浓度的变化
Fig.6 Surface charge density of the protein as a func-tion of anion concentration.
4 、结语
在本文中,我们基于分子理论,研究了盐离子对蛋白质带电特性的影响,理论模型考虑蛋白质与阴离子的结合作用.研究发现,由于蛋白质与阴离子的结合,距离蛋白质表面附近处的阴离子被吸附在了蛋白质表面,较大的阴离子浓度和较强的结合能都会使得有更多的阴离子结合在蛋白质表面,并使得电势分布呈现负值.对于带正电荷的阳离子,由于感受到静电吸引作用,在距离蛋白质表面附近的区域,阳离子数目增多.这样,在不同阴离子浓度与阴离子结合能条件下,阴离子可以调控蛋白质的带电荷特性.不同的阴离子浓度,以及蛋白质与阴离子结合能的变化都会在不同程度上影响蛋白质的带电荷特性,不同的阴离子与蛋白质的结合能不同,这样导致带同种负电荷的阴离子渗入蛋白质遵循Hofmeister序列[8,12].通过考察不同结合能条件下,蛋白质表面电荷面密度随阴离子浓度的变化关系还可以确认,随着阴离子浓度的增加,蛋白质表面电荷面密度呈现了从正电荷态向负电荷态的转变,并且较大的结合能会使得阴离子与蛋白质的结合增快,因此,较大的结合能会导致蛋白质表面电荷面密度从正电荷态向负电荷态的转变加快.这样,当蛋白质表面的电荷呈现了从带正电荷态向带负电荷态的转变,原本带正电荷的蛋白质可以被带正电荷的高分子刷吸附[31].
在本文中我们只考虑了阴离子和蛋白质的结合作用[12],事实上,蛋白质也可以与带正电荷的阳离子结合[14],这样,一旦蛋白质的电荷呈现了从带正电荷态向带负电荷态的转变,原本带正电荷的蛋白质可以被带正电荷的高分子刷吸附.并且,蛋白质分子带电量会随着盐离子浓度、种类、p H的变化而改变[32,33],本文中考虑蛋白质与负电荷阴离子结合.理论结果符合实验观测,由此表明,盐离子与蛋白质结合,导致蛋白质带电荷特性改变,是盐离子影响蛋白质带电特性的本质.
参考文献
[1]Hofmeister F.Zur lehre von der wirkung der salze[J].Archiv für Experimentelle Pathologie und Pharmakologie,1888,24:247.
[2]Von Hippel P H,Schleich T.Ion effects on the solution structure of biological macromolecules[J].Acc.Chem.Res.,1969,2:257.
[3]Collins K D,Washabaugh M W.The Hofmeister effect and the behaviour of water at interfaces[J].Quarterly Rev.Biophys.,1985,18:323.
[4]Clarke R J,Lüpfert C.Influence of anions and cations on the dipole potential of phosphatidylcholine vesicles:a basis for the Hofmeister effect[J].Biophys.J.,1999,76:2614.
[5]Lo Nostro P,Fratoni L,Ninham B W,et al.Water absorbency by wool fibers:Hofmeister effect[J].Biomacromolecules,2002,3:1217.
[6]Kunz W,Henle J,Ninham B W.Zur lehre von der wirkung der salze(about the science of the effect of salts):franz Hofmeister's historical papers[J].Current Opinion in Colloid&Interface Science,2004,9:19.
[7]Pinna M C,Bauduin P,Touraud D,et al.Hofmeister effects in biology:effect of choline addition on the salt-induced super activity of horseradish peroxidase and its implication for salt resistance of plants[J].J.Phys.Chem.B,2005,109:16511.
[8]Bilanicova D,Salis A,Ninham B W,et al.Specific anion effects on enzymatic activity in nonaqueous media[J].J.Phys.Chem.B,2008,112:12066.
[9]Pinna M C,Bauduin P,Touraud D,et al.Hofmeister effects in biology:effect of choline addition on the salt-induced super activity of horseradish peroxidase and its implication for salt resistance of plants[J].J.Phys.Chem.B,2005,109:16511.
[10]Monduzzi M,Ninham B W,Pinna M C,et al.Hofmeister series:the hydrolytic activity of aspergillus niger lipase depends on specific anion effects[J].J.Phys.Chem.B,2005,109:5406.
[11]Winzor D J,Jones S,Harding S E.Determination of protein charge by capillary zone electrophoresis[J].Analy.Biochem.,2004,333:225.
[12]Salis A,Bilanicova D,Ninham B W,et al.Hofmeister effects in enzymatic activity:weak and strong electrolyte influences on the activity of candida rugosa lipase[J].J.Phys.Chem.B,2007,111:1149.
[13]Xie W J,Gao Y Q.A simple theory for the Hofmeister series[J].J.Phys.Chem.Lett.,2013,4:4247.
[14]Lo Nostro P,Ninham B W.Hofmeister phenomena:an update on ion specificity in biology[J].Chem.Rev.,2012,112:2286.
[15]Medda L,Barse B,Cugia F,et al.Hofmeister challenges:ion binding and charge of the BSA protein as explicit examples[J].Langmuir,2012,28:16355.
[16]Lim S,Moon D,Kim H J,et al.Interfacial tension of complex coacervated mussel adhesive protein according to the Hofmeister series[J].Langmuir,2014,30:1108.
[17]Yin Z,Rajkovic I,Kubicek K,et al.Probing the Hofmeister effect with ultrafast core-hole spectroscopy[J].J.Phys.Chem.B,2014,118:9398.
[18]Fox J M,Kang K,Sherman W,et al.Interactions between Hofmeister anions and the binding pocket of a protein[J].J.Am.Chem.Soc.,2015,137:3859.
[19]Okur H I,Jana H L,Rembert K B,et al.Beyond the Hofmeister series:ion-specific effects on proteins and their biological functions[J].J.Phys.Chem.B,2017,121:1997.
[20]Zhao L,Damodaran S.Hofmeister order of anions on protein stability originates from Lifshitz-Van Der Waals dispersion interaction with the protein phase[J].Langmuir,2019,35,40:12993.
[21]Szleifer I,Carignano M A.Tethered polymer layers:phase transitions and reduction of protein adsorption[J].Macromol.Rapid Commun.,2000,21:423.
[22]Ren C L,Nap R J,Szleifer I.The role of hydrogen bonding in tethered polymer layers[J].J.Phys.Chem.B,2008,112:16238.
[23]Kundagrami A,Muthukumar M.Theory of competitive counterion adsorption on flexible polyelectrolytes:palent salts[J].J.Chem.Phys.,2008,128:244901.
[24]Zhao X J,Jiang Z Y.The role of hydrogen bonding in the volume phase transitions of polymer gels[J].J.At.Mol.Phys.,2015,32:313(in Chinese)[赵新军,蒋中英.高分子凝胶体积相变中的氢键作用[J].原子与分子物理学报,2015,32:313]
[25]Zhang Y,Furyk S,Bergbreiter D E,et al.Specific ion effects on the water solubility of macromolecules:PNIPAM and the Hofmeister series[J].J.Am.Chem.Soc.,2005,127:14505.
[26]Naini C A,Thomas M,Franzka S,et al.Hofmeister effect of sodium halides on the switching energetics of thermoresponsive polymer brushes[J].Macromol.Rapid Commun.,2013,34:417.
[27] Szleifer I,Carignano M A.Tethered polymer layers:phase transitions and reduction of protein adsorption[J].Macromol.Rapid Commun.,2000,21:423.
[28]Zhao X J,Zhang G L.A theoretical investigation on the ph-induced switching of mixed,polyelectrolyte brushes[J].Chin.J.Polymer Sci.,2014(5):568.
[29]Delcroix M F,Huet G L,Conard T,et al.Design of mixed PEO/PAA brushes with switchable properties toward protein adsorption[J].Biomacromolecules,2013,14:215.
[30]Salis A,Bostro M M,Medda L,et al.Measurements and theoretical interpretation of points of zero charge/potential of BSA protein[J].Langmuir,2011,27:11597.
[31]Kuehner D E,Engmann J,Fergg F,et al.Lysozyme net charge and ion binding inconcentrated aqueous electrolyte solutions[J].J.Phys.Chem.B,1999,103:1368.
[32]Wittemann A,Ballauff M.Interaction of proteins with linear polyelectrolytes and spherical polyelectrolyte brushes in aqueous solution[J].Phys.Chem.Chem.Phys.,2006,8:5269.
[33]Nap R J,Bozicl A L,Szleifer I,et al.The role of solution conditions in the bacteriophage PP7 capsid charge regulation[J].Biophys.J.,2014,107:1970.