摘要:目的 探讨心脏成纤维细胞 (CFs) 生物表型多样性。方法 新生13天SD大鼠12只, 胰蛋白酶/胶原酶联合消化法分离培养新60只生大鼠CFs, 比较原代和传代培养细胞形态学变化, 免疫组织化学学检测鉴定常见成纤维细胞标记波形蛋白 (vimentin) 、成纤维细胞特异性蛋白1 (FSP1) 和盘状结构域受体 (DDR2) 的表达, 细胞免疫荧光检测CFs干细胞标记nanog、c-kit、sca-1、CD73和CD90的表达, 细胞免疫荧光三标技术检测CFs干细胞标记间的共表达情况。结果 酶联合消化法分离培养的CFs收获细胞量大, 第3代细胞活力好、纯度高。Vimentin、FSP1和DDR2在CFs中均表达, 但DDR2在CFs中呈强表达。部分CFs分别表达nanog、c-kit、sca-1、CD73和CD90, 部分nanog阳性的CFs分别和CD73、CD90和sca-1, 及其CD90和sca-1存在共表达, nanog+/CD73+共表达阳性率最高 (59.02%±8.39%) , 与其他3组相比差异均有极显着性 (P<0.01) ;而nanog+/CD90+共表达阳性率与nanog+/sca-1+之间差异无显着性 (P>0.05) , 但这两组与CD90+/sca-1+相比差异均有极显着性 (P<0.01) ;CD90+/sca-1+共表达阳性率均低于其他3组, 差异具有极显着意义 (P<0.01) .结论 CFs是具有干细胞特征混合细胞群, 在表型上具有多样性。
关键词:心脏成纤维细胞; 干细胞标记; 细胞培养; 免疫组织化学; 新生大鼠;
Multiple phenotypes in cardiac fibroblasts
Abstract:Objective To explore the multiple phenotypes in cardiac fibroblasts ( CFs) . Methods CFs of neonatal rats were isolated from twelve 1-3-day neonatal SD rats and cultured using combined type I collagenase ( w/v, 0. 1%) trypsin ( w/v, 0. 25%) digestion method. Morphological characteristics were observed between primary and subcultured CFs. Common molecular markers for fibroblasts such as vimentin, fibroblast specific protein ( FSP1) and discoidin domain receptors 2 ( DDR2) were detected by immunohistochemical staining. Nanog, c-kit, sca-1, CD73 and CD90 recognized as stem cell markers were evaluated in CFs by immunofluorescence staining, and co-expression of those markers was investigated by three-color immunofluorescence technology. Results By the combined enzyme digestion method, the isolated fibroblasts had large volume. Passage 3 cells exhibited good biological activity, fast proliferation and high purity. Vimentin, FSP1 and DDR2 were all expressed and DDR2 was strongly expressed in CFs. Nanog, c-kit, sca-1, CD73 and CD90 were detected in some CFs. Interestingly, CD73, CD90 and sca-1 were co-expressed with nanog positive CFs respectively and the result showed the positive expression rate of nanog+/CD73+was the highest than other three groups ( 59. 02% ± 8. 39%) . It had significant different ( P < 0. 01) . while the positive rate of nanog+/CD90+in CFs had no different with the rate of nanog+/sca-1+ ( P > 0. 05) . And the rate of nanog+/CD90+and nanog+/sca-1+ had extremely significant different with the rate of CD90+/sca-1+ ( P < 0. 01) . But the positive rate of CD90+/sca-1+ was significantly lower than that in the other three groups ( P < 0. 01) . Conclusion CFs have several subpopulations with stem cell characteristics and multiple phenotype.
Keyword:Cardiac fibroblast; Stem cell marker; Cell culture; Immunohistochemical staining; Neonatal rat;
心脏成纤维细胞 (cardiac fibroblasts, CFs) 占心脏细胞总数的50%~70%, 是心肌组织重要的支持细胞, 抗缺氧损伤能力强, 即使是在长期纤维化状态下, 仍具有较高的增殖和代谢活性[1].传统观念认为, 成纤维细胞是一群均一的细胞, 在不同的器官组织中, 发挥其支持和分泌功能。近期研究发现, 成纤维细胞具有显着异质性, 表现在细胞形态大小[2]、增殖特性[3], 胶原合成[4], 分泌细胞因子和细胞表面受体等[5].前期研究发现, 不同器官成纤维细胞在细胞形态、生长增殖和表面受体表达等方面具有显着异质性, 且成纤维细胞具有间充质干细胞样特性, 表现出多向分化潜能[6,7].但CFs是否存在干细胞分子标记的表达差异, 以及干细胞标记的重叠表达等, 目前尚鲜见报道。
本研究拟采用体外分离培养技术和免疫细胞化学技术, 探讨CFs表达干细胞标记nanog、c-kit、sca-1、CD73和CD90及其共表达情况, 进一步确定CFs的不同亚群, 为进一步开发利用成纤维细胞提供可靠的实验支持, 为组织损伤原位修复提供更丰富的种子细胞来源奠定实验基础。
材料和方法
1. 实验材料
1~3 d SD新生大鼠12只, 体重 (7.1±0.31) g, 雌雄不限, 由新乡医学院实验动物中心提供, 动物合格证号:SCXK (豫) 2010-0002.
2. 方法
2.1 CFs分离培养和传代:
新生大鼠称重后处死, 无菌条件下取心脏, 预冷PBS冲洗, 剔除心房, 大血管和结缔组织, 用眼科剪将组织剪成约1 mm3小块, 加入0.1%胶原酶I (Roche公司) 和3倍体积的0.125%胰蛋白酶 (Sigma公司) , 37℃10 min, 吸管充分吹打, 上清加入等体积含低糖完全培养基[DMEM (Hyclone公司) +10%胎牛血清 (Hyclone公司) ]终止消化, 直到组织小块完全消化为止, 1200 r/min离心5 min, 完全培养基重悬沉淀, 接种至25 cm2培养瓶中, 40 min, 弃上清, 加入完全培养。48 h后首次更换完全培养基, 以后每2 d换液, 待细胞汇合约85%时, 胰蛋白酶细胞消化液 (含0.25%胰蛋白酶、0.02%EDTA) , 37℃, 2 min, 消化贴壁细胞, 以1∶3接种传代扩大培养, 细胞汇合近70%时, 4%多聚甲醛固定备用。
2.2 细胞免疫组织化学染色:
经固定过的细胞爬片, PBS冲洗, 3%H2O2孵育5~10 min, PBS冲洗, 山羊血清室温封闭10~15 min.分别滴加山羊抗大鼠盘状结构域受体2 (discoidin domain receptor 2, DDR2) 多克隆抗体 (1∶300, 美国Santa Cruz公司) 、兔抗大鼠成纤维细胞特异性蛋白1 (fibroblast specific protein, FSP1) 多克隆抗体 (1∶200, 美国Abcam公司) 和兔抗大鼠波形蛋白 (vimentin) 多克隆抗体 (1∶500, 美国Abcam公司) , 4℃过夜, PBS冲洗, 滴加相应的生物素化二抗工作液, 37℃孵育20 min, PBS冲洗, 滴加HRP标记链霉卵白素工作液 (S-A/HRP) , 室温孵育12 min.空白对照为PBS代替一抗, 其余相同。DAB显色, 苏木素复染细胞核, 自来水返蓝, 光学显微镜下观察, 图像采集和分析。
2.3 细胞免疫荧光染色:
经固定过的细胞爬片, PBS冲洗, 0.3%Triton透膜10 min, PBS浸洗3次, 每次3min.正常山羊血清室温封闭20 min, 分别滴加兔抗大鼠sca-1多克隆抗体 (1∶200, 德国Merck公司) 、兔抗大鼠c-kit单克隆抗体 (1∶300, 美国Santa Cruz公司) 、兔抗大鼠nanog多克隆抗体 (1∶200, 美国Santa Cruz公司) 、小鼠抗大鼠CD90单克隆抗体 (1∶500, 美国Abcam公司) 和小鼠抗大鼠CD73单克隆抗体 (1∶300, 美国BD公司) , 4℃过夜, PBS冲洗, PBS漂洗3次, 每次5 min;滴加相应二抗, 37℃孵育40 min, PBS漂洗3次, 每次5 min;5 mg/L DAPI室温孵育5 min, 抗荧光淬灭封片剂封片, 荧光显微镜下观察并摄片。空白对照为PBS代替一抗工作液, 其余步骤相同。荧光显微镜下行图像采集。
2.4 细胞免疫荧光三标染色:
经固定过的细胞爬片, 除分组加入一抗 (具体分组见表1) 外, 其余步骤同上。
2.5 数据统计学处理:
免疫荧光数据均采用SPSS17.0软件进行统计学分析。随机各取30个视野, 按下列公式计算:共表达率=共表达细胞数/有核细胞总数。结果以均值±标准差 (±s) 表示, 两样本均数比较采用独立样本t检验, 多个样本均数的比较采用单因素方差分析, 检验标准α=0.05, P<0.05为差异有统计学意义。
结果
1.体外培养不同代次CFs形态学比较
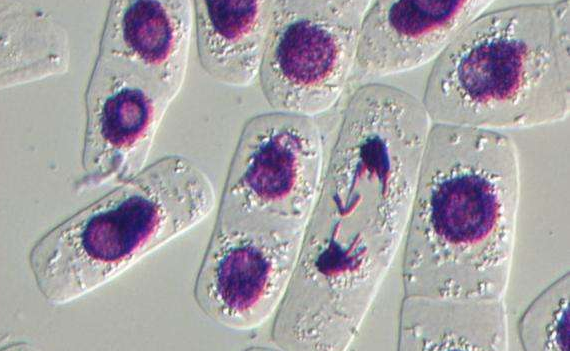
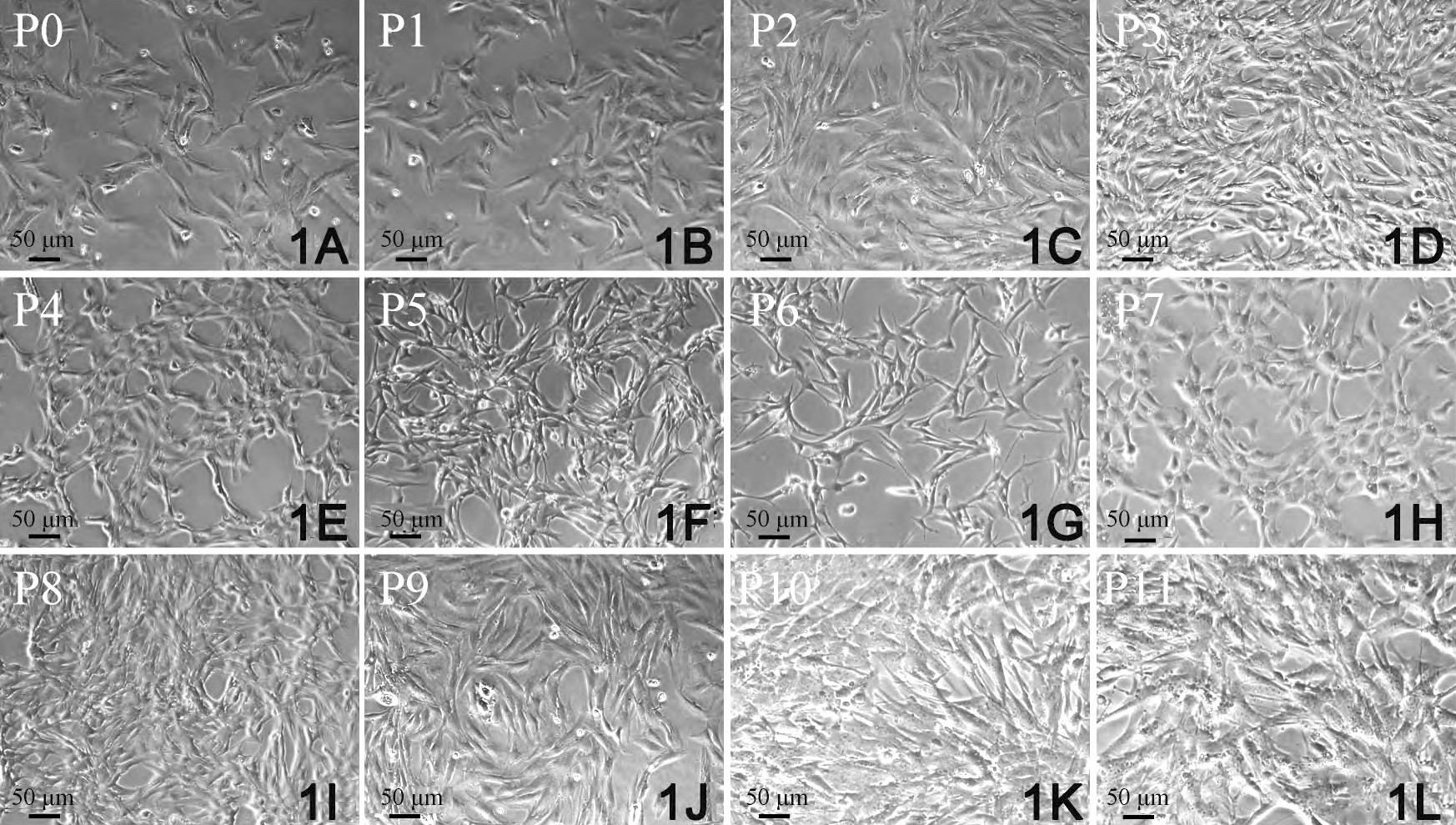
酶联合消化法体外分离培养的CFs活力好, 增殖能力强, 传2~11代 (P2~P11) 后的CFs增殖能力与原代细胞比较, 均显示出同样的增殖能力。传代后的CFs, 尽管受到细胞消化液中酶的作用, 但在增殖期内仍表现出很强的适应性, 增殖能力继续保持稳定。在光学显微镜下观察, CFs形态多样, 大小不一。呈三角形、梭形、星形和多边形, 胞核较小, 双核细胞约占40%, 偶见3核细胞 (图1) .5~7 d细胞铺满培养皿底部, 约有85%CFs聚集, 呈现出漩涡状或放射状分布 (图1) .培养7 d后, 细胞大部分交叉重叠, 形成“编织状”外观。
原代 (primary, P0) CFs细胞边界较为清晰, 折光度好, 但经初次差速贴壁后, 纯度不够, 除CFs外, 还有少量小而圆的心肌干细胞, 内皮细胞, 偶见跳动的心肌细胞。经传代培养后, 成纤维细胞纯度大增。经细胞免疫荧光检测, P0纯度为95%, P1为99%, P2代为99.8%, P3~P11CFs纯度达到100%.但从形态上观察, P0~P9细胞, 胞核明显, 胞体较大, 有数量不等的短突起, 细胞折光度高, 无自发性搏动。但P10和P11 CFs, 细胞核变形, 染色质分布不均, 胞质所占比例减少, 内有颗粒状分布, 细胞边界更加模糊不清, 符合细胞衰老的形态学特征。综合考虑, P3~P5 CFs是用于后续实验的最佳代次。
2.成纤维细胞常见标记的免疫组织化学表达鉴定
将分离培养第3代CFs分别行vimentin、DDR2和FSP1细胞免疫组织化学染色, 结果显示, 形态各异的成纤维细胞对这3种成纤维细胞标记物均呈阳性染色 (图2) .如图2 A中所示, 构成细胞骨架的中间纤维蛋白---波形蛋白, 棕黄色颗粒分布于胞质中, 其他部位无非特异性染色;而作为膜受体的DDR2蛋白, 主要分布于胞膜及胞质近膜处, 但也有少部分呈现出胞核分布 (图2B) , 约有97.5%细胞呈DDR2阳性表达;FSP1则在胞质中呈均匀分布, 在胞核和胞膜中染色较淡 (图2C) .
3. CFs的干细胞表达标记检测
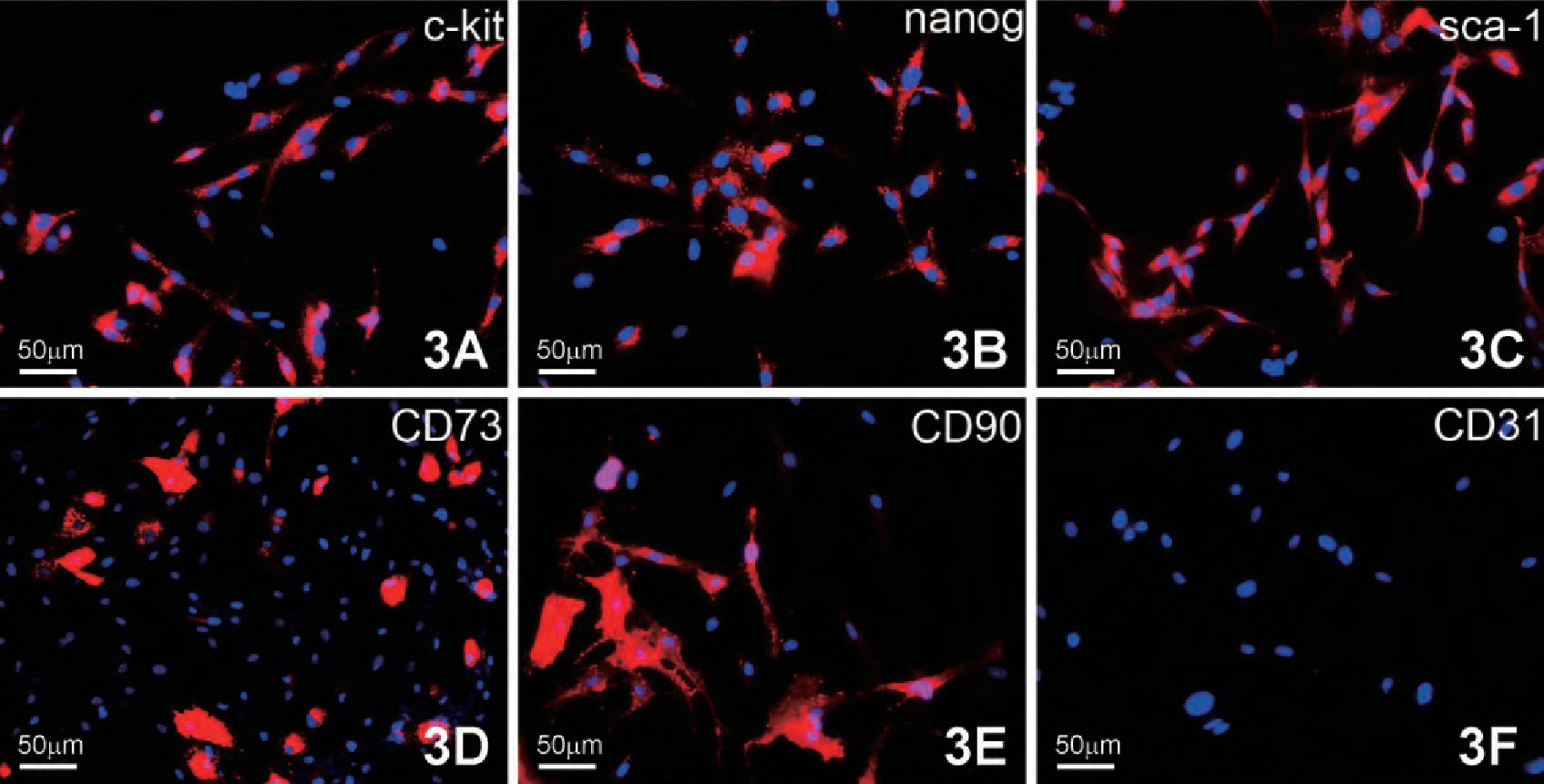
将分离培养第3代CFs经胚胎干细胞标记nanog, 心肌干细胞标记c-kit和sca-1, 间充质干细胞标记CD90和CD73, 及其内皮细胞标记CD31的细胞免疫荧光检测, 发现CFs不表达CD31 (图3F) , 而有部分细胞则表达这五种干细胞标记。c-kit主要表达于胞膜, 少量分布于胞质 (图3A) ;nanog主要分布在胞质, 呈强阳性表达 (图3B) ;sca-1主要分布于胞核和胞质中 (图3C) , CD90和CD73主要在胞膜中呈强阳性表达 (图3D, 3E) .
4. CFs的干细胞标记共表达检测
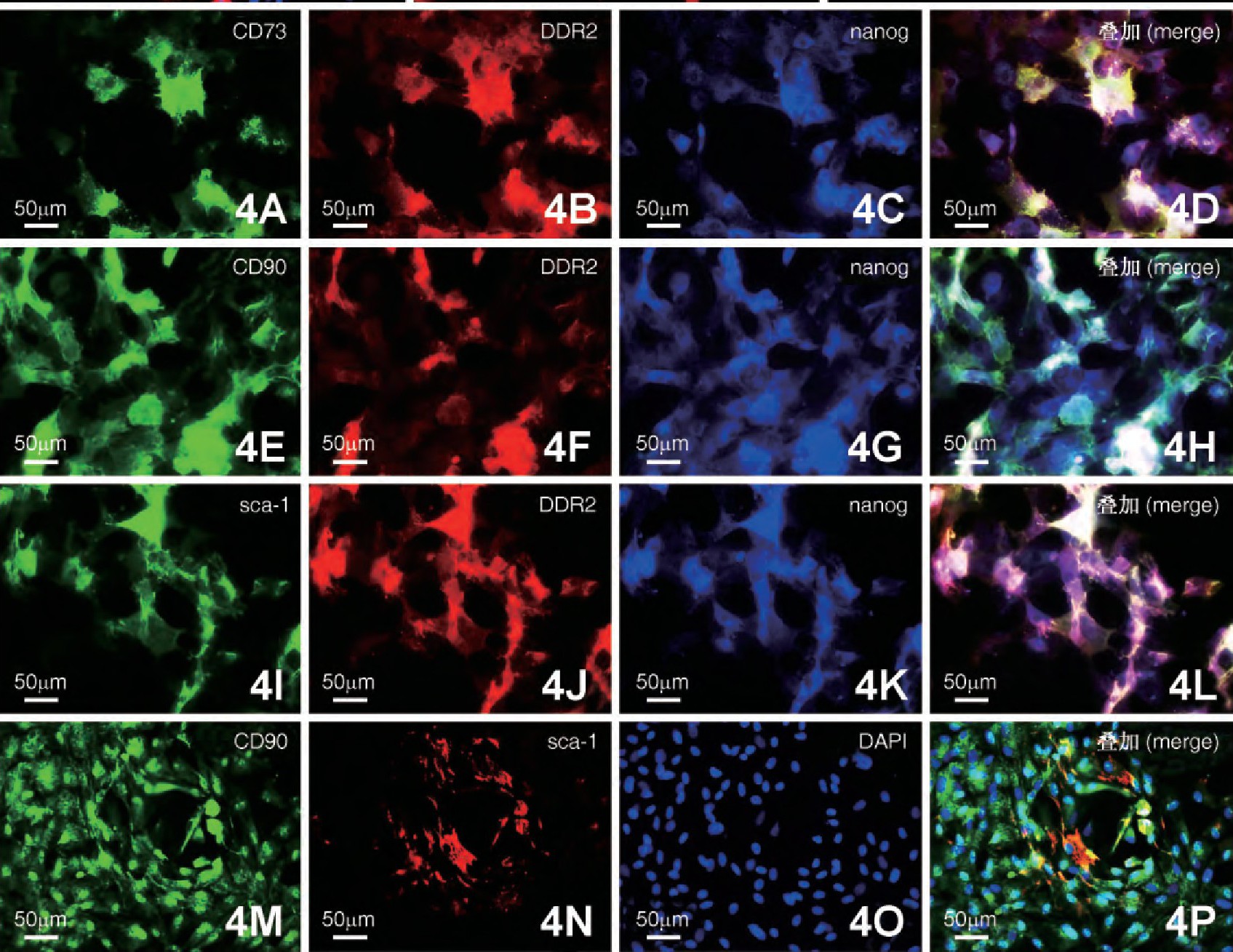
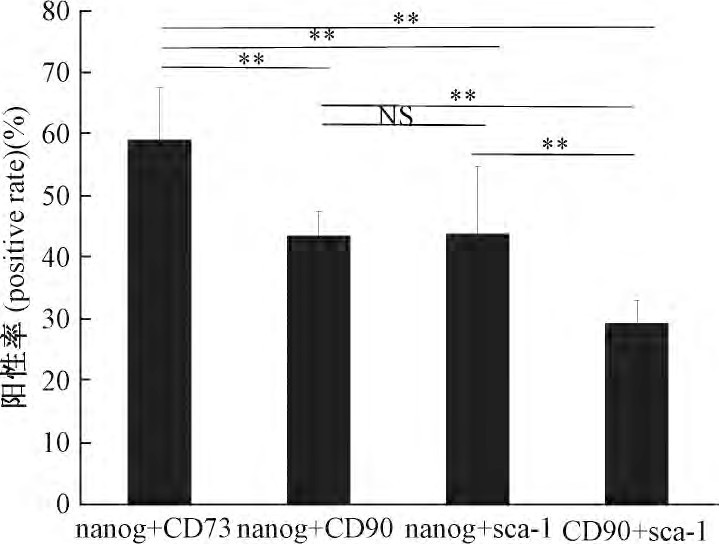
为检测CFs是否存在干细胞标记的共表达现象, 采取细胞荧光三标技术进行观察分析。结果显示, 部分CFs中nanog分别和CD73、CD90和sca-1存在共表达 (图4) .同时, 对nanog+/CD73+、nanog+/CD90+、nanog+/sca-1+和CD90+/sca-1+共表达阳性率进行统计分析, 结果显示, nanog+/CD73+共表达阳性率最高 (59.02%±8.39%) , 与其他3组相比差异均有极显着性 (P<0.01) ;而nanog+/CD90+共表达CFs阳性率与nanog+/sca-1+之间差异没有显着性 (P>0.05) , 但这两组与CD90+/sca-1+相比差异均有极显着性 (P<0.01) ;CD90+/sca-1+共表达CFs阳性率均低于其他3组 (29.35%±3.7%vs59.02%±8.39%, 43.55%±3.92%, 43.78%±10.88%) , 差异具有极显着意义 (P<0.01, 图5) .
讨论
CFs是心脏中数量最丰富的一种间质细胞, 分布广泛, 增殖迅速。其主要功能是合成和分泌细胞外基质 (extracellular matrix, ECM) , CFs与ECM共同构成复杂而精妙的三维网络结构, 支持并连接心肌细胞, 调节心肌细胞机械、电生理活动, 在心脏正常发育和病理性损伤修复中发挥重要作用[8,9].
目前, 成纤维细胞尚缺乏特异性表面标记, 对成纤维细胞的鉴定也存在诸多争议。只有确保成纤维细胞鉴定准确后, 才能保证对其研究的精准性。Vimentin是最常见的成纤维细胞分子标记, 但该蛋白也可标记内皮细胞和神经元[10];FSP1曾经被认为是成纤维细胞的特异性标记, 但淋巴细胞和肿瘤细胞也呈阳性表达[11];DDR2也可标记成纤维细胞, 但白细胞和肿瘤细胞中也有表达。有研究显示, 在心脏组织中, 心肌细胞、内皮细胞和平滑肌细胞中未检测到DDR2表达[12].本研究对体外分离培养新生大鼠CFs, 采用免疫组织化学分别检测vimentin、FSP1和DDR2表达。根据我们先前的研究认为, 除了根据以上这些标记物作为鉴定成纤维细胞之外, 还应该结合细胞来源、形态、分布等特征进行判断, 比如来自正常心肌组织的成纤维细胞不可能含有肿瘤细胞。另外, 根据细胞的形态特点可以明确地区别于心肌细胞 (有横纹) 和白细胞等[13].综合分析, 本研究采用3种标记综合判断, 筛选出的成纤维细胞纯度是达标的、可信的。
CD90为一种细胞表面黏附分子, 在细胞的黏附、凋亡、增殖和迁移等信号转导中发挥重要作用。有研究证明, 体外分离培养肺成纤维细胞中存在CD90+和CD90-亚群, 它们在炎症反应和纤维化进程中发挥不同作用[14].Rege等[15]证实, CD90+成纤维细胞更易转化为肌成纤维细胞 (myofibroblast, MFB) .心肌球来源 (cardiosphere-derived cells, CDCs) 的CD90-细胞在心肌梗死模型中则具有更大的修复潜能[16].Ali等[17]证实, Thy1+、CD45-、CD31-、CD11b-、Ter119-是心肌成纤维细胞中的主要亚群。
C-kit又称CD117, 酪氨酸激酶受体蛋白家族的重要成员之一, 是干细胞因子 (stem cell factor, SCF) 的受体, 它与SCF结合作为重要的受体配基复合物, 通过激活下游信号分子复合物, 产生强大的连锁反应, 从而在细胞分化、增殖中发挥重要作用[18].与c-kit类似, 干细胞抗原1 (stem cells antigen-1, sca-1) 也是一种造血干细胞标记物, 在调控造血干细胞和c-kit表达中发挥重要作用[19].移植分离培养心脏sca-1+/CD31-可实现对心肌梗死损伤的有效修复[20].nanog是一种胚胎干细胞转录因子, 在维持干细胞多能性中发挥重要作用, 调控基因的转录并保持干细胞的未分化状态[21,22].CD73在细胞生长发育、纤维蛋白合成及免疫应答等方面均发挥重要作用[23], Boiret等[24]证实, CD73在细胞增殖方面具有一定的促进作用。前期我们研究发现, 表达nanog蛋白的心脏成纤维细胞可能更具有干细胞样特性[13], 且nanog在CD73+脂肪间充质干细胞 (adipose tissue-derived mesenchymal stem cells, ADMSCs) 中呈现强阳性表达[25], 且CD73+ADMSCs具有更强的向心肌分化能力[26].
为比较CFs在干细胞表达方面差异, 结合我们前期工作基础, 细胞免疫荧光对nanog、c-kit、sca-1、CD90和CD73表达情况进行分析, sca-1+所占比例最大, 其次为nanog+, 而c-kit、CD90和CD73阳性细胞所占比例下降。为检测CFs是否存在干细胞标记的共表达现象, 采取细胞荧光三标技术进行观察分析。结果显示, nanog+/CD73+共表达阳性率最高, 与其他3组相比差异均有极显着性;而nanog+/CD90+共表达CFs阳性率与nanog+/sca-1+之间差异没有显着性, CD90+/sca-1+共表达CFs阳性率均低于其他3组, 差异具有极显着意义。虽然这些干细胞标记物在成纤维细胞的表达存在差异, 但足以提示成纤维细胞具有显着的干细胞特性, 且干细胞标记存在重叠性表达现象, 至于它们在细胞增殖、心肌分化、心肌损伤修复等过程中的具体作用, 有待进一步探讨。
参考文献
[1]Van Tuyn J, Pijnappels DA, Vries AA, et al.Fibroblasts from human postmyocardial infarction scars acquire properties of cardiomyocytes after transduction with a recombinant myocardin gene[J].FASEB J, 2007, 21 (12) :3369-3379.
[2]Wang Z, Leisner TM, Parise LV.Platelet alpha2beta1 integrin activation:contribution of ligand internalization and the alpha2-cytoplasmic domain[J].Blood, 2003, 102 (4) :1307-1315.
[3]Eyre DR.Collagen:molecular diversity in the body's protein scaffold[J].Science, 1980, 207 (4437) :1315-1322.
[4]Johansson N, Ahonen M, Khri VM.Matrix metalloproteinases in tumor invasion[J].Cell Mol Life Sci, 2000, 57 (l) :5-15.
[5]Humphries MJ, Mc Ewan PA, Barton SJ, et al.Integrin structure:heady advances in ligand binding, but activation still makes the knees wobble[J].Trends Biochem Sci, 2003, 28 (6) :313-320.
[6]Chang Y, Li H, Guo Z.Mesenchymal stem cell-like properties in fibroblasts[J].Cell Physiol Biochem, 2014, 34 (3) :703-714.
[7]Chang Y, Guo K, Li Q, et al.Multiple directional differentiation difference of neonatal rat fibroblasts from six organs[J].Cell Physiol Biochem, 2016, 39 (1) :157-171.
[8]Mac Kenna D, Summerour SR, Villarreal FJ.Role of mechanical factors in modulating cardiac fibroblast function and extracellular matrix synthesis[J].Cardiovasc Res, 2000, 46 (2) :257-263.
[9]Goldsmith EC, Hoffman A, Morales MO, et al.Organization of fibroblasts in the heart[J].Dev Dyn, 2004, 230 (4) :787-794.
[10]Camelliti P, Green CR, Le Grice I, et al.Fibroblast network in rabbit sinoatrial node:structural and functional identification of homogeneous and heterogeneous cell coupling[J].Circ Res, 2004, 94 (6) :828-835.
[11]Strutz F, Okada H, Lo CW, et al.Identification and characterization of a fibroblast marker:FSP1[J].J Cell Biol, 1995, 130 (2) :393-405.
[12]Chin GS, Lee S, Hsu M, et al.Discoidin domain receptors andtheir ligand, collagen, are temporally regulated in fetal rat fibroblasts in vitro[J].Plast Reconstr Surg, 2001, 107 (3) :769-776.
[13]Lu Zh H, Chang YQ, Guo Zh K, et al.Expression of nanog protein in fibroblasts from multiple organs of the neonatal rat[J].Acta Anatomica Sinica, 2015, 46 (4) :495-501. (in Chinese) 鲁召辉, 常玉巧, 郭志坤, 等。新生大鼠多器官成纤维细胞nanog蛋白的表达差异[J].解剖学报, 2015, 46 (4) :495-501.
[14]Hagood JS, Prabhakaran P, Kumbla P, et al.Loss of fibroblast Thy-1 expression correlates with lung fibrogenesis[J].Am J Pathol, 2005, 167 (2) :365-379.
[15]Rege TA, Hagood JS.Thy-1, a versatile modulator of signaling affecting cellular adhesion, proliferation, survival, and cytokine/growth factor responses[J].Biochim Biophys Acta, 2006, 1763 (10) :991-999.
[16]Cheng K, Ibrahim A, Hensley MT, et al.Relative roles of CD90and c-kit to the regenerative efficacy of cardiosphere-derived cells in humans and in a mouse model of myocardial infarction[J].J Am Heart Assoc, 2014, 3 (5) :e001260.
[17]Ali SR, Ranjbarvaziri S, Talkhabi M, et al.Developmental heterogeneity of cardiac fibroblasts does not predict pathological proliferation and activation[J].Circ Res, 2014, 115 (7) :625-635.
[18]Leong KG, Wang BE, Johnson L, et al.Generation of a prostate from a single adult stem cell[J].Nature, 2008, 456 (7223) :804-808.
[19]Holmes C, Stanford WL.Concise review:stem cell antigen-1:expression, function, and enigma[J].Stem Cells, 2007, 25 (6) :1339-1347.
[20]Bradfute SB, Graubert TA, Goodell MA.Roles of Sca-1 in hematopoietic stem/progenitor cell function[J].Exp Hematol, 2005, 33 (7) :836-843.
[21]Silva J, Nichols J, Theunissen TW, et al.Nanog is the gateway to the pluripotent ground state[J].Cell, 2009, 138 (4) :722-737.
[22]Chambers I, Silva J, Colby D, et al.Nanog safeguards pluripotency and mediates germline development[J].Nature, 2007, 450 (7173) :1230-1234.
[23]Boiret N, Rapatel C, Veyrat-Masson R, et al.Characterization of nonexpanded mesenchymal progenitor cells from normal adult human bone marrow[J].Exp Hematol, 2005, 33 (2) :219-225.
[24]Beavis PA, Stagg J, Darcy PK, et al.CD73:a potent suppressor of antitumor immune responses[J].Trends Immunol, 2012, 33 (5) :231-237.
[25]Qi LJ, Guo Zh K, Li Q, et al.Expresssion of nanog protein in mouse CD73+adipose tissue derived mesenchymal stem cells[J].Acta Anatomica Sinica, 2012, 43 (5) :619-623. (in Chinese) 齐立杰, 郭志坤, 李琼, 等。Nanog蛋白在CD73+小鼠脂肪间充质干细胞中的表达[J].解剖学报, 2012, 43 (5) :619-623.
[26]Li Q, Qi LJ, Guo ZK, et al.CD73+adipose-derived mesenchymal stem cells possess higher potential to differentiate into cardiomyocytes in vitro[J].J Mol Histol, 2013, 44 (4) :411-422.