摘 要: 辅助性T淋巴细胞是机体免疫系统的重要组成部分,由来源于胸腺的CD4+纯真T细胞,在不同强度抗原刺激、不同细胞因子以及其他一些内环境因素的共同作用下,进一步分化出的多个功能亚群的混合体。这些功能亚群根据其激活所需的特异性转录因子、表达的不同细胞因子和归巢受体而定义。它们在机体感染、炎症反应、肿瘤、自身免疫性疾病以及过敏性疾病的发生发展中发挥重要的调节作用。本文将就辅助性T淋巴细胞亚群的分化机制、临床意义做一综述。
关键词: 辅助性T淋巴细胞亚群; 分化机制; 临床意义;
辅助性T(T helper,Th)淋巴细胞亚群是机体适应性免疫系统的关键组分,包括了在分子特征、产细胞因子、效应功能及组织分布上有所差异的一群细胞[1]。Th亚群细胞由胸腺CD4+Na6ve T细胞(纯真T细胞)在不同强度抗原刺激因素、不同内细胞因子及转录信号等诱导作用下进一步分化而来,并根据分化过程中激活的转录因子、表达的不同细胞因子和归巢受体而定义。目前研究较多的Th亚群主要是Th1、Th2、Th17、Treg、Th22、Th9和T滤泡辅助细胞(T follicular helper,Tfh)亚群[2,3]。Th细胞亚群是机体免疫系统重要的调节器,在适应性免疫调节反应中,它们既参与细胞毒性细胞免疫应答调节,又介导B细胞依赖性抗体的产生,还能与固有免疫系统组分相互作用。研究显示,与树突状细胞(dendritic cell,DC)接触进而产生的细胞因子决定了Th细胞亚群的分化方向[4]。Th细胞亚群是宿主免疫防御的关键因素,也是免疫介导疾病的主要驱动分子,其通过产生一系列细胞因子,参与感染、炎症、过敏性疾病、自身免疫性疾病以及肿瘤等疾病的发生发展[2,5,6]。
细胞因子决定了Th亚群的分化方向,而分化的亚群细胞通过产生不同的细胞因子参与疾病进展;各亚群之间保持平衡维持了机体健康状态,失衡则将导致疾病状态[6]。本文将就Th亚群特点、分化机制、效应机制及其与临床疾病的关系进行综述,以期了解Th细胞亚群的临床价值。

1、 Th细胞亚群的分化机制
1.1、 Th1细胞
白细胞介素(interleukin,IL)-12是Na6ve T细胞向Th1分化的关键因子,γ干扰素(interferon gamma,IFN-γ)也同样发挥了重要的作用,并且IFN-γ还在消除IL-12促分化极化,维持亚群数量平衡方面发挥了作用[7]。机体感染细菌、真菌和病毒,均可诱导Na6ve T细胞分化为Th1。在DC细胞吞噬病原体后提取和递呈抗原肽给T细胞时,即产生和分泌IFN-γ和IL-12,二者调动和协调机体固有免疫和适应性免疫应答反应的同时,也促使Na6ve T向Th1细胞分化。最初,Th1的分化主要依赖DC分泌的IFN-γ和IL-12,分别通过STAT 1和STAT 4信号转导和转录因子通路介导实现。随后,分化出的Th1细胞在上述细胞因子及其胞内信号通路作用下,激活调节转录因子T-bet进而产生大量的IFN-γ,二者相互作用的正反馈调节环路,产生Th1分化的级联放大效应[8]。在Th1分化后期,借助IL-12/STAT 4信号通路,Th1细胞膜表面IL-18Rα受体上调,进一步促进了IFN-γ的产生进而分化出更多的Th1细胞。上述通过细胞因子及其信号通路促进Th1细胞分化的过程,是不依赖于T细胞受体的,这种非抗原依赖的纯细胞因子效应途径是Th1分化的重要机制。Th1主要产生IFN-γ,通过活化巨噬细胞介导机体细胞免疫调节。
1.2 、Th2细胞
促使Na6ve T细胞向Th2分化的细胞因子是IL-4,其通过STAT 6信号通路介导Th2细胞的分化,主要受转录调节因子GATA3调控。这条控制细胞分化的信号通路也同Th1的STAT 1和STAT 4信号通路一样,具有自我激活的正反馈调节效应,表现为Th2分化的级联放大反应[9]。当DC细胞表达配体Jagged-1时,就会触发Na6ve T细胞产生IL-4。此外,研究发现,被蠕虫感染的动物肠道中的肥大细胞和巨噬细胞,以及肺上皮细胞均能产生IL-25,其能进一步诱导动物Na6ve T细胞产生IL-4,进而引发Th2极化[10]。Th2细胞可以产生IL-4、IL-5和IL-13,前两者可诱导趋化、激活嗜酸性粒细胞和肥大细胞,进而导致组胺、前列腺素、白三烯等炎症因子的触发和释放,这些炎症因子作用于局部使血管扩张和渗漏、支气管收缩以及肠蠕动增强,即发生过敏反应,此种类型的过敏反应又称为即时超敏反应。即时超敏反应对于消除肠道蠕虫非常重要,实际上蠕虫卵能够强烈的诱导Th2分化[11]。Th2也参与机体变态反应和过敏反应,例如哮喘和过敏。
1.3 、Th17细胞
Th17细胞系是近年来发现的独立于Th1及Th2以外的新T细胞亚群,由Na6ve T细胞在IL-6和转化生长因子(transforming growth factor,TGF)-β作用下分化而来,该过程主要受STAT3、Smad信号通路和视黄酸受体相关孤儿受体RORγt等转录因子调控[12]。此外还有其他一些细胞因子参与调节Th17的生成,如IL-1β、TNF-α能够增强IL-6和TGF-β对Th17的促分化作用,IL-23也在Th17的增殖和维持方面发挥了正向作用[13];与此相反,Th1、Th2产生的细胞因子如IFN-γ和IL-4以及其他一些STAT1激活途径生成的细胞因子如IL-27,均能抑制Th17的分化。Th17亚群本身以分泌IL-17家族细胞因子(主要是IL-17A及IL-17F)为特点,同时也能产生IL-22和粒细胞巨噬细胞刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF),后者对中性粒细胞和单核细胞有趋化效应。
1.4 、Treg细胞
Treg细胞即调节T细胞(the regulatory T cell),由Na6ve T在TGF-β单独诱导作用下,主要通过转录因子Foxp3调控分化而来。Treg和Th17两个亚群相互对抗,若TGF-β和IL-6同时存在,Treg分化受抑,Th17会成为优势亚群。对Treg的免疫识别研究显示,Treg细胞强表达CD4,同时表达CD25、CD127low和胞浆Foxp3,可以利用这些胞内外标志物对其识别和研究[14,15]。Treg细胞的稳定性受其来源影响,一般来源于胸腺的Treg细胞较为稳定;而来源于外周血经TGF-β诱导而来的iTreg稳定性欠佳。Treg的功能主要是维持免疫耐受,它可以通过细胞间接触,释放如IL-10、TGF-β等抑制性细胞因子的方式抑制效应T细胞及抗原递呈细胞的功能,从而发挥免疫抑制效应[14,15]。机体的Treg和Th17保持着动态平衡以维持机体免疫自稳。
1.5 、Th22细胞
Th22是在对IL-22来源细胞的研究中发现的新CD4+T细胞亚群,起初被认为是Th17的一个分支群,但实际上Th22是不同于Th17的一个独立亚群。一项对Th22和经典的Th17转录组比对分析结果表明,二者有超过600个差异基因表达,Th22转录组与以往被描述为“致病性Th17”细胞高度相似,以高表达IL-23R、STAT4和T-bet等致病相关基因为特点,而经典的Th17则与过去所谓的“非致病性Th17”类似[16]。IL-22是IL-10因子家族成员,通过作用于皮肤、呼吸道及消化道上皮细胞介导机体的皮肤粘膜屏障抗感染效应。过去普遍认为IL-22主要由Th17细胞产生,但Duhen等[17]在一项人类皮肤免疫的研究中发现,一群大量产生IL-22但不产生IL-17的非Th17细胞,即Th22细胞。上述研究均证实Th22细胞群的独立性。Th22的诱导因子也是TGF-β和IL-6,但Na6ve T细胞发育为Th22还是Th17主要由TGF-β和IL-6的相对浓度决定。在高浓度IL-6和低浓度TGF-β环境下,Na6ve T细胞更易分化为Th22,反之则为Th17。借助IL-22、IL-13、TNF-α以及皮肤归巢受体CCR10等细胞因子的产生,Th22主要在调节皮肤稳态,参与呼吸道、消化道等腔道免疫保护,以及调控上皮组织免疫相关炎症中起作用[18]。
1.6、 Th9细胞
Th9细胞是一群以产生细胞因子IL-9为主要特点的辅助T细胞亚群,于20世纪80年代末首次被报道[19]。Th9的体内诱导机制复杂,目前仍不十分明确,但体外实验显示,Th9主要由Na6ve T细胞在TGF-β和IL-4的作用下诱导分化而来,但仅有一小部分细胞对此种诱导敏感,因此Th9细胞群数量极少[20]。在仅有TGF-β或IL-4存在的情况下,Na6ve T细胞分化为Treg或Th2;而当二者同时作用于Na6ve T细胞时,IL-4通过负调节FOX3转录因子抑制Treg分化,TGF-β又抑制Th2亚群分化,在同时抑制Treg和Th2分化机制下,Th9分化得以实现[21]。也有研究发现,有部分Th2通过自我关闭IL-4的表达而转化为Th9,这说明Th2与Th9之间有着某种潜在的联系[22]。与前述辅助性T细胞亚群都有明确的诱导信号通路不同,目前尚未发现Th9转化相关特异性信号通路,故推测Th9的转化是多条信号通路叠加参与的结果。目前已明确肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)超家族的共刺激分子,如Ox40、糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)和死亡受体(death receptor,DR)3等参与了Th9的诱导分化过程[23]。
1.7、 Tfh细胞
T滤泡辅助细胞(T follicular helper cells,Tfh)是一种特殊类型的CD4+T细胞,在生发中心反应中发挥维持B细胞记忆和辅助B细胞产生抗体的作用。Tfh细胞主要特点为表达CXC趋化因子受体(CXC chemokine receptor,CXCR)5、诱导共刺激分子(induced costimulatory molecules,ICOS)、程序化死亡因子(programmed death factor,PD)-1、Bcl-6和IL-21[24]。Tfh的分化受Bcl-6、IRF4、c-Maf、Batf以及STAT3/5等主要转录因子参与的复杂转录网调节,其也可由其他效应T细胞转化而来,例如在病毒感染期间Th1细胞就可转化为Tfh细胞[24,25]。效应T细胞转化为Tfh的具体机制尚不清楚。
2、Th细胞亚群功能与临床疾病
2.1、 Th1/Th2
Th1、Th2功能细胞亚群是最早被描述的辅助性T细胞亚群,在过去的数十年里得到了较为充分的研究。Th1主要参与细胞免疫调节,通过产生高水平的IFN-γ,参与吞噬细胞的活化,通过调理吞噬作用以及补体固定抗体,在机体抗病毒或胞内病原微生物感染以及消除肿瘤细胞中发挥用。此外Th1也介导机体炎症反应和迟发型超敏反应,与一些自身免疫疾病,如自身免疫性脑炎和机体慢性炎症反应,如胶原相关关节炎和炎症性肠病有关[26]。Th2主要介导体液免疫调节,通过促进抗体的产生对抗胞外病原体(如寄生虫感染),并在过敏反应的发生发展以及异种移植和妊娠过程中的免疫耐受方面发挥作用。Th1主要通过产生IFN-γ发挥其生理功能,Th2则主要产生IL-4发挥效应。生理情况下二者相对稳定,受到相互抑制和自分泌的转录和信号因子的调节。病理情况下稳态打破,表现为某亚型优势参与疾病发展。
在病毒感染性疾病中,HBV感染所致慢性肝炎、活动性肝炎后肝硬化及慢性重症肝炎等情况下常表现为Th1亚群优势[27],而HCV隐匿性感染和HIV感染后AIDS进展后期则以Th2应答为主[28,29]。在细菌性脓毒血症患者中,表现为Th2优势应答的患者临床进展更快、死亡率更高[30]。在机体抗肿瘤免疫方面,适应性免疫细胞中的Th细胞通过产生IFN-γ直接杀伤或招募激活NK或巨噬细胞等间接方式对抗肿瘤细胞,以Th1应答为主的患者预后更好[31]。
2.2、 Th17/Treg
Th17主要诱导机体的炎症反应,参与自身免疫性疾病的发生发展。Treg则主要发挥免疫抑制作用,在机体免疫自稳过程中意义重大,机体Treg不足将更容易发生自身免疫性疾病。正常情况下,Th17/Treg保持着动态平衡,在机体免疫防御、炎症反应和免疫耐受等方面发挥效应。
在机体细菌和真菌感染后,Th17能通过直接产生GM-CSF招募和激活中性粒细胞和单核细胞,或间接诱导患者CSF和CXCL8发挥抗感染作用,而在特应性皮炎、克罗恩病、牛皮癣和多发硬化症的患者中发现升高的Th17,均提示其参与了自身免疫性疾病和炎症反应[13]。研究对Th17在肿瘤免疫方面的作用结论不一,患者的转归与肿瘤类型有关,有可能成为未来肿瘤免疫治疗的靶点[32]。而Treg则是明确的肿瘤免疫障碍成分,是肿瘤细胞免疫逃逸的重要帮凶。在肿瘤发生早期,Treg通过直接抑制实体瘤局部的免疫效应细胞帮助肿瘤进展;在肿瘤发生后期,Treg通过自身系统上调,抑制机体对转移瘤的免疫效应,促进肿瘤转移。因此,减少Treg细胞和控制其功能以增加抗肿瘤免疫应答是肿瘤免疫治疗领域潜在的靶点[33]。机体Th17/Treg相互作用调节,维持机体免疫稳态,在疾病状态下二者调节失衡,疾病则表现出进展状态。如在肿瘤患者中表现出Treg优势的患者更易复发和转移[33]。在细菌性脓毒血症患者中,外周血Treg细胞升高、Th17减少者更易进展为创伤性休克[34]。
2.3 、Th22、Th9和Tfh细胞
Th22主要通过产生IL-22发挥生物学效应。IL-22是IL-10家族成员,通过作用于上皮细胞、胰腺细胞、肝细胞和某些类型的成纤维细胞,介导宿主防御侵袭性病原体。在炎症性肠病、哮喘、系统性硬化症和类风湿性关节炎等自身免疫病或过敏性疾病中均可见IL-22的升高,但效应不一,既可能抑制炎症反应,也可能促进疾病进展,这取决于内环境和疾病阶段[35,36]。此外有研究报道在肿瘤患者中也观察到Th22和其效应分子IL-22的变化,提出其可能是未来肿瘤免疫治疗的潜在靶点[37]。
Th9通过IL-9主要参与自身免疫性疾病和过敏性疾病的发生发展[38]。IL-9在免疫系统中具有许多重要的功能,它促进T细胞和肥大细胞的存活和增殖,刺激多种细胞因子的产生,并调节B细胞的反应,其在抗肿瘤中也有一定作用[39,40]。Th9细胞也能产生IL-10和IL-21,但其功能尚待阐明。
Tfh与其他T辅助细胞亚群不断迁移出淋巴结生发中心区不同,它驻留原处发挥维持B细胞记忆和辅助B细胞产生抗体的效应,CXCR5受体可能与此有关,其也是Tfh独特的免疫标志物[24]。目前Tfh与其他淋巴亚群的关系尚不清楚,还需要更多研究。
3 、小结
在不同刺激因素或细胞因子作用下,胸腺CD4+Na6ve T细胞分化为不同的Th亚群,这些亚群进一步分泌不同细胞因子产生多种免疫效应(见图1)。生理状态下,机体内的Th细胞亚群保持着动态平衡,维持正常免疫调节功能。当感染、炎症、肿瘤等疾病发生时,Th亚群受到抗原刺激,在细胞因子作用下亚群分化平衡被打破,免疫调节功能失调,疾病进展;经过治疗,亚群平衡恢复,疾病好转(见表1)。通过对亚群表面标志物和其产生的细胞因子的检测,能够了解健康和疾病状态下亚群的分布状态,有助于疾病诊断,病情的严重程度和疗效判断。积极开展淋巴细胞亚群在不同疾病状态下的深入研究,对于深入认识疾病发展规律以及新治疗策略的探索极具意义。
图1 Th细胞亚群分化机制及细胞功能示意图
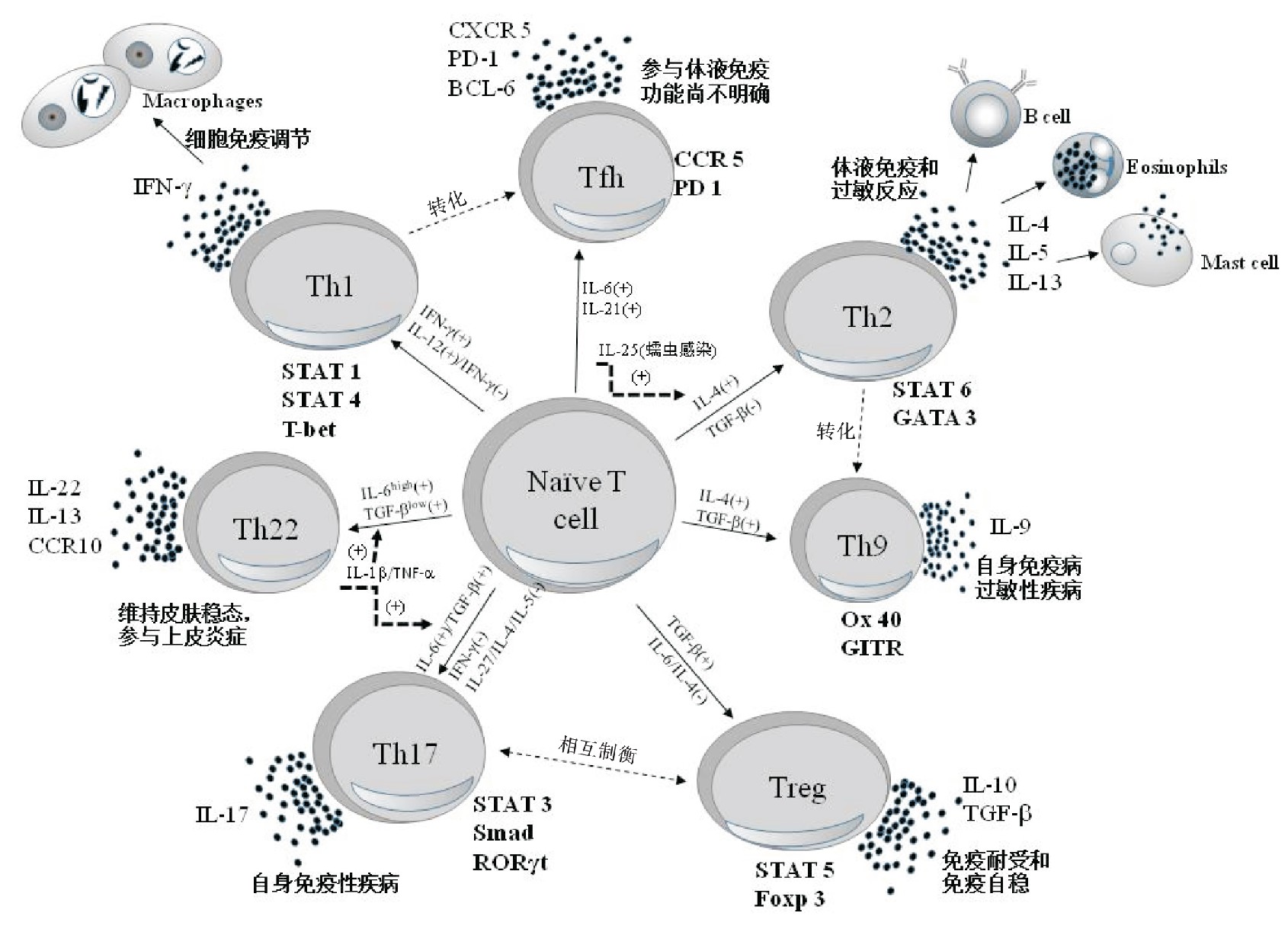
表1 Th亚群与临床疾病

参考文献
[1] Read K A,Powell M D,Sreekumar B K,et al.In vitro differentiation of effector CD4+T helper cell subsets[J].Methods Mol Biol,2019,1960:75-84.
[2] Zhu J.T Helper cell differentiation,heterogeneity,and plasticity[J].Cold Spring Harb Perspect Biol,2018,10(10):a030338.
[3]Morel P A.Differential T-cell receptor signals for Thelper cell programming[J].Immunology,2018,155(1):63-71.
[4]Schmitt N,Ueno H.Regulation of human helper T cell subset differentiation by cytokines[J].Curr Opin Immunol,2015,34:130-136.
[5]Raphael I,Nalawade S,Eagar T N,et al.T cell subsets and their signature cytokines in autoimmune and inflammatory diseases[J].Cytokine,2015,74(1):5-17.
[6]Ivanova E A,Orekhov A N.T helper lymphocyte subsets and plasticity in autoimmunity and cancer:an overview[J].Biomed Res Int,2015,2015:327470.
[7] Zhang Y,Zhang Y,Gu W,et al.TH1/TH2cell differentiation and molecular signals[J].Adv Exp Med Biol,2014,841:15-44.
[8] Espinosa V,Rivera A.Cytokines and the regulation of fungus-specific CD4Tcell differentiation[J].Cytokine,2012,58(1):100-106.
[9]Ouyang W,L9hning M,Gao Z,et al.Stat6-independent GATA-3 autoactivation directs IL-4-independent Th2development and commitment[J].Immunity,2000,12(1):27-37.
[10] Owyang A M,Zaph C,Wilson E H,et al.Interleukin25regulates type 2cytokine-dependent immunity and limits chronic inflammation in the gastrointestinal tract[J].JExp Med,2006,203(4):843-849.
[11] Pearce E J,Caspar P,Grzych J M,et al.Pillars article:downregulation of Th1cytokine production accompanies induction of Th2responses by aparasitic helminth[J].JImmunol,2012,189(3):1104-1111.
[12] Korn T,Bettelli E,Oukka M,et al.IL-17and Th17Cells[J].Annu Rev Immunol,2009,8(1):485-517.
[13]Girolomoni G,Strohal R,Puig L,et al.The role of IL-23and the IL-23/TH 17immune axis in the pathogenesis and treatment of psoriasis[J].J Eur Acad Dermatol Venereol,2017,31(10):1616-1626.
[14] Abbas A K,Benoist C,Bluestone J A,et al.Regulatory T cells:recommendations to simplify the nomenclature[J].Nat Immunol,2013,14(4):307-308.
[15] Sakaguchi S,Miyara M,Costantino C M,et al.FOXP3+regulatory T cells in the human immune system[J].Nat Rev Immunol,2010,10(7):490-500.
[16] Coombes J L,Siddiqui K R,Arancibia-Crcamo C V,et al.A functionally specialized population of mucosal CD103+DCs induces Foxp3+regulatory T cells via a TGF-beta and retinoic acid-dependent mechanism[J].JExp Med,2007,204(8):1757-1764.
[17] Duhen T,Geiger R,Jarrossay D,et al.Production of interleukin 22but not interleukin 17by a subset of human skin-homing memory T cells[J].Nat Immunol,2009,10(8):857-863.
[18]Basu R,Hatton R D,Weaver C T.The Th17family:flexibility follows function[J].Immunol Rev,2013,252(1):89-103.
[19] Li J,Chen S,Xiao X,et al.IL-9and Th9cells in health and diseases-from tolerance to immunopathology[J].Cytokine Growth Factor Rev,2017,37:47-55.
[20] Malik S,Awasthi A.Transcriptional control of Th9cells:role of Foxo1in interleukin-9induction[J].Front Immunol,2018,9:995.
[21] Dardalhon V,Awasthi A,Kwon H,et al.IL-4inhibits TGF-beta-induced Foxp3+T cells and,together with TGF-beta,generates IL-9+IL-10+Foxp3(-)effector T cells[J].Nat Immunol,2008,9(12):1347-1355.
[22] Veldhoen M,Uyttenhove C,van Snick J,et al.Transforming growth factor-beta'reprograms'the differentiation of T helper 2cells and promotes an interleukin 9-producing subset[J].Nat Immunol,2008,9(12):1341-1346.
[23] Kaplan M H.The transcription factor network in Th9cells[J].Semin immunopathol,2017,39(1):11-20.
[24] Jogdand G M,Mohanty S,Devadas S.Regulator of Tfh cell differentiation[J].Front Immunol,2016,7:520.
[25]Liu X,Nurieva R I,Dong C.Transcriptional regulation of follicular T-helper (Tfh)cells[J].Immunol Rev,2013,252(1):139-145.
[26]Hirahara K,Poholek A,Vahedi G,et al.Mechanisms underlying helper T-cell plasticity:implications for immune-mediated disease[J].J Allergy Clin Immunol,2013,131(5):1276-1287.
[27]Li M H,Zhang D,Zhang L,et al.Ratios of T-helper 2cells to T-helper 1cells and cytokine levels in patients with hepatitis B[J].Chin Med J (Engl),2017,130(15):1810-1815.
[28]Mousa N,Eldars W,Eldegla H,et al.Cytokine profiles and hepatic injury in occult hepatitis C versus chronic hepatitis C virus infection[J].Int J Immunopathol Pharmacol,2014,27(1):87-96.
[29] Gorenec L,Zidovec Lepej S,Grgic I,et al.The comparison of Th1,Th2,Th9,Th17and Th22cytokine profiles in acute and chronic HIV-1infection[J].Microb Pathog,2016,97:125-130
[30] Gupta D L,Bhoi S,Mohan T,et al.Coexistence of Th1/Th2and Th17/Treg imbalances in patients with post traumatic sepsis[J].Cytokine,2016,88:214-221.
[31]Vesely M D,Kershaw M H,Schreiber R D,et al.Natural innate and adaptive immunity to cancer[J].Annu Rev Immunol,2011,29:235-271.
[32] Chang S H.T helper 17(Th17)cells and interleukin-17(IL-17)in cancer[J].Arch Pharm Res,2019,42(7):549-559.
[33] Ohue Y,Nishikawa H.Regulatory T (Treg)cells in cancer:can treg cells be a new therapeutic target[J].Cancer Sci,2019,110(7):2080-2089.
[34] Lanca T,Silva-Santos B.The split nature of tumor-infltrating leukocytes:implications for cancer surveillance and immunotherapy[J].Oncol Immunol,2012,1(5):717-725.
[35] Tang M S,Bowcutt R,Leung J M,et al.Integrated analysis of biopsies from inflammatory bowel disease patients identifies SAA1as a link between mucosal microbes with TH17and TH22cells[J].Inflamm Bowel Dis,2017,23(9):1544-1554.
[36]Tamasauskiene L,Sitkauskiene B.Role of Th22and IL-22in pathogenesis of allergic airway diseases:proinflammatory or anti-inflammatory effect[J].Pediatr Neonatol,2018,59(4):339-344.
[37] Jia L,Wu C.The biology and functions of Th22cells[J].Adva Exp Med Biol,2014,841:209-230.
[38] Deng Y,Wang Z,Chang C,et al.Th9cells and IL-9in autoimmune disorders:pathogenesis and therapeutic potentials[J].Hum Immunol,2017,78(2):120-128.
[39] Koch S,Sopel N,Finotto S.Th9and other IL-9-producing cells in allergic asthma[J].Semin Immunopathol,2017,39(1):55-68.
[40] Chauhan S R,Singhal P G,Sharma U,et al.Th9cytokines curb cervical cancer progression and immune evasion[J].Hum Immunol,2019,80(12):1020-1025.