摘 要: 光诱导技术是一种新兴的基因表达调控技术,目前已应用于原核细胞、哺乳动物和鱼类细胞。为探索光诱导技术在昆虫细胞基因表达系统中的调控功能,采用具有代表性的C120-EL222光诱导系统,在昆虫细胞表达质粒pMIB/V5-His的基础上,构建了集光诱导外源基因表达框与光激活转录因子于一体的昆虫细胞光诱导表达载体pMIB-C120-GOI-GFP-EL222质粒。将上述质粒转染昆虫Sf9细胞,通过检测光诱导产生的红色荧光蛋白(mCherry)或海参荧光素酶(hRluc)报告基因的表达,对光诱导元件的功能进行了定性和定量分析。结果表明,C120-EL222光诱导系统在昆虫Sf9细胞中具有较高的效能和严谨性,为光诱导表达技术在昆虫细胞基因表达调控中的深入研究和应用奠定了基础。
关键词: 光诱导技术; 昆虫细胞系; 基因表达调控; 报告基因;
Abstract: Light-induction is a new technique of gene expression regulation.However,its application is limited to prokaryotic cells and mammalian and fish cells.In order to explore the functional effectiveness of light induction technology in insect cell lines,a representative C120-EL222 light induction system was adopted in this study.On the basis of insect cell expression plasmid pMIB/V5-His,the pMIB-C120-GOI-GFP-EL222 plasmid,which integrates the expression frame of exogenous gene induced by light and the transcription factor activated by light,was constructed.The above plasmids were transfected into insect Sf9 cells,and the expression of the light-induced red fluorescent protein(mCherry) or humanized Renilla luciferase(hRluc) reporter gene was detected after light induction,and the function of the light-induced elements was detected qualitatively and quantitatively.The experimental results showed that the C120-EL222 light induction system had high efficiency and preciseness in insect Sf9 cells.This study expands the application scope of the light-induced expression technology and lays a foundation for further research and application of the light-induced expression technology in insect cells.
Keyword: Light-induction technology; insect cell; gene expression regulation; reporter gene;
昆虫细胞表达系统因其表达重组蛋白效率高、生产成本低、蛋白翻译后修饰等优点[1],被广泛应用于功能性重组蛋白、人或兽用疫苗以及基因治疗用重组腺相关病毒载体(rAAV)等的生产[2,3],如β干扰素、人乳头瘤病毒疫苗的抗原L1蛋白、猪圆环病毒2型疫苗的抗原Cap蛋白及1型rAAV载体药物Glybera等[4,5,6]。昆虫细胞表达系统主要有两种类型,一种是在昆虫杆状病毒感染的情况下,利用昆虫杆状病毒晚期基因强启动子(如P10、PH等)实现外源基因大量表达,最常用有Bac-to-Bac系统[7];另一种是在没有杆状病毒感染的情况下,利用昆虫细胞建立的稳定细胞系,通过昆虫细胞特异性启动子(如OpIE1、OpIE2等)实现外源基因的大量表达[8]。利用昆虫细胞表达特殊蛋白复合体或具有细胞毒性蛋白时,常规表达调控方法并不适合。因此,需要在时间、空间和表达强度方面具有更灵活精确的基因表达调控方法。过去20多年来,四环素诱导表达系统、甲醇诱导表达系统等依赖小分子化合物调控的系统,常用于时间维度的基因表达调控[9]。组织细胞特异性启动子常用于特定空间尺度的基因表达控制,但严谨性通常不高。
光诱导转录调控技术可用于基因表达的空间和时间双重精准控制[10,11]。当前的光诱导表达系统仍存在一些缺点限制着它的应用,例如蛋白本身的毒性、调控范围有限以及激活和去激活作用迟缓。2014年,Motta-Mena等建立了C120-EL222光诱导转录调控系统[12]。其原理是在蓝光(波长450nm左右)照射下,含有工程化改造的光-氧-电压(Light-Oxygen-Voltage,LOV)蛋白亚基的光诱导转录因子(EL222)发生二聚化,结合到相应的DNA序列C120调节元件上,启动目的基因的转录与表达;在无光照条件下,这些结构变化能够自动逆转,使EL222脱离结合的DNA启动子序列,从而关闭基因的表达[13](图1A)。在哺乳动物HEK293细胞中,C120-EL222光诱导表达系统可以产生200倍以上的基因表达上调,具有快速活化(<10 s)和失活动力学(<50 s)。研究表明该系统在斑马鱼中也具有功能,但是EL222蛋白对斑马鱼胚胎发育具有一定的毒性[12]。
目前还没有光诱导表达技术在昆虫细胞中应用的报道。本研究在昆虫细胞中对具有代表性的C120-EL222光诱导元件进行基因表达调控功能检测,首次证实了C120-EL222光诱导表达系统在昆虫细胞中具有功能,进一步扩展了该光诱导表达系统的适用范围。
1 、材料与方法
1.1 、材料
1.1.1 、主要试剂
限制性内切酶、T4 DNA连接酶,NEB公司产品;Cellfectin Ⅱ Reagent 转染试剂,Invitrogen 公司产品;Grace昆虫细胞培养基、胎牛血清(FBS),GIBCO公司产品;Gel Extraction kit胶回收试剂盒、Plasmid mini kit质粒提取试剂盒,OMEGA公司产品;Renilla Luciferase Assay System荧光素酶试剂盒,Promega公司产品。
1.1.2 、主要仪器
PCR热循环仪(K960),力康(Heal Force)生物医疗科技控股有限公司产品;恒温培养箱(ZXJD-A1270)上海智城公司产品;多功能酶标仪(EnSpire),珀金埃尔默(PerkinElmer)公司产品;倒置荧光显微镜(IX71),奥林巴斯(Olympus)公司产品。
1.1.3、 载体与合成基因
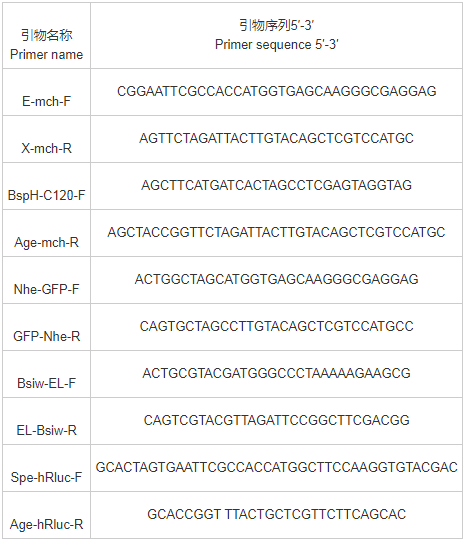
质粒pC120-Luc和pVP-EL222由Kevin H.Gardner教授馈赠,质粒pMIB/V5-His购自Invitrogen公司。引物序列见表1。
表1 引物序列表
1.2 、方法
1.2.1、 载体构建
首先,用引物E-mch-F和X-mch-R扩增mCherry基因,插入到pC120-Luc质粒的EcoRⅠ和XbaⅠ酶切位点之间,得到pC120-mCherry质粒。再用引物BspH-C120-F和Age-Mch-R扩增C120-mCherry片段,插入pMIB/V5-his载体的BspHⅠ和AgeⅠ酶切位点之间,得到pMIB-C120-mCherry质粒。然后,在携带有合成基因片段PFT2AN的质粒pSimple-T/PFT2AN中的NheⅠ酶切位点和BsiwⅠ酶切位点,分别引入由引物Nhe-GFP-F和GFP-Nhe-R扩增的GFP基因和由引物Bsiw-EL-F和EL-Bsiw-R扩增的 EL222基因,得到psimple-T/ GFP-EL222质粒。再将GFP-EL222片段插入到pMIB-C120-mCherry质粒的PvuⅡ和BglⅡ酶切位点之间,得到pMIB-C120-mCherry-GFP-EL222质粒,利用SpeⅠ和AgeⅠ酶切位点将其mCherry基因置换成由引物Spe-hRluc-F和Age-hRluc-R扩增的hRluc基因,得到pMIB-C120-hRluc-GFP-EL222质粒。最后,用BsiwⅠ酶切去除上述质粒中的EL222基因,得到功能缺失的对照质粒pMIB-C120-mCherry-GFP和pMIB-C120-hRluc-GFP。
1.2.2、 昆虫Sf9细胞培养与质粒转染
昆虫Sf9细胞来源于草地贪夜蛾(Spodoptera frugiperda)卵巢细胞系,采用含有100 mL/L FBS的Grace完全培养基贴壁培养在10 cm培养皿中,培养温度28℃。转染前将Sf9细胞按每孔8×105个细胞的密度接种于6孔板中,当细胞汇合度达到70%~80%时,用Cellfectin Ⅱ转染试剂进行质粒转染。转染24 h后,给予蓝光照射诱导并观察细胞状态。
1.2.3、 昆虫Sf9细胞的光照射诱导与报告基因检测
光照射诱导组(试验组)处理方法:将6孔板中培养的Sf9细胞在28℃培养箱中避光培养,在转染质粒24 h后,用蓝色LED光板(波长465 nm左右)对 6孔板透明培养底板壁培养的Sf9细胞给予蓝光光照(通过时间控制器设置光照循环条件为:蓝光照射20 s停60 s为一个循环,持续诱导24 h)。黑暗无光照组(对照组)处理方法:将6孔板中培养的Sf9细胞在28℃培养箱中全程避光培养。用荧光显微镜直接实时监测荧光蛋白的表达情况,或将待测Sf9细胞样品进行裂解处理,使用荧光素酶试剂盒试剂检测hRluc酶的活性,酶标仪检测读数。
2、 结果
2.1 、昆虫细胞光诱导表达载体的构建
在昆虫细胞表达载体pMIB/V5-His质粒骨架基础上,构建了pMIB-C120-GOI-GFP-EL222昆虫光控表达载体,以及相应的激活阴性对照载体pMIB-C120-GOI-GFP(图1B)。为了便于检测C120元件的激活,选用了红色荧光蛋白(mCherry)和海参荧光素酶(hRluc)2种报告基因作为目的外源基因(gene of interest,GOI)。mCherry可以活细胞状态下实施定性观察,而hRluc与底物作用产生的信号具有很好的线性关系便于定量检测。为此,采用经典的分子克隆技术按照方法中所述的步骤进行目标载体的构建。最终,构建了2种光控报告基因表达载体pMIB-C120-mCherry-GFP-EL222和pMIB-C120-hRLuc-GFP-EL222,以及相应的光激活阴性对照载体pMIB-C120-mCherry-GFP和pMIB-C120-hRLuc-GFP(图1B)。
2.2、 光控表达载体的酶切与测序鉴定
对构建的2种光控报告基因表达载体pMIB-C120-mCherry-GFP-EL222 和pMIB-C120- hRLuc-GFP-EL222,以及相应的激活阴性对照载体pMIB-C120-mCherry-GFP和pMIB-C120-hRLuc-GFP质粒进行酶切鉴定。 从琼脂糖凝胶电泳结果可以看出,泳道1和2释放出了约720 bp的mCherry基因片段,泳道3和4释放出了约950 bp的hRluc基因片段,泳道5和7释放出了约900 bp的EL222基因片段,符合预期结果(图2)。进一步对构建的载体质粒进行的基因测序证明序列正确。
图1 光诱导表达载体示意图
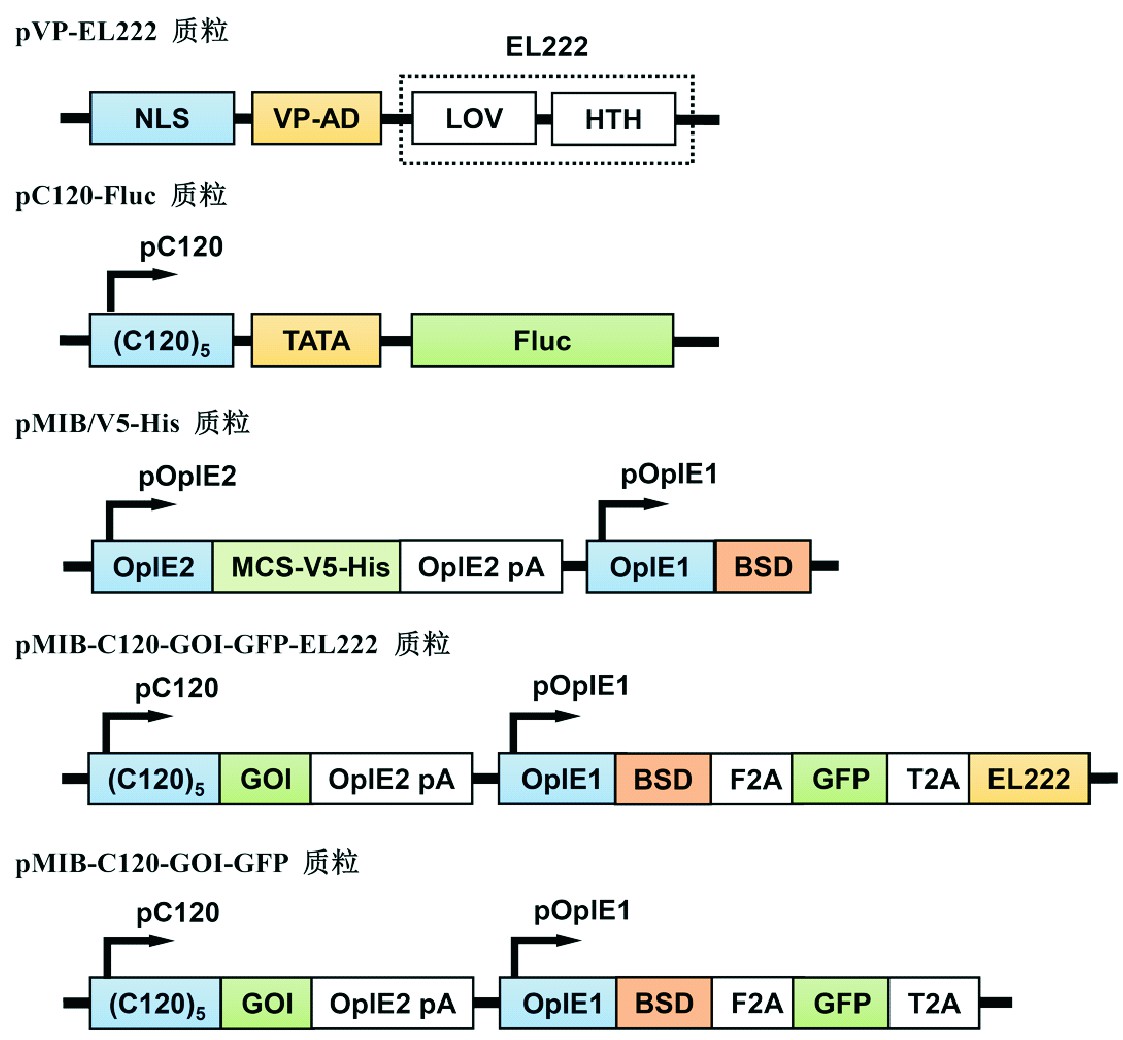
Fig.1 Schematic diagram of light-induced expression vectors
图2 含有报告基因的昆虫细胞光诱导表达质粒载体的酶切鉴定
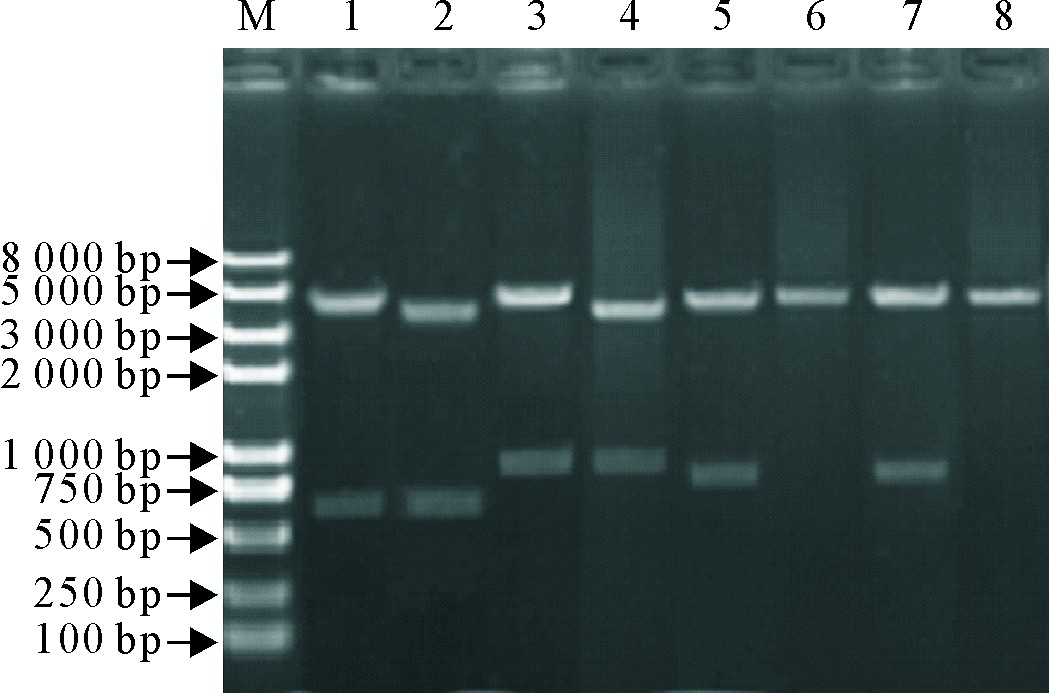
Fig.2 Identification of insect cell light-induced expression vector contained reporter genes by restriction enzyme digestion
1、5.分别为pMIB-C120-mCherry-GFP-EL222质粒用SpeⅠ和AgeⅠ双酶切,用Bsi wⅠ单酶切;2、6.分别为pMIB-C120-mCherry-GFP质粒用SpeⅠ和AgeⅠ双酶切,用Bsi wⅠ单酶切;3、7.分别为pMIB-C120-hRluc-GFP-EL222质粒用SpeⅠ和AgeⅠ双酶切,用BsiwⅠ单酶切;4、8.分别为pMIB-C120-hRluc-GFP质粒用SpeⅠ和AgeⅠ双酶切,用Bsi wⅠ单酶切。
1,5.pMIB-C120-mCherry-GFP-EL222double digestion with SpeⅠand AgeⅠ,and single digestion with Bsi wⅠ,respectively;2,6.pMIB-C120-mCherry-GFP double digestion with SpeⅠand AgeⅠ,and single digestion with Bsi wⅠ,respectively;3,7.pMIB-C120-hRluc-GFP-EL222double digestion with SpeⅠand AgeⅠ,and single digestion with BsiwⅠ,respectively;4,8.pMIB-C120-hR-luc-GFP double digestion with SpeⅠand AgeⅠ,and single digestion with Bsi wⅠ,respectively.
2.3、 光诱导表达载体在昆虫Sf9细胞中的功能检测
2.3.1、 光诱导表达红色荧光蛋白的检测
在6孔板中培养的Sf9细胞分别转染pMIB-C120-mCherry-GFP-EL222质粒和pMIB-C120-mCherry-GFP质粒,28℃孵育24 h后,再施加光照与黑暗两种条件,24 h后荧光显微镜下观察细胞荧光蛋白的表达。结果显示,试验组质粒pMIB-C120-mCherry-GFP-EL222转染Sf9细胞24 h后,黑暗无光继续培养24 h,由组成性启动子OpIE1调控的GFP有明显表达,由光诱导启动子C120调控的mCherry无表达;而再经过蓝光照射诱导24 h,由OpIE1调控的GFP有明显表达,由C120调控的mCherry也有明显的表达。对照组质粒pMIB-C120-mCherry-GFP转染Sf9细胞24 h后,再经过蓝光照射诱导24 h,由OpIE1调控的GFP有表达,而由C120调控的mCherry无表达。未转染质粒的Sf9细胞,既没有GFP的表达,也没有mCherry的表达(图3)。
图3 含有红色荧光蛋白mCherry报告基因的昆虫细胞光控表达载体测试
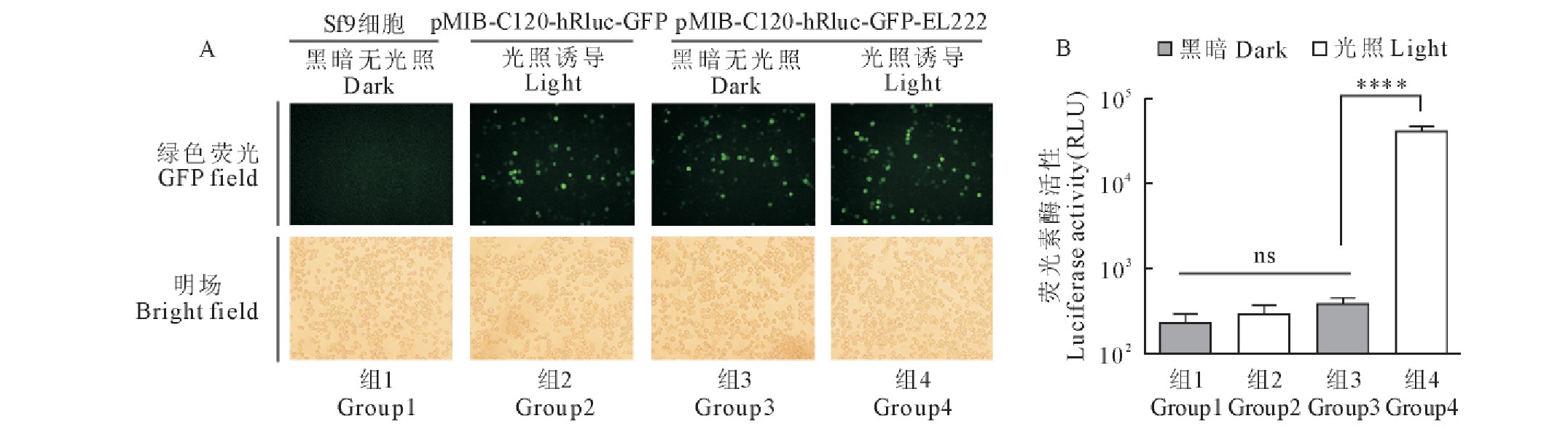
Fig.3 Test of insect cell light-induced expression vector containing mCherry reporter gene
2.3.2 、光诱导表达海参荧光素酶的检测
在6孔板中培养的Sf9细胞分别转染pMIB-C120-hRluc-GFP-EL222质粒和pMIB-C120-hRluc-GFP质粒,28℃孵育24 h后,再施加光照与黑暗两种条件,24 h后于荧光显微镜下观察细胞荧光蛋白的表达,检测hRluc的活性。结果显示,试验组质粒pMIB-C120-hRluc-GFP-EL222转染Sf9细胞24 h后,黑暗无光继续培养24 h,由组成性启动子OpIE1调控的GFP有明显表达,由光诱导启动子C120调控的hRluc无表达(图4组3);而再经过蓝光照射诱导24 h,由OpIE1调控的GFP有明显表达,由C120调控的hRluc也有大量表达(图4组4);对照组质粒pMIB-C120- hRluc -GFP转染Sf9细胞24 h后,再经过蓝光照射诱导24 h,由OpIE1调控的绿色荧光蛋白GFP表达,由于缺失EL222光诱导转录因子,hRluc无表达(图4组2)。未转染质粒的Sf9细胞,既没有GFP的表达,也没有hRluc的表达(图4组1)。从荧光素酶活性值的多重比较检验显着性分析结果可以看出,试验组光照后的hRluc表达有明显增加,相比黑暗无光照组荧光素活性值提高了100多倍;而且,阴性对照组之间荧光素活性值无显着性差异。上述结果表明,C120-EL222光诱导表达元件在Sf9细胞中具有很高的表达效率和严谨性(图4B)。
3、 讨论
新型昆虫细胞光诱导表达载体pMIB-C120-GOI-GFP-EL222,采用含有光诱导启动子C120元件序列的外源基因表达框替换了常规昆虫细胞表达载体pMIB/V5-His的OpIE2启动子表达框,利用口蹄疫病毒(Foot-and-mouth disease virus,FMDV)的2A自剪切多肽序列(F2A)和昆虫病毒(Thosea asigna virus)的2A自剪切多肽序列(T2A),将杀稻瘟菌素抗性基因(Blasticidin,BSD)、绿色荧光蛋白(GFP)基因和光激活转录因子EL222的编码基因串联,由OpIE1启动子转录成一条mRNA,实现了上述3种基因的持续性表达。这种高度集成的单质粒构建策略克服了多种质粒共转染效率低的缺点[12]。通过该质粒瞬时转染昆虫细胞,检测光诱导表达的 mCherry或hRluc报告基因,为验证光诱导表达元件的功能提供了快速有效的新方法。引入的GFP报告基因,能够直观地反映该质粒的转染效率。此外,为了提高光诱导外源基因的整体表达水平,还可以利用BSD抗生素筛选Sf9稳定细胞系,进一步利用GFP绿色荧光进行流式细胞仪分选,从而获得高性能的光诱导表达Sf9稳定细胞系。
在试验中观察到有少部分表达GFP的Sf9细胞中,mCherry的表达量很低甚至没有表达(图3)。造成这种现象的原因可能有以下几种:其一可能是蓝光照射的条件对部分细胞的作用效果较差,虽然试验方法中采用了一种优选的光照循环条件(蓝光照射20s停60s为一个循环,持续诱导24 h),但将来还需要根据不同的昆虫细胞类型不断优化各种最佳光诱导条件;其二可能是EL222转录因子的表达不稳定造成的,因为EL222是通过T2A自剪切多肽串联在GFP基因之后。为了避免T2A自剪切多肽的活性的差异会导致EL222的表达量差异,可以选用新的更加稳定的EL222表达策略。
图4 含有荧光素酶hRluc报告基因的昆虫细胞光诱导表达载体测试
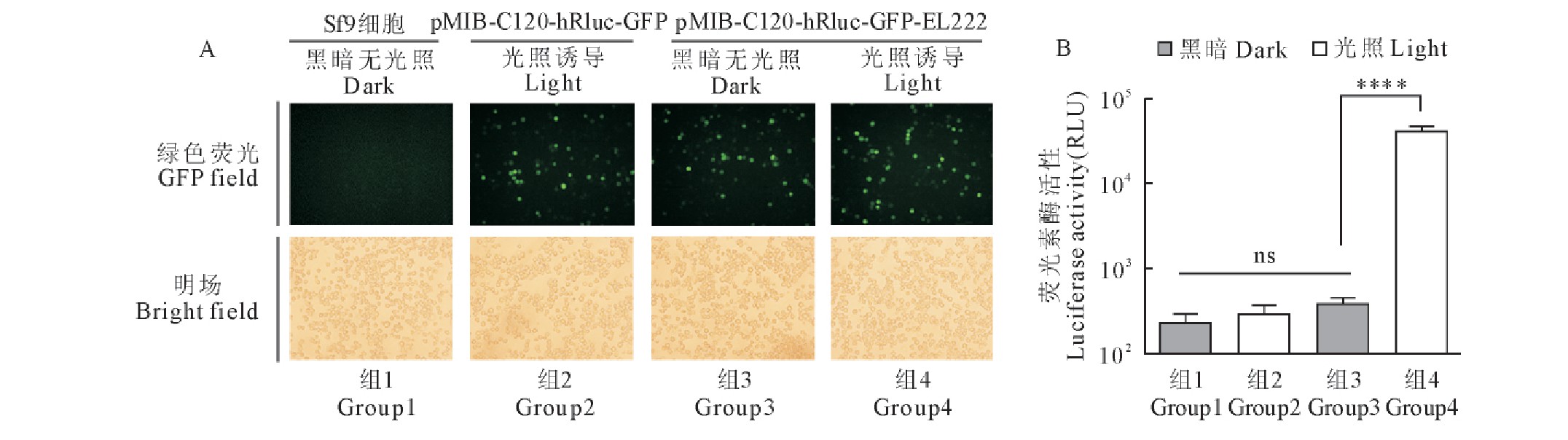
Fig.4 Test of insect cell light-induced expression vector containing hRluc reporter gene
A.荧光显微镜观测转染了含有hRluc基因的昆虫细胞光诱导表达载体的Sf9细胞;B.检测转染了含有hRluc基因的昆虫细胞光诱导表达载体的Sf9细胞中荧光素酶活性。每组实验3次重复,数值表示为平均值±标准差。星号表示经方差分析后各组间的Tukey多重比较检验显着性,****,p<0.0001;ns,无显着性差异。
A.Fluorescence microscopy observation of Sf9cells transfected with insect cell light induced expression vector containing hRluc gene.B.Detection of luciferase activity in Sf9cells transfected with insect cell light induced expression vector containing hRluc gene.Experiments were performed in triplicate.All values are presented as mean±standard deviation.Asterisks depict Tukey’s multiple comparison test significance between groups after an ANOVA test,****,p<0.0001;ns,no significant differences.
试验结果充分证明了基于C120-EL222的光诱导表达系统在昆虫Sf9细胞中具有功能,诱导表达具有很高的效率和严谨性(图3和图4)。除了来源于草地贪夜蛾(Spodoptera frugiperda)卵巢细胞系的Sf9细胞之外,下一步将探索光诱导表达系统在其他常用的昆虫细胞,如Sf21、High Five、BmN和Tn-368等细胞中的效能。除了C120-EL222光诱导表达系统之外,下一步也将探索具有应用潜力的其他类型光诱导系统在昆虫细胞中的效能[11]。此外,光诱导表达系统为在昆虫细胞中表达特殊蛋白复合体或具有细胞毒性蛋白提供了新的方法。例如腺相关病毒Rep基因的持续性表达对细胞具有一定的毒性[14],现有的用于制备rAAV的Sf9包装细胞系采用的是感染诱导的方式调节Rep基因的表达[15,16],将来可尝试利用 C120-EL222光诱导系统构建调节Rep基因表达的新型Sf9包装细胞系。
总之,研究结果为进一步利用昆虫细胞系深入开展光诱导灵活调控外源基因表达的研究和应用打下了坚实的基础。所构建的适用于昆虫细胞光诱导表达载体也为实现外源基因在昆虫细胞系中的灵活表达调控提供了基础方法。
参考文献
[1] MILLER L K.Baculoviruses:high-level expression in insect cells [J].Curr Opin Genet Dev,1993,3(01):97-101.
[2] URABE M,DING C,KOTIN R M.Insect cells as a factory to produce adeno-associated virus type 2 vectors [J].Human Gene Ther,2002,13(16):1935-1943.
[3] WU Y,JIANG L,GENG H,et al.A Recombinant baculovirus efficiently generates recombinant adeno-associated virus vectors in cultured insect cells and larvae [J].Mol Ther Methods Clin Dev,2018,10,38-47.
[4] 尹曼曼,刘汉平,楼觉人.猪圆环病毒2型Cap基因多拷贝质粒的构建及病毒样颗粒的表达 [J].动物医学进展,2019,40(09):1-6.
[5] 于永利.昆虫杆状病毒表达载体系统与疫苗研制的30 年回顾 [J].微生物学免疫学进展,2015,43(04):1-15.
[6] BRYANT L M,CHRISTOPHER D M,GILES A R,et al.Lessons learned from the clinical development andmarket authorization of Glybera [J].Hum Gene Ther Clin Dev,2013,24(2):55-64.
[7] 唐琦,邱立鹏,李东,等.杆状病毒表达载体的应用现状 [J].微生物学通报,2018,45(02):442-450.
[8] MCCARROLL L,KING L A.Stable insect cell cultures for recombinant protein production [J].Curr Opin Biotechnol,1997,8(05):590-594.
[9] GOSSEN M,FREUNDLIEB S,BENDER G,et al.Transcriptional activation by tetracyclines in mammalian cells [J].Science,1995,268(5218):1766-1769.
[10] TISCHER D,WEINER O D.Illuminating cell signalling with optogenetic tools [J].Nat Rev Mol Cell Biol,2014,15(08):551-558.
[11] 陈显军,左方婷,杨弋.光控基因表达系统 [J].生命科学,2019,31(4):343-356.
[12] MOTTA-MENA L B,READE A,MALLORY M J,et al.An optogenetic gene expression system with rapid activation and deactivation kinetics [J].Nat Chem Biol,2014,10(03):196-202.
[13] ZOLTOWSKI B D,MOTTA-MENA L B,GARDNER K H.Blue light-induced dimerization of a bacterial LOV-HTH DNA-binding protein [J].Biochemistry,2013,52(38):6653-6661.
[14] YANG Q C,CHEN F,TREMPE J P.Characterization of cell-lines that inducibly express the adenoassociated virus Rep proteins [J].J Virol,1994,68(08):4847-4856.
[15] ASLANIDI G,LAMB K,ZOLOTUKHIN S.An inducible system for highly efficient production of recombinant adeno-associated virus (rAAV) vectors in insect Sf9 cells [J].Proc Nat Acad Sci U S A,2009,106(13):5059-5064.
[16] WU Y,MEI T,JIANG L,et al.Development of versatile and flexible Sf9 packaging cell line dependent OneBac system for large-scale rAAV production [J].Hum Gene Ther Methods,2019,30(05):172-183
软骨细胞和成骨细胞等其他细胞来源于骨骼干细胞的分化作用,软骨形成是关节软骨形成过程中的一个关键过程,始于骨髓间充质干细胞的凝结。...