
多环芳烃(Polycyclic aromatic hydrocarbons,简称 PAHs) 是存在于环境中且含有两个以上苯环的碳氢化合物,包括菲、芘、苯并芘(BaP) 等 150 余种. 近年来,人类活动的加剧,特别是煤、石油等化石燃料和木材的不完全燃烧,破坏了其在环境中原有的平衡,使环境中 PAHs 大量增加. 作为一种典型的持久性有机污染物,PAHs 类化合物已在世界各地被检出,此外 PAHs 类化合物还具有强烈的致癌作用、致畸作用和致突变作用,可以通过呼吸道、消化道和皮肤进入人体,是最早发现也是数量最多的致癌物之一.由于 PAHs 独特的性质,其也具有生物蓄积性和半挥发性,因此是大气污染监测的重要目标之一.
肺泡巨噬细胞(Alveolar macrophage,简称 AM) 是存在于肺泡隔中较大的圆形或卵圆形巨噬细胞,可吞噬、清除外来的尘粒或病原,参与肺的防御和免疫,还可产生大量的生物活性物质,维持肺和机体的正常生理活动.菲是一种典型的三环芳香烃,易挥发,很多条件下以气态存在,可经呼吸系统进入人体,对动物有致癌作用.目前关于菲对植物生长发育的影响有一些报道,研究结果表明氧化损伤为菲毒性的可能机制,而关于菲对动物毒性作用的报道并不多.本文以菲为研究对象,测定了染毒后细胞中谷胱甘肽 (Glutathione,GSH) 、超氧化物歧化酶(Superoxide dismutase,SOD) 和丙二醛(Malondialdehyde,MDA) 含量,观察了线粒体融合/分裂状态,以此探讨低环多环芳烃对大鼠 AM 的毒性机制.
1、 材料和方法
1.1 仪器和主要试剂
CO2培养箱(Thermo Forma 公司) 、低温高速离心机(Thermo Forma 公司) 、TU-1810 紫外可见分光光度计(北京普析通用仪器公司) 、HZQ-F100 振荡培养箱、酶标仪、激光共聚焦显微镜.RPMI1640 培养液、小牛血清、MDA 试剂盒、SOD 试剂盒、GSH 试剂盒、二甲基亚砜(DMSO) 、0.4%的台盼蓝、四甲基偶氮唑盐(MTT) 、考马斯亮蓝 G-250、0.18%胰蛋白酶、菲母液(5 mg·mL-1甲醇) 、线粒体荧光试剂(Mito-Tracker Green) .
1.2 实验方法
1.2.1 大鼠 AM 的提取和培养
每次实验选体重 220—250 g 的雄性、清洁 Wistar 大鼠 4 只,腹腔注射 1%戊巴比妥那 1.0 mL,腹主动脉放血致死,打开胸腔,用灭菌的磷酸盐缓冲液(PBS,pH = 7.0) 灌洗双肺,灌洗液(BLAF) 于3000 r·min-1、4 ℃离心 10 min,弃上清液,沉淀用含 10%小牛血清的 RPMI1640 培养液洗涤,台盼蓝拒染法计数,稀释(2×106—3×106个·mL-1) ,将细胞稀释液按每皿 3 mL 分装于细胞培养皿中,置于 37 ℃、5% CO2培养箱中培养 2 h,小心弃原培养液,用 PBS 轻轻洗涤 1—2 次,去除非贴壁的细胞.
用不同浓度的菲(20、40、60、80、100 μg·mL-1) 染毒,同时设对照组(只加培养液) .染毒 4 h,去培养液,以 PBS 清洗后用 0.18%的胰蛋白酶消化细胞,30 s 后弃消化液,用含小牛血清的 RPMI1640 培养液终止消化,轻轻吹打贴壁的细胞,将悬液转移到 10 mL 离心管中,于 3000 r·min-1、4 ℃离心 10 min,用PBS 清洗两次,之后加少许 PBS 冻存,备用.
1.2.2 细胞毒性的测定
采用 MTT 分析法.活细胞线粒体中的琥珀酸脱氢酶能使外源性 MTT 还原为溶解于二甲基亚砜(DMSO) 的蓝紫色结晶———甲瓒(Formazan) ,用酶标仪在 490 nm 波长处测其吸收值,可间接反映活细胞数量.
将稀释好的细胞悬液(1—2×105个·mL-1) 按每孔 100 μL 加到 96 孔培养板中,贴壁 2 h 后,用不同浓度的含菲培养液 100 μL 染毒,同时设一对照组(只加培养液) 、空白组(只加甲醇) 和一标准组(只加MTT 和 DMSO) ,每个浓度设 5 个平行,染毒 4 h 后,去原培养液,每孔加 100 μL RPMI 1640 培养液和20 μL MTT(5 mg·mL-1) 继续培养,4 h 后去上清液,每孔加 150 μL DMSO,振荡 10 min,将液体平行转移到另一 96 孔板中,在酶标仪上测 OD 值,计算细胞的相对存活率.
1.2.3 AM 线粒体融合 / 分裂的观察
观察线粒体融合/分裂所用的荧光试剂为 Mito-Tracker Green.不同浓度菲染毒 4 h 后,用 0.18%的胰酶消化细胞,30 s 后,用含小牛血清的 1640 培养液终止消化,终止液转移到 10 mL 离心管中,3000 r·min-1、4 ℃ 离心 10 min,去上清液,沉淀加入 37 ℃ 预温育的染色工作液 1 mL,浓度为25 nmol·L-1,孵育 30 min 后,3000 r·min-1、4 ℃离心 10 min,弃上清,重新加入培养液 500 μL,用移液器吹打均匀,取一滴做标片,在激光共聚焦显微镜下观察 AM 线粒体融合/分裂的状态.
1.2.4 生理指标的测定
蛋白含量测定: 以牛血清白蛋白为标准溶液(1 mg·mL-1) ,作蛋白含量 0、10、20、30、40、50、60 μg 的标准曲线,采用考马斯亮蓝法,于 595 nm 波长下测其吸光值,通过标准曲线测得样品中的蛋白含量.SOD、GSH 及 MDA 含量用试剂盒测定(购自南京建成公司) ,具体方法参见试剂盒说明书.
1.2.5 统计分析
实验数据以平均值±标准误差(Mean±SD) 表示,用 Excel 软件对组间差异进行统计分析,P<0.05 表示差异显著,用 Origin 8.0 完成制图与分析.
2、 结果与讨论
2.1 菲的细胞毒性
AM 是重要的吞噬细胞,可以清除肺中的坏疽碎片及尘埃等,当病原体被 AM 吞噬后,会与溶酶体融合并被消化掉,而 AM 也将死于消化过程中产生的混合物.如图 1 所示,随染毒浓度的增加,AM 成活率呈下降趋势,低浓度(20 μg·mL-1) 组相对于较高浓度组(80 μg·mL-1、100 μg·mL-1) 而言,产生的混合物较少,AM 成活率下降较缓,当浓度大于 40 μg·mL-1时,染毒组与对照组相比差异达显著或极显著水平(P<0.05 或 P<0.01) .图 1 空白为只加甲醇时的细胞成活率(以最大染毒浓度组的甲醇体积计算) ,与对照组相比,无显著性差异.
2.2 不同浓度菲对 AM SOD 活力的影响
SOD 是保护细胞免受自由基侵袭的第一道屏障,能够催化 O-·2与 H2O2反应生成 O2.SOD 作为重要的抗氧化酶,广泛存在于生物体内,SOD 能及时修复受损细胞,复原自由基对细胞造成的伤害,但当有毒有害物质的浓度过高,产生的 O2-过多,超出 SOD 的清理能力时,SOD 活力就会减弱.如图 2 所示,随着染毒剂量的增加,SOD 活力呈下降趋势,说明细胞的抗氧化能力减弱.在浓度大于 80 μg·mL-1时,与对照组相比,差异极显著(P<0.01) .

2.3 不同浓度菲对 AM GSH 含量的影响
GSH 也是一种重要的抗氧化酶,可以清除体内的 O2-、H2O2、LOOH. 此外,GSH 还可与一些毒性分子及其代谢物结合,降低其毒性.当有毒有害物质增加时,O2-增加,GSH 的清理能力减弱,含量下降.如图 3 所示,当染毒浓度大于 40 μg·mL-1时,随着染毒浓度的升高,GSH 含量逐渐降低,且与对照相比,差异显著(P<0.05 或 P<0.01) ,但在染毒浓度为 20 μg·mL-1时,GSH 含量略有上升,但与对照相比无显著差异.其可能原因为低浓度处理时,细胞内的自由基增加,细胞中 GSH 含量上升以及时清理过量的自由基,是细胞的一种应激反应,随着染毒浓度的升高,自由基的产生远远超出了 GSH 的清除能力,导致GSH 含量的降低.
2.4 不同浓度菲对 AM MDA 含量的影响
MDA 是脂质过氧化的产物,通常 MDA 的含量反映了脂质过氧化水平.当生物体内自由基过量时,MDA 含量就会增加,细胞受损害程度增强.如图 4 所示,不同浓度染毒使得 AM 中 MDA 含量增加,且与其他指标相比在较低浓度 20 μg·mL-1时与对照相比差异就达显著水平(P<0.05) ,高浓度处理时,与对照相比差异极显著(P<0.01) .

2.5 菲对大鼠 AM 线粒体融合 / 分裂的影响
正常的细胞中,线粒体的融合与分裂是协同进行的,两者保持动态平衡,这种平衡对维持线粒体的正常形态、分布和功能十分重要.线粒体融合/分裂平衡的紊乱将导致线粒体功能障碍,表现为 ATP 生成减少、氧自由基(ROS) 产生增多等,同时还将造成细胞功能损害和疾病的发生. 除此之外,线粒体融合和分裂的异常还能导致巨型线粒体(megamitochondria) 的出现.由图 5 可以看出,不同浓度的菲处理,对 AM 线粒体的融合/分裂造成了一定的影响.
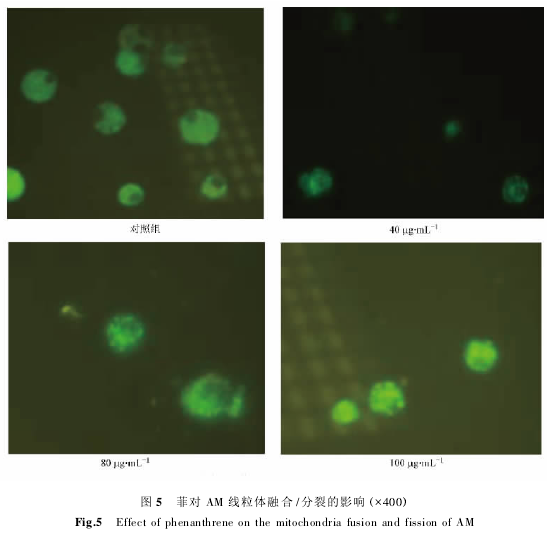
多、体积增大.菲进入细胞后,溶酶体需要不断地将其消化掉,这就需要大量的能量,不断的融合能使线粒体体积变大,基质增加,释放大量的能量,同时菲的进入可能引起线粒体分裂相关基因(如 Drp) 损伤,导致线粒体分裂减少,在胞体内积聚,这就导致了巨型线粒体的出现,且随着菲浓度的增加,巨型线粒体的数目越来越多,体积越来越大.
3、 结论
本研究采用体外细胞培养及染毒方法,选择典型的低环多环芳烃菲为代表,以肺泡巨噬细胞为研究对象,研究了菲对肺泡巨噬细胞的生物学毒性,旨在阐明多环芳烃对呼吸系统的毒理机制,研究发现:
(1) 不同浓度的菲造成细胞成活率的下降,特别是在高浓度处理下,细胞成活率急剧降低,说明了菲对 AM 具有细胞毒性.
(2) 菲处理后,AM 中 SOD、GSH 含量都有所下降,而 MDA 含量在低浓度下就有所上升,且均呈现一定的剂量-效应关系,揭示过量自由基的生成并对细胞造成氧化损伤是菲对 AM 毒性的一条可能途径.
(3) 正常细胞的线粒体处于不断的分裂/融合当中,始终保持平衡,而菲处理后,细胞线粒体融合/分裂异常,出现了大量的巨型线粒体,导致细胞正常功能的损害,这也是菲细胞毒性的可能机制.
参考文献:
[1] 段晓丽,陶澍,徐东群,等. 多环芳烃污染的人体暴露和健康风险评价方法[M].北京: 中国环境科学出版社,2011: 2.
[2] 卢晓丹,高彦征,凌婉婷,等.多环芳烃对黑麦草体内过氧化物酶和多酚氧化酶的影响[J].农业环境科学学报,2008,27(5) :1969-1973.