
甲状腺相关眼病 (thyroid-associated ophthal-mopathy,TAO) 又称 Graves 眼病 (Graves ophthal-mopathy,GO), 是眼眶的炎症性免疫疾病, 是Graves 病(Graves disease,GD)最常见的甲状腺外表现,目前已知引起该病眼球突出等临床表现主要是由于眶内脂肪组织和眼外肌的膨胀.
过氧化物酶体增殖物激活受体 γ(peroxisomeproliferator-activated receptor, PPAR-γ)在 脂肪化的过程中起到十分重要的作用,分泌卷曲相关蛋白(secreted frizzled-related protein, SFRP)在脂肪组织中的作用也逐渐引起研究人员的重视,且有学者发现,GO 患者眶脂肪组织中 SFRP1 的 mRNA 水平与脂肪量有关. 本研究主要通过检测 TAO 患者眶脂肪组织中 SFRP、PPAR-γ 的 mRNA 和蛋白的表达情况,初步探索 SFRP 在 TAO 眶脂肪组织增生中的作用。
资料与方法
一、临床资料
收集我院 2009 年至 2011 年诊断为 TAO 并行鼻内镜下眶减压术患者(病变组)眶脂肪组织,共9 例(9 眼),其中男 4 例(4 眼),女 5 例(5 眼),年龄45~73 岁,平均(58.3±9.2)岁。 病例入选标准:①根据临床症状和体征,血三碘甲状腺原氨酸(T3)、甲状腺素(T4)及促甲状腺激素(TSH)检测,常规眼科检查及眶部 CT 或磁共振成像(MRI)检查等,确诊为 TAO;②保守治疗后效果不佳,突眼、角膜溃疡及视力受损等未能明显改善或者视力急剧下降;③期望通过手术改善视力受损和容貌改变等情况的患者。 TAO 的确诊依据 Bartley1995 年提出的诊断标准. 有眼睑退缩者,合并以下之一:①甲状腺功能异常或调节异常 (包括血清 T3或 T4水平增高,或TSH 降低, 或 T3水平增高抑制和 TSH 释放激素兴奋试验异常,或血清 TSH 免疫球蛋白阳性);②眼球突出;③视神经功能障碍;④眼外肌受累。 无眼睑退缩者, 则必须有甲状腺功能异常或调节异常,合并有眼球突出或视功能障碍或眼外肌受累之一。
收集我院眼科同期因外伤等原因需要行眼球摘除术或眼外肌矫形术的患者(对照组)术中切除的眶脂肪组织,患者均无甲状腺疾病史,共 7 例(7 眼),其中男 3 例(3 眼),女 4 例(4 眼),年龄 38~65 岁,平均(53.1±12.5)岁。
二、方法
1. 实 时荧光定量 PCR 检 测 眶 脂 肪 组 织 中SFRP1~5 及 PPAR-γ 的 mRNA 水平:用 Trizol 法提取组织中总 RNA,紫外分光光度计上定量,RNA 纯度为 A260/A280= 1.8~2.0. 用宝生物工程(大连)有限公司(TaKaRa)反转录试剂盒反转录 1 μg 总 RNA,去基因组 DNA 反应条件为 42℃、2 min,4℃骤冷;反转录反应条件为 37℃ 15 min,85℃ 5 s.实时荧光定量 PCR 目的基因及内参基因引物均由 Primerpremier 5.0 软件跨内含子设计,由上海生工生物工程公司合成, 序列详见表 1. 样本实时荧光定量PCR 反应均做复孔, 条件为预变性 95℃ 30 s;95℃变性 5 s,60℃退火延伸 30 s, 共进行 40 个循环;采用 2-ΔΔCT值对组间目的基因的相对表达量进行比较。【表1】

2. 蛋白质印迹(Western blot)技术检测眶脂肪组织中 SFRP2 以及 PPAR-γ 的蛋白表达情况:采用蛋白裂解液 RIPA (上海申能博彩生物有限科技公司)抽提组织蛋白,考马斯亮兰法测定组织蛋白浓度, 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜,5%脱脂奶粉封闭后加一抗过夜。 洗去一抗后加入二抗孵育 1 h, 洗涤后电化学发光法(ECL)显 色 . 内参对照采用肌动蛋白 (actin)。 抗SFRP2 和 抗 PPAR-γ 兔 抗人单克隆抗体及二抗均购自美国圣克鲁斯生物技术公司。
三、统计学方法
所有数据采用 SPSS 17.0 统计软件进行分析。实验数据用x±s表示。 2 组间均数比较采用 t 检验。以 P<0.05 为差异具有统计学意义。
结 果
一、SFRP1~5 和 PPAR-γ 的 mRNA 表达
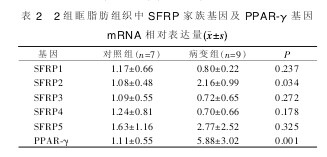
TAO 病变组眶脂肪组织中 SFRP2 的表达水平高于对照组, 差异具有统计学意义 (P<0.05),而SFRP1、SFRP3、SFRP4、SFRP5 在 2 组 间的差异无统计学意义(P>0.05)。 在 TAO 病变组眶脂肪组织中 PPAR-γ 的 mRNA 表达水平高于对照组,差异具有统计学意义(P<0.01)(见表 2)。【表2】
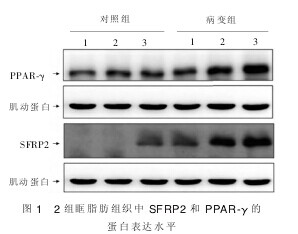
二、SFRP2 和 PPAR-γ 的蛋白表达
TAO 患 者 眶 脂 肪 组 织 中 SFRP2 及 PPAR-γ的蛋白水平均较对照组明显升高(见图 1),分别为0.96±0.77 比 0.03 ±0.05 和 0.90 ±0.51 比 0.14 ±0.15(均 P<0.01),2 组间 SFRP1、SFRP3、SFRP4 和SFRP5蛋白水平均无差异(P>0.05)。【图1】
讨 论
TAO 是一种免疫性疾病,免疫机制的异常导致局部炎症的发生,引起眶内脂肪和眼外肌的肿胀.眼眶脂肪组织在 TAO 的发病中起重要作用, 其增多导致眶压增高,眼球突出,同时脂肪组织本身分泌的多种脂肪细胞因子、生长因子等也可能参与了TAO 的发病。脂肪细胞分化是指成纤维细胞样的脂肪前体细胞在一系列细胞内、外因素作用下转变为成熟的、充满脂质的脂肪细胞的过程。
首先, 本研究结果显示在 TAO 病变组眶脂肪组织中 PPAR-γ 的 mRNA 和蛋白表达水平均明显高于对照组。 PPAR-γ 是脂肪细胞分化中起重要作用的因子之一, 有学者研究指出 TAO 患者眶内脂肪基质细胞在 PPAR-γ 水平上调后能向脂肪细胞分化. 说明 PPAR-γ 表达水平的上调在 TAO 眶脂肪增生过程中具有一定的作用。 其次,本研究结果显示 SFRP 家族中 SFRP2 在 TAO 病变组眶脂肪组织中的 mRNA 和蛋白表达水平也均明显高于对照组。 那么,SFRP2 可能通过怎样的信号转导通路影响 PPAR-γ 的上调,进而引起眶脂肪增生的呢?
研究认为,Wnt 信号途径是脂肪分化过程中起重要作用的一条信号通路. Wnt 蛋白与其特异性受体及辅助受体结合后,启动一系列下游信号分子的磷酸化和去磷酸化,完成其信号转导过程,并对脂肪形成起到抑制作用。 经典 Wnt 信号途径亦称Wnt/β 联蛋白(β-catenin)信号途径。在此信号转导过程中,Wnt 蛋白与其特异性受体卷曲蛋白(frizzled,Fz) 及 辅助受体低密度脂蛋白受体相关蛋白 5/6(LRP5/6)结 合后 ,激活 dishevlled(Dvl) 蛋 白 ,使糖原合成酶激酶 3β(GSK-3β)、结肠腺瘤样息肉(APC)肿瘤抑制因子和细胞支架蛋白(axin)形成的蛋白三体复合物的活性受到抑制,导致内源性 β 联蛋白在细胞质中积聚并进入细胞核,β 联蛋白可以通过直接抑制 PPAR-γ 和 CCAAT 增强子结合蛋白(C/EBP)α的表达来维持脂肪前体细胞的未分化状态. 而SFRP 作为 Wnt 信号途径的抑制剂,其结构与 Fz 受体极为相似,具有同源的配体抑制区,通过竞争性结合 Wnt 蛋白而抑制 Wnt 的活动,从而可能增强PPAR-γ 的表达水平,促进了脂肪细胞的分化,导致脂肪组织的增生。 其中 SFRP2 又名分泌型凋亡相关蛋白 1(secreted apoptosis-related protein 1,SARP1),位于 4 号染色体 q31-3.全长约 2 kb,编码一个大小约 34 ku 的可溶性蛋白质,表达于胞浆,但也可分泌至胞外发挥作用。 另有研究表明,SFRP2 能稳定β 联蛋白,受甲状腺激素上调作用,经过激活 β 联蛋白信号通路,作用于 Fz 受体,能加强细胞增殖.
因此,SFRP2 作为 SFRP 家族成员, 不仅可以通过竞争性抑制 Fz 受体而抑制 Wnt 的活动, 促进脂肪细胞分化导致脂肪组织的增生,而且在甲状腺激素上调的 TAO 患者中,SFRP2 还可能通过加强眶脂肪细胞的增殖来增加眶脂肪的体积。Kumar 等研究发现 TAO 患者眶脂肪组织中SFRP1 及 PPAR-γ 的基因表达水平 均高于正常对照组, 认为 SFRP1 在 TAO 患者的发病中可能起到一定的作用。 本研究结果与其有所不同,可能是样本量或者实验检测手段的不同等原因导致,进一步的研究可利用基因转染或干扰技术上调或下调眶内前脂肪细胞中 SFRP 的表达来观察其分化情况,对 SFRP 在 TAO 发病中的作用进行更深入的探索。
[参考文献]
[1] Iyer S, Bahn R. Immunopathogenesis of Graves'ophthal-mopathy: the role of the TSH receptor [J]. Best Pract ResClin Endocrinol Metab, 2012, 26(3): 281-289.
[2] Zhang L, Grennan-Jones F, Lane C, et al. Adipose tis-sue depot-specific differences in the regulation ofhyaluronan production of relevance to Graves'orbitopa-thy[J]. J Clin Endocrinol Metab, 2012, 97(2): 653-662.
[3] Noh JR, Kim YH, Hwang JH, et al. Scoparone inhibitsadipocyte differentiation through down-regulation of per-oxisome proliferators-activated receptor γ in 3T3-L1preadipocytes [J]. Food Chem, 2013, 141(2): 723-730.
[4] Ehrlund A, Mejhert N, Lorente-Cebrián S, et al. Charac-terization of the Wnt inhibitors secreted frizzled-relatedproteins (SFRPs) in human adipose tissue [J]. J Clin En-docrinol Metab, 2013, 98(3): E503-E508.
[5] Kumar S, Leontovich A, Coenen MJ, et al. Gene ex-pression profiling of orbital adipose tissue from patientswith Graves' ophthalmopathy: a potential role for se-creted frizzled-related protein-1 in orbital adipogenesis[J]. J Clin Endocrinol Metab, 2005, 90(8): 4730-4735.
[6] Bartley GB, Gorman CA. Diagnostic criteria for Graves'ophthalmopathy[J]. Am J Ophthalmol, 1995, 119(6): 792-795.
[7] Dolman PJ. Evaluating Graves' orbitopathy [J]. Best PractRes Clin Endocrinol Metab, 2012, 26(3): 229-248.
[8] Zhao P, Deng Y, Gu P, et al. Insulin-like growth factor 1promotes the proliferation and adipogenesis of orbitaladipose-derived stromal cells in thyroid-associated oph-thalmopathy[J]. Exp Eye Res, 2013, 107: 65-73.