摘要: 常见的催化药物氧化代谢的非 P450 酶包括黄素单氧化酶 (FMO)、单胺氧化酶 (MAO)、醛氧化酶(AO)、黄嘌呤氧化酶 (XO)、乙醇脱氢酶 (ADH) 和乙醛脱氢酶 (ALDH)。近年来, 它们在药物氧化代谢中的作用越来越受到重视。但是, 由于在药物发现和先导化合物优化过程中通常使用 P450 酶相关的体外模型进行代谢研究, 非 P450 酶在药物氧化代谢中的贡献往往被低估。本文综述了以上非 P450 酶的催化反应类型、常见底物、基因多态性以及药物相互作用, 并总结了非 P450 酶介导药物氧化代谢的体外研究模型及影响因素。与 P450 酶类似, 非 P450 酶可以直接催化药物发生氧化代谢, 产生具有治疗活性的代谢物或者毒性代谢物。这类酶也可以进一步氧化经 P450 酶催化产生的毒性代谢物, 发挥解毒作用。与 P450 酶相比, 大部分非 P450 酶 (如 FMO 和MAO) 不容易被诱导。
关键词: 黄素单氧化酶; 单胺氧化酶; 醛氧化酶; 黄嘌呤氧化酶; 乙醇脱氢酶; 乙醛脱氢酶; 氧化代谢。
药物代谢是指药物分子被机体吸收后, 在机体作用下发生化学结构转化的过程。药物代谢对药物的药效、毒性及临床合并用药时的药物相互作用等具有重要影响。作为体内最重要的Ⅰ相药物代谢酶, 细胞色素 P450 酶参与约 75%的药物代谢反应。临床上基于代谢的药物相互作用大多都是通过对 P450 酶亚型的抑制或诱导实现的, 因此这类酶及相关氧化代谢反应一直是新药研发中关注的焦点, 相应的研究技术和评价策略也已趋于成熟。
近年来, 随着组合化学、高通量筛选等技术的发展, 结构新颖的药物层出不穷, 非 P450 酶催化的氧化代谢途径逐渐进入新药研发科学家的视线。然而,由于对非 P450 酶催化的特殊代谢途径认识不足, 导致临床前实验动物种属选择失误, 使临床试验阶段药物被终止开发的案例越来越多。例如, 美国因赛特制药公司开发的第一代高效、高选择性 c-MET 抑制剂SGX523, 在Ⅰ期临床剂量上升至>80 mg时, 患者出现急性肾功能衰竭, 表现为血清肌酸酐升高。代谢研究发现 SGX523 结构中的喹啉环能够被醛氧化酶(AO) 代谢生成 2-喹啉酮, 这一代谢物水溶性差, 在肾小管内形成结晶。安全性评价中使用的动物醛氧化酶的催化活性低, 因而未发现 SGX523 的肾毒性[1].此外, 日本山之内制药公司开发的新型腺苷 A1/2 双重抑制剂 FK3453, 到了临床阶段才发现人体的系统暴露量极低, 达不到药效浓度, 而被终止开发, 究其原因是人体内AO介导了2-氨基嘧啶环的氧化代谢[2].这些案例引发了人们对非 P450 酶及其介导的特殊代谢途径的关注。
常见的催化药物氧化代谢的非 P450 酶包括黄素单氧化酶 (FMO)、单胺氧化酶 (MAO)、醛氧化酶(AO)、黄嘌呤氧化酶 (XO)、乙醇脱氢酶 (ADH) 和乙醛脱氢酶 (ALDH)[3?8].本文将从催化反应类型、常见底物、基因多态性及药物相互作用等方面对以上非 P450 酶进行介绍。
1 黄素单氧化酶 (FMO)
1.1 底物类型 FMO 为微粒体中除 P450 酶外的另一种氧化酶。与 P450 酶类似, FMO 催化的氧化反应需要辅助因子 NADPH 的参与。FMO 和 P450 均能催化杂环类化合物发生 N-氧化和 S-氧化。不同的是,FMO 的底物通常为含有 N 或 S 原子的弱亲核试剂,而 P450 酶的底物并不局限于亲核试剂[9?11].与 P450酶相比, FMO 对温度更敏感。在不加 NADPH 时, 45 ℃条件下预孵 5 min 会使 FMO 失活, 而 P450 酶活性不受影响[12].
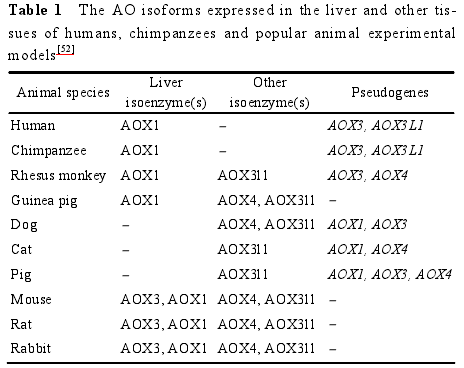
一般认为, pKa值为 8~11 的碱性胺的 N-氧化反应主要由 FMO 催化, 而弱碱由 P450 和 FMO 共同催化[13].此外, FMO 一般不催化伯胺的氧化, 而主要催化仲胺的 N-氧化过程, 形成羟胺代谢产物, 如抗真菌药酮康唑的脱乙酰基代谢物[14](deacetyl-ketoconazole, 图 1A)。叔胺类化合物也可经 FMO催化发生 N-氧化, 如治疗乳腺癌的药物他莫昔芬[15](tamoxifen, 图 1B)。除了 N-氧化外, FMO 也催化 S-氧化反应, 如抗组胺药西咪替丁[16, 17](cimetidine, 图1C)。近年来, 也有文献[18]报道 FMO 能催化 C-氧化反应, 如 MRX-I 在 FMO5 催化下发生 Baeyer-Villiger氧化反应。
1.2 FMO 亚型、分布及基因多态性 目前, FMO 共有 5 种亚型被鉴定, 分别为 FMO1、FMO2、FMO3、FMO4 和 FMO5.在成人肝中, FMO3 和 FMO5 是最主要的两种亚型[17].FMO1 在成人肝中表达量低, 但在胎儿肝脏中是最主要的亚型[19].文献[20]报道 FMO3 具有基因多态性。在正常人体内, 三甲胺经 FMO3 代谢产生三甲胺氮氧化物, 尿中回收的氮氧化物与原形含量的比值为 97∶3, 而在FMO3 基因表达异常的人体内, 三甲胺代谢严重不足, 氮氧化物与原形含量的比值仅为 1∶9, 从而引发“鱼腥综合征”[21, 22].
1.3 药物相互作用 与 P450 酶不同, 有关 FMO 抑制剂和诱导剂的报道较少。FMO 的经典抑制剂有吲哚甲醇[23, 24]和甲硫基咪唑[25]等。Zaragoza 等[26]报道苯巴比妥可以提高 FMO 介导的硫代乙酰胺生物活化的程度, 从而导致硫代乙酰胺在大鼠体内肝毒性增加。此外, 性激素等内源性物质可以诱导 FMO3 活性[27], 孕妇在服用经 FMO3 代谢的药物时应考虑到这一点。
2 单胺氧化酶 (MAO)
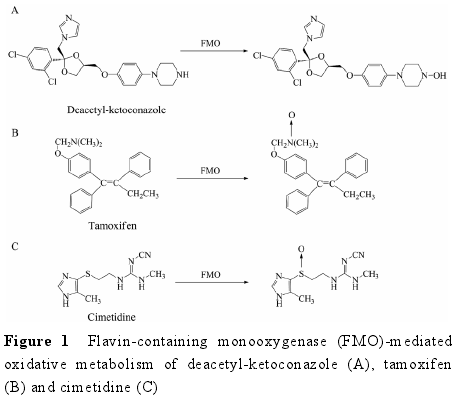
2.1 底物类型 MAO 是存在于线粒体外膜上的一类氧化酶, 可以催化胺类化合物 (伯、仲、叔胺) 发生氧化脱氨或脱氢反应[28, 29].MAO 催化的氧化反应不需要辅助因子的参与。人的脑、肝和胎盘组织中均存在 MAO[30].MAO 共有两个亚型, 分别为 MAO-A和 MAO-B[29].MAO-A 的常见底物有肾上腺素和 5-羟色胺[29]等内源性物质。此外, 与 5-羟色胺具有类似结构的药物如舒马曲坦 (sumatriptan, 图 2A) 也可被MAO-A 广泛代谢[4, 31].MAO-B 的常见底物有 β-苯乙胺、苄胺和司来吉兰等[32].与 P450 酶类似, MAO 能够介导化合物发生氧化代谢产生毒性代谢物。例如,MAO-B 氧化 1-甲基-4-苯基-1,2,3,6-四氢吡啶 (MPTP,图 2B) 形成 1-甲基-4-苯基-2,3-二氢吡啶 (MPDP+)中间体, 最终生成 1-甲基-4-苯基吡啶 (MPP+)[33].MPP+是一种神经毒素, 可导致脑黑质线粒体中毒,产生与帕金森症类似的症状[34].
2.2 药物相互作用 由于 MAO 能催化神经递质的代谢, 寻找 MAO 的可逆或不可逆抑制剂, 增加神经递质在体内的水平, 对于抑郁症及帕金森症的治疗具有重要意义[30, 35, 36].文献[6, 37]报道的 MAO 抑制剂有氯吉兰、苯乙肼、艾梦克酮和拉扎贝胺等。此外,Fowler 等[38]报道烟草中的尼古丁能够降低吸烟者体内的 MAO 水平, 增加体内去甲肾上腺素水平, 进而引发一系列中枢及外周神经效应。目前, 关于 MAO 被外源性物质诱导的报道较少。Sarabia 等[39]指出雌二醇可以诱导仓鼠肾脏中的MAO-B 水平, 增加儿茶酚胺类化合物的脱胺代谢过程, 该过程产生过氧化氢和羟基自由基等有毒物质,可能导致肾肿瘤的发生。
3 醛氧化酶 (AO)
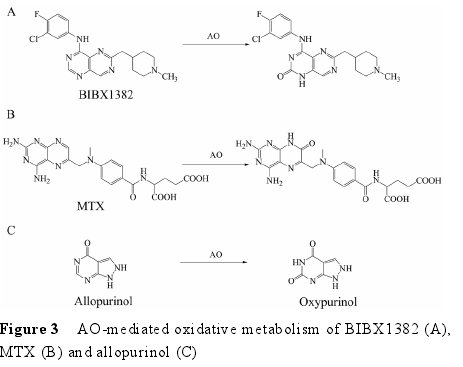
3.1 底物类型 AO 是一类广泛存在于胞浆中的高度保守的钼?黄素蛋白, 除了催化醛生成羧酸外, 还能催化含氮杂环类化合物的氧化过程, 以及一些化合物,如芳硝基化合物[40, 41]、环氧化物[42]、氮氧化物[43, 44]和亚砜[45]等的还原过程。本文重点阐述 AO 催化的氮杂环类化合物的氧化反应。这类反应通常表现为芳香环中杂原子邻位的碳被氧化。表皮生长因子受体抑制剂 BIBX1382 (图 3A)、抗肿瘤药甲氨蝶呤 (MTX,图 3B), 以及治疗痛风的药物别嘌呤醇 (allopurinol,图 3C) 等[5, 46?48]均为 AO 的常见底物。
 3
3
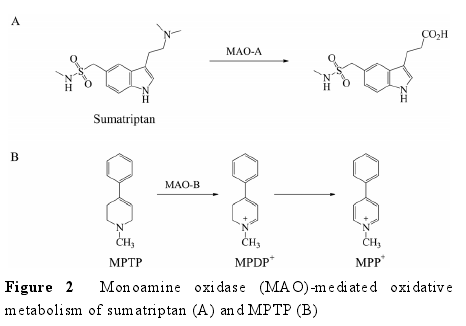
3.2 种属差异 AO 存在明显的种属及个体差异[1, 49,50].目前, 共有 4 种亚型被鉴定, 分别为 AOX1、AOX3、AOX4 和 AOX3l1[51, 52].Garattini 等[52]总结了人、黑猩猩和常用实验动物的肝及其他组织表达的 AO 亚型 (表 1)。