摘 要: 目的:讨论伏立康唑体内血药浓度个体差异大的影响机制,为临床合理使用伏立康唑提供依据。方法:回顾性分析109名使用伏立康唑的患者,分析其CYP2C19基因型,测定血中伏立康唑及其主要代谢物浓度,统计分析性别,年龄,溶酶,CYP2C19 基因型、C反应蛋白,药物相互作用对伏立康唑血药浓度的影响,并统计分析使用伏立康唑前后肝酶指标的情况。结果:性别、年龄及临床常用溶媒对伏立康唑血药浓度无显着性影响;不同基因型之间,伏立康唑血药浓度及代谢物浓度之间无显着性差异,代谢率(代谢物浓度与原药浓度比值)有显着性差异;随着C反应蛋白增加,伏立康唑浓度升高,并在<40、40-200、>200组间具有显着性差异。质子泵抑制剂能显着性影响伏立康唑浓度,其他利尿剂、激素对伏立康唑血药浓度无统计学意义。结论:伏立康唑血药浓度受影响因素较多,对于临床重症患者更应该加强血药浓度监测。
关键词: 伏立康唑; 血药浓度监测; 影响因素。;
Abstract: OBJECTIVE To assess clinical factors and drug interactions that may affect the mechanism of the variability of voriconazole plasma concentration. METHOD Medical records were reviewed for patients who received voriconazole and had at least 1 concentration measured. The study included 109 patients with 125 voriconazole trough concentrations. Relationship of multiple factors including sex, age, vehicle, CYP2C19, drug combination and the level of C-reaction protein were identified. Furthermore, liver functions were assessed before and after the therapy. RESULTS The results showed that with the increase of CRP, the trough concentration increased. There was no statistical significance in the interaction between sex, enzyme or drug. Determination of voriconazole metabolites in human plasma by ultra fast liquid chromatography tandem mass spectrometry method, determination of CYP2C19 genotype, analysis of the influence of genotype on blood concentration, showed no statistical significance, but metabolic rate was significant. CONCLUSION Voriconazole therapeutic drug levels are variable and can be affected by several factors such as co-administrated with PPI as well as inflammation.
Keyword: voriconazole; therapeutic drug monitoring; factors;
伏立康唑是在氟康唑的结构基础上合成的一种新型三唑类广谱抗真菌药,主要对急性侵袭性曲霉菌、耐氟康唑严重的侵袭性念珠菌属、足放线病菌属和镰刀菌属有很好的抗菌活性[1]。伏立康唑由CYP2C19介导代谢,具有代谢饱和性,因此其体内呈非线性药代动力学,与其他唑类药物相似,伏立康唑在体外研究时即发现其游离药物浓度曲线下面积与最小抑菌浓度的比值与其PK-PD具有相关性,因此临床上将治疗药物监测作为预测临床疗效及避免不良反应的主要工具[2]。当伏立康唑谷浓度>2 mg×mL-1,可获得88%以上的临床有效率,当谷浓度<2 mg×mL-1有效率仅有54%;当谷浓度超过5~6 mg×mL-1 时,神经毒性、视觉障碍和肝毒性等不良反应发生率明显升高[3,4]。研究发现伏立康唑血药浓度个体差异大[5],影响因素包括年龄、肝肾功、CYP2C19基因多态性、以及由CYP2C19介导的药物相互作用等。随着进一步研究,发现伏立康唑血药浓度的差异除了上述因素外,尚有未阐明的机制,部分文献报道了,激素、利尿剂等的使用以及患者感染程度等也可能是影响伏立康唑血药浓度的因素,本文纳入109名使用伏立康唑并开展血药浓度监测的患者进行分析,包括性别、年龄、溶媒、CYP2C19基因型、药物相互作用以及体现感染程度的C反应蛋白(C-reaction protein,CRP)[6,7],意在进一步讨论伏立康唑血药浓度个体差异大的影响机制,为临床合理使用伏立康唑提供依据。
1. 研究对象
收集整理2015年1月至2017年2月使用伏立康唑并且达稳态(使用负荷剂量,维持剂量使用2 d以上;未使用负荷剂量时,维持剂量至少3 d以上)使用用情况。排除使用伏立康唑未达稳态或采血期间有血液净化的患者。
2. 方法
2.1、 血药浓度测定方法
本研究采用的是已建立的超快速液相串联质谱法测定人血浆中伏立康唑及其代谢物N-氧化伏立康唑浓度。伏立康唑治疗达稳态后于次日清晨给药前抽取静脉血于抗凝管中,3 500 rpm离心后,取上清血浆180 mL,加20 mL甲醇,涡旋10 s,加入1 000 mL含有800 ng×mL-1格列本脲的甲醇溶液,涡旋3 min后10 000 rpm离心10 min,取上清5 mL进样进行分析,具体分析条件及相关方法学验证见文献[8]。
2.2、 CYP2C19基因型检测
采用PROMEGA基因组DNA提取试剂盒提取DNA,PCR扩增目的片段(PCR引物见表1),经凝胶电泳验证后,由华大基因采用直接测序法检测CYP2C19基因型。
表 1 PCR引物 导出到EXCEL

2.3、 统计学分析方法
归纳整理数据,应用SPSS 17.0统计软件对数据处理,单因素方差分析性别、年龄、溶媒、基因型及CRP对伏立康唑血药谷浓度及谷浓度与剂量比的影响,应用多重线性回归分析联合用药对伏立康唑血药谷浓度的影响程度,应用成对t检验评估患者伏立康唑用药前与用药后肝酶指标的情况。
3. 结果
3.1、 患者基本资料
共纳入病历109例,其中男性75例,占68.8%,女性34例,占31.2%,平均年龄(63.42±23.34)岁,45岁以下青年患者25例,占22.9%,45~59岁中年患者18例,占16.5%,59岁以上患者66例,占60.6%。原发疾病以血液系统恶性肿瘤及实体器官移植为主,感染部位为肺部感染。本研究中伏立康唑给药方式均为静脉给药,涉及的牌子包括辉瑞制药有限公司的威凡及珠海亿邦制药有限公司的注射用伏立康唑。
3.2 浓度分布情况
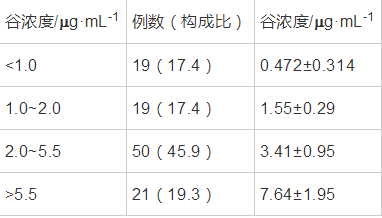
根据既往多中心临床研究以及前期临床观察,伏立康唑血药谷浓度范围在2.0-5.5 mg·mL-1时,临床疗效最佳且不良反应发生率较低[3,4]。因此根据此范围对血药浓度情况进行分组分析,其中45.9%的患者血药浓度在2.0-5.5 mg·mL-1内,<1.0占17.4%,1.0-2.0占17.4%,>5.5占19.3%。谷浓度>5.5 mg·mL-1的21名患者中,11名患者年龄大于60岁。
表 2伏立康唑血药浓度分布情况 导出到EXCEL >5.5
3.3、性别
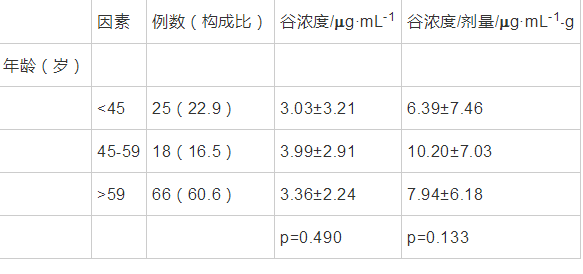
根据性别以及不同年龄组的血药谷浓度及谷浓度剂量比做单因素方差分析、成对,结果显示无统计学意义,见表3、表4。
表 3性别对伏立康唑谷浓度单因素分析 导出到EXCEL
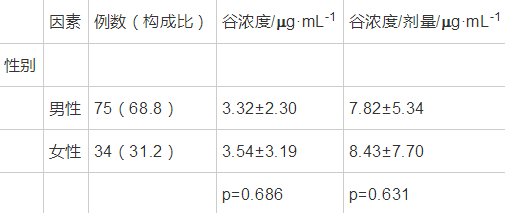
表 4年龄对伏立康唑谷浓度单因素分析 导出到EXCEL
3.4、 溶媒
伏立康唑溶解度极低,临床使用的注射液品种较多,不同厂家增加溶解度的方法也不同,包括羟丙基环糊精包合增加溶解度以及使用乙醇丙二醇作为助溶剂增加溶解度等,注射剂中药物溶解度与临床用药安全性以及体内分布等药代动力学行为相关,溶媒的品种及体积是影响伏立康唑溶解度的重要因素。我院曾发现多例在使用伏立康唑时出现头晕、胸闷等不良反应,同时在伏立康唑输液袋中发现肉眼可见结晶。因此对使用5%葡萄糖和0.9%氯化钠为溶媒的两组血药谷浓度及谷浓度剂量比进行独立样本t检验,结果显示无统计学意义(P=0.200,P=0.315)
3.5、 CYP2C19基因型
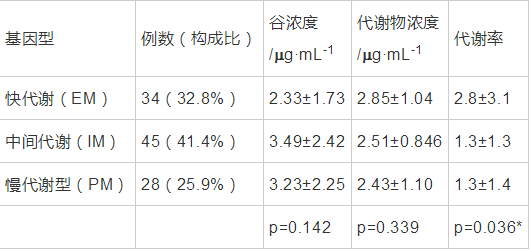
CYP2C19基因多态性目前已发现至少14种突变基因和18种等位基因。CYP2C19*1为具有催化活性的野生型基因,CYP2C19*2和CYP2C19*3在亚洲人群突变率较高,突变后其催化活性降低。本文对纳入人群进行的CYP2C19进行基因分型,对基因型测定,结果分为快代谢型(EM)、中间代谢型(IM)、慢代谢型(PM),以三种基因型分为三组,对数据进行单因素方差分析,所得结果谷浓度及代谢物浓度无统计学意义,代谢率,即代谢物浓度与谷浓度比值,具有统计学差异(P=0.036)。
表 5 CYP2C19基因型对伏立康唑血浆谷浓度、代谢物及代谢率的影响 导出到EXCEL
3.6、 CRP
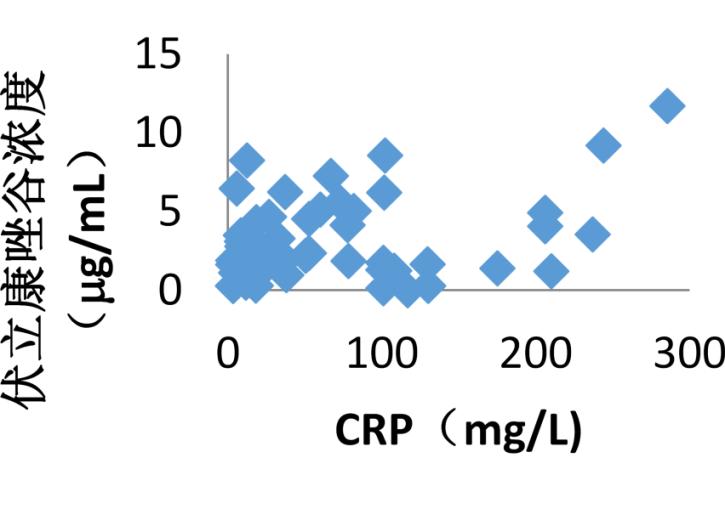
CRP是机体受到微生物入侵或组织损伤等炎症性刺激时肝细胞合成的急性相蛋白,是机体非特异性免疫机制的一部分,在一定程度上体现感染及炎症的严重程度。据部分研究发现[6,7],伏立康唑血浆谷浓度与CRP水平呈现相关性。在所收集的患者中,其中58例患者住院期间测定CRP,根据CRP值分为三组,<40 mg·L-1,40~200 mg·L-1,>200 mg·L-1利用单因素方差分析,结果显示有统计学意义(P=0.024),结果见下表。
表 6 CRP与伏立康唑血浆谷浓度 导出到EXCEL
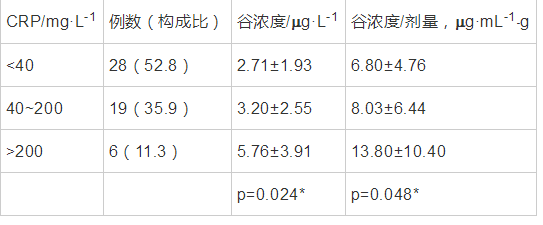
图 1 CRP与伏立康唑血浆谷浓度相关性
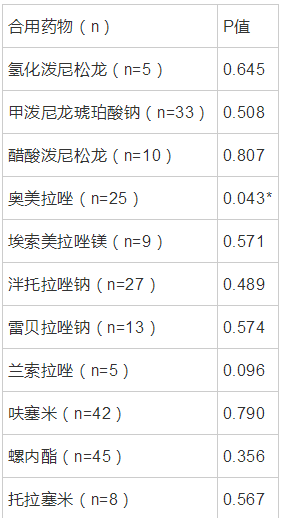
临床深部真菌感染的患者,由于其病情危重程度,导致临床用药比较复杂,可能联用的药物包括质子泵抑制剂、糖皮质激素、利尿剂等,根据前期研究发现,质子泵抑制剂对伏立康唑血药浓度有一定的影响[9],与文献报道一致,本次对患者住院期间联合使用的其它药物与浓度剂量比进行逐步回归分析。其中,奥美拉唑显示有显着性差异。结果如表:
表 7 药物相互作用 导出到
3.7、 不良反应
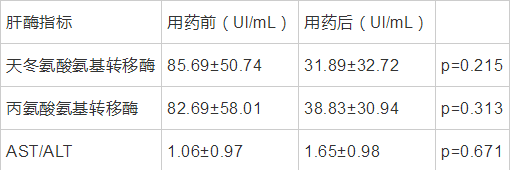
伏立康唑临床常见不良反应包括肝酶指标升高及神经系统异常,本次研究中使用伏立康唑期间出现神经系统异常的患者有6名,具体症状包括幻觉、视觉模糊、肢体麻木等症状。除此之外针对用药前肝酶指标(丙氨酸氨基转移酶、天冬氨酸氨基转移酶及二者比值)异常的患者(n=9),采用配对t-test分析使用伏立康唑前后的指标,考察其是否加重肝损,结果无显着性差异。如表8所示。
表 8用药前及用药后肝酶指标 导出到EXCEL
4.讨论
伏立康唑临床疗效与其血药浓度相关,根据既往多中心研究,其血药谷浓度个体差异大,临床疗效与其血药浓度相关,目前临床已广泛利用血药浓度监测开展个体化治疗方案。本研究纳入的109名患者,以2.0-5.5 mg·mL-1为范围,有54.1%的患者浓度不在正常范围内,证明伏立康唑在临床使用存在较大的个体差异。
从性别、年龄、基因型、溶媒以及感染程度进行了统计分析。结果表明,性别统计学无明显差异。据文献报道,CYP2C19在男性中的酶活性高于女性,特别是对其特征性底物奥美拉唑的研究中发现,女性奥美拉唑血药浓度高于男性。但在本次结果中无显着性差异,由于伏立康唑除CYP2C19外,CYP3A4也介导伏立康唑的代谢,尤其当伏立康唑体内浓度偏高时;另外也可能是伏立康唑体内浓度较其Km值高而导致性别差异不明显。CYP2C19基因多态性与伏立康唑血药谷浓度进行分析时发现纳入研究的患者中慢代谢基因型占25.9%,中间代谢占41.4%,基因型比例与文献报道亚洲人群2C19基因型分布相符[4], 但在本次研究中基因型对谷浓度及代谢物浓度影响无统计学意义,对代谢率有统计学意义,可能与纳入研究的例数有限、患者间体重剂量差异以及机体对药物处置其它环节的影响导致无统计学差异,但代谢率排除了其它相关影响因素表现出与基因型相关,并具有统计学意义。
部分研究表明,伏立康唑血药谷浓度与CRP有关[10],本次结果发现随着CRP增加,谷浓度有升高的趋势,并且具有统计学意义,其可能机制是,随着感染发展,炎症因子下调对肝脏P450酶的转录和表达,从而影响伏立康唑代谢速率,造成体内血药浓度的升高[11,12]。据文献报道,尤其当年龄小于12的青少年在使用伏立康唑时,CRP偏高带来的也影响显着高于普通成年人,可能与婴幼儿及青少年阶段P450酶含量较高,因此影响更为显着。然而,相关临床观察及意义还需进一步研究。
伏立康唑在一项多中心临床研究中发现,排除性别、年龄、基因型等因素,联合用药对其血药浓度具有影响。涉及的药物相互作用包括糖皮质激素及P450酶相关的诱导剂及抑制剂[9],本研究在分析药物相互作用时,纳入的药物包括糖皮质激素、利尿剂、质子泵抑制剂、通过逐步多元线性回归分析得出,奥美拉唑较强的CYP2C19抑制剂对其血药浓度影响较大,具有显着性差异,其它尚无统计学意义。
伏立康唑临床常见不良反应有肝功能异常及神经系统异常,不良反应的发生与体内药物浓度水平相关,本次研究中应用成对t检验统计分析用药前后肝酶指标的差异,未表现出具有显着性相关且有所降低,主要可能与是骨髓移植后的患者出现移植物抗宿主病,引起肝功能异常,随着治疗好转肝酶指标恢复正常有关,也可能与纳入的研究例数较少有关。后期将继续扩大样本量继续探讨相关内容。
伏立康唑作为目前深部真菌感染一线药物,其血药浓度的个体差异还存在尚需研究的因素,本文收集整理相关实验室及病例资料进行统计,从基因型、年龄、性别、溶媒、感染程度及药物相互作用进行统计分析,为临床用药及血药浓度结果解读提供了依据。
参考文献:
[1]Shiner, C. & Martin, C. Guidelines for Measuring Voriconazole Concentrations Task Force Members.
[2]Kuo, I. F. & Ensom, M. H. H. Role of Therapeutic Drug Monitoring of Voriconazole in the Treatment of Invasive Fungal Infections [J]. Can. J. Hosp. Pharm. 2009(62):469-482.
[3]Matsuda, T. et al. A case of Aspergillus empyema successfully treated with combination therapy of voriconazole and micafungin: excellent penetration of voriconazole and micafungin into pleural fluid [J]. Intern. Med. 2010(49):1163-1169.
[4]Gautier E. et al. Variability of voriconazole plasma concentrations after allogeneic hematopoietic stem cell transplantation: Impact of cytochrome P450 polymorphisms and comedications on initial and subsequent trough levels [J]. Antimicrob. Agents Chemother. 2015(59): 2305-2314.
[5]Jing- W, Jin He, Lu- W et al. Retrospective Analysis of Voriconazole plasma concentration in 61 patiens [J],Chin Hospital Pharm J,2016(36)770:773
[6]Van Wanrooy, M. J. P. et al. Inflammation is associated with voriconazole trough concentrations [J]. Antimicrob. Agents Chemother. 2014(58):7098-7101.
[7]Jing-, W, Qiong Zhou, Hua Huang et al. A simple and accurate method for the determination of voriconazole concentration in human plasma with UHPLC-MS/MS [J]. Chin Hospital Pharm J,2014(34):10-13.
[8]Pascual, A. et al. Voriconazole therapeutic drug monitoring in patients with invasive mycoses improves efficacy and safety outcomes [J]. Clin. Infect. Dis. 2008(46):201–211.
[9]Dolton, M. J. et al. Multicenter study of voriconazole pharmacokinetics and therapeutic drug monitoring. Antimicrob [J]. Agents Chemother. 2012(56):4793-9.
[10]Encalada Ventura, M. A., Span, L. F. R., Van Den Heuvel, E. R., Groothuis, G. M. M. & Alffenaara, J. W. C. Influence of inflammation on voriconazole metabolism [J]. Antimicrob. Agents Chemother. 2015(59):2942-2943.
[11]Morgan, E. T. Regulation of Cytochrome P450 by Inflammatory Mediators: Why and How? [J] Drug Metab. Dispos. 2001(29):207–212.
[12]Richardson, T. a & Morgan, E. T. Hepatic Cytochrome P450 Gene Regulation during Endotoxin-Induced Inflammation in Nuclear Receptor Knockout Mice [J]. J. Pharmacol. Exp. Ther. 2005(314):703–709.