摘 要: 阿片类药物是控制癌症疼痛(简称癌痛)的重要药物,若品种及剂量使用不当,将会进一步造成肾脏损伤。癌症患者由于疾病本身或并发症的进展,可能会伴有肾功能不全。因此存在肾功能不全风险的癌痛患者,必须正确评估肾功能状态,结合疼痛程度和阿片类药物特性,正确选择药品品种和剂量。该文综述常用阿片类药物的药动学特征、肾功能不全患者和透析患者阿片类药物的选择等,以期为临床合理用药提供参考。
关键词: 阿片类药物; 肾功能不全; 癌症疼痛;
Abstract: Opioids are important drugs to control cancer pain.When the wrong kind of opioids or wrong dose are used,it will further cause kidney injury. Cancer patients may be associated with renal dysfunction due to the progression of the disease itself or complications.Therefore,cancer pain patients with the risk of renal dysfunction must correctly evaluate the state of renal function,and correctly select the variety and dose of drugs according to the degree of pain and the characteristics of opioids.This article reviews the pharmacokinetic characteristics of commonly used opioids and the selection of opioids in patients with renal dysfunction and dialysis patients,in order to provide clinical reference for rational use of opioids.
Keyword: Opioid drugs; Renal dysfunction; Cancer pain;
癌症疼痛(简称癌痛)是慢性疼痛的一种,其治疗多以阿片类药物为主[1]。在一项超过4500例肿瘤患者的流行病学调查中发现,约20%的患者肾小球滤过率(glomeruar filtration rate,GFR)<50 m L·min-1[2]。肾功能不全会导致药物清除率下降、原药及代谢产物蓄积、毒副反应发生率上升。如何为这部分患者选择合适的阿片类药物,是临床医务人员的当务之急。笔者从阿片类药物药动学特点出发,讨论这一类药物在肾功能不全患者中的应用。
1 、常用阿片类药物的药动学特点
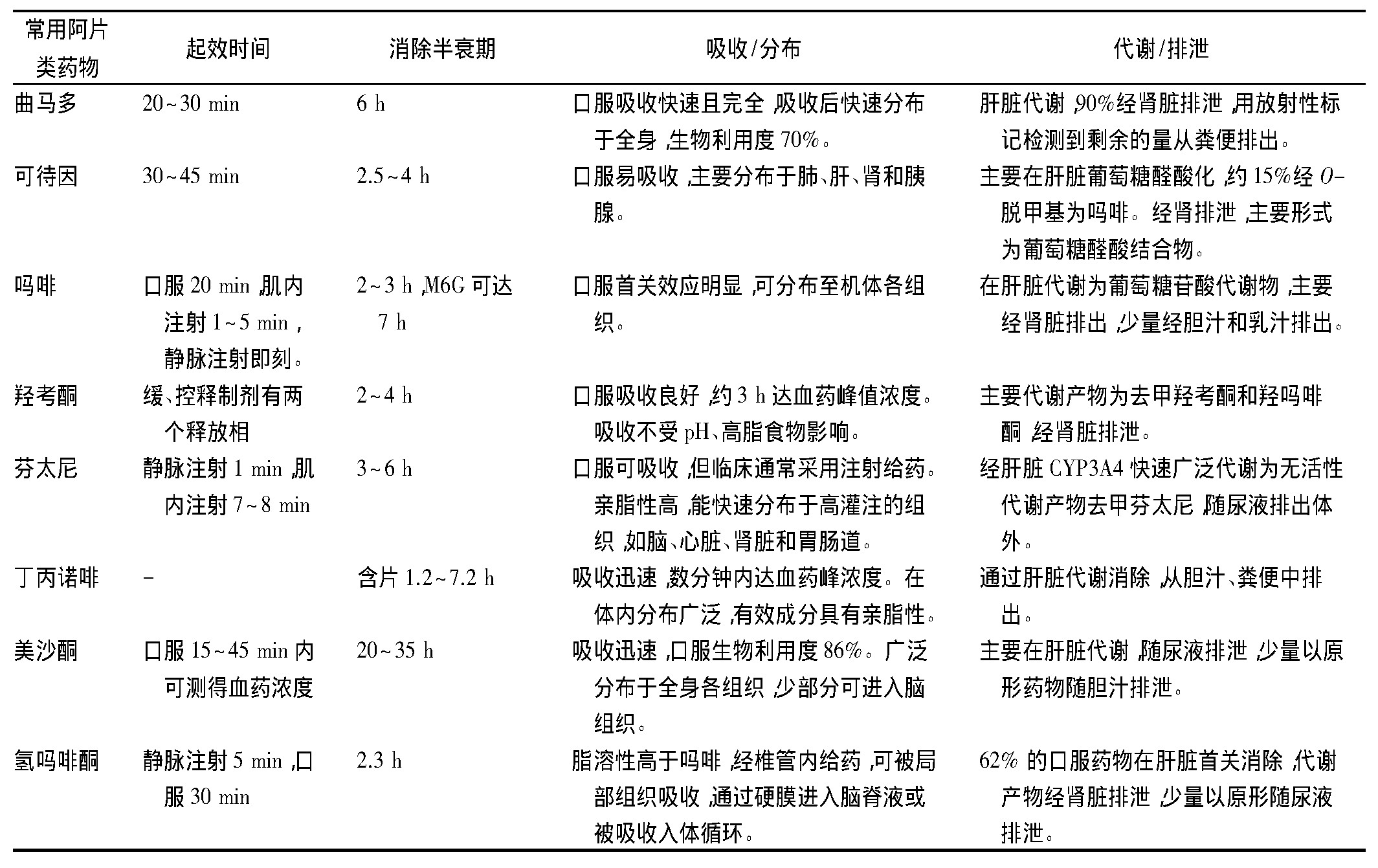
1.1、 曲马多
作为WHO癌痛治疗第二阶梯代表药物,曲马多因其镇痛效果好、成瘾性低,广泛应用于轻中度癌痛患者。曲马多对μ受体的亲和力为可待因的1/10,但进入人体后被代谢为强活性的O-脱甲基化产物M1,M1对μ受体的亲和力比母体高300倍。该药具有独特的双相镇痛作用,既是中枢阿片受体激动药,又是去甲肾上腺素和5-羟色胺的再摄取抑制药,能够增强中枢神经系统中与疼痛传递相关的下行抑制信号[3]。曲马多及其代谢产物90%经肾脏排泄,约有0.1%的剂量进入乳汁[4]。

1.2、 可待因
可待因由吗啡分子中的3位酚羟基甲基化所得,效力约为吗啡的1/10。已知可待因的代谢产物中,可待因-6-葡萄糖醛酸(codeine-6-glucuronic acid,C6G)占80%;次要途径为经O-脱甲基化代谢为吗啡,进而通过肾脏排泄[5]。
1.3、 吗啡
吗啡是从植物罂粟中提取出来的一种阿片类生物碱,是治疗中重度疼痛的基础用药。吗啡在体内主要经肝脏的尿苷二磷酸葡萄糖醛酸转移酶2B7代谢为吗啡-3-葡萄糖醛酸(morphine 3-glucuronic acid,M3G)和吗啡-6-葡萄糖醛酸(morphine-6-glucuronic acid,M6G)。M6G可刺激μ受体,参与产生镇痛活性,而M3G可能与某些不良反应相关[6]。M3G和M6G的排泄主要依靠肾脏,并与肌酐清除率高度相关[7]。M6G半衰期比母药更长,易在肾功能受损的患者体内蓄积。
1.4、 羟考酮
羟考酮口服生物利用度高,为50%~87%,经肝脏CYP3A4酶代谢为去甲羟考酮,再由CYP2D6酶代谢为羟吗啡酮。羟吗啡酮对μ受体的亲和力比羟考酮高10~45倍,效力是羟考酮的8~30倍,但由于含量极微,一般认为不具备药理学活性[8]。羟考酮主要与白蛋白结合,蛋白结合率38%~45%。羟考酮及其代谢产物主要通过肾脏排泄,其中原形占9%~11%,去甲羟考酮23%,羟吗啡酮10%,去甲羟吗啡酮14%,其他代谢物≤18%[9]。
1.5 、芬太尼
芬太尼是一种纯合成的阿片类药物,在体内与μ和κ受体结合后发挥镇痛作用,镇痛强度为吗啡的50~100倍。芬太尼透皮贴剂是应用最广泛的芬太尼剂型,药物以恒定的速率释放,机体的72 h吸收率可达94%[10]。芬太尼主要经肝脏CYP3A4酶代谢为无药理活性的去甲芬太尼,随后经肾脏排泄,其中代谢产物占75%,原形占10%,代谢产物没有药理活性,不易引起蓄积。研究表明,芬太尼透皮贴剂在肾功能不全患者中长期应用相对安全[11]。
1.6 、丁丙诺啡
丁丙诺啡是μ阿片受体部分激动药,美国食品药品管理局(FDA)批准用于治疗中至重度、需连续不断长时间使用阿片类镇痛药物的疼痛。在慢性非癌痛的临床试验中[12],丁丙诺啡镇痛效果明显优于安慰药。舌下制剂吸收迅速,生物利用度30%~40%,在体内主要由CYP3A4酶介导经N-脱烷基化形成去甲丁丙诺啡。与其他阿片类药物不同,丁丙诺啡可经肝肠循环,最终大部分经胆汁由粪便排泄。
1.7 、美沙酮
与吗啡和其他阿片类药物相比,美沙酮具有成本低、口服生物利用度高、半衰期长等优点。MERCADANTE等[13]比较了3种强阿片类药物(缓释吗啡、芬太尼透皮贴剂和美沙酮)在可待因或曲马多治疗无效的轻中度癌痛患者中的有效性。结果表明,3种药物在控制疼痛(疼痛强度降低>30%)方面效果类似。该药口服吸收迅速,2.5~4 h血药浓度达峰值。体内主要经CYP3A4和CYP2B6酶系N-去甲基化为无活性的代谢产物,20%~50%以原形或其代谢产物形式经肾排泄,其余由粪便排出[14]。
1.8 、氢吗啡酮
氢吗啡酮是半合成的μ阿片受体激动药,镇痛强度是吗啡的5~10倍,且更易透过血脑屏障。氢吗啡酮在体内不通过P450酶系代谢,而是被葡萄糖苷化为无镇痛活性的氢吗啡酮-3-葡糖苷酸(hydromortenone-3-glucosidate,H3G),随后经肾排泄[15]。以上药物的药动学特征见表1。
2 、肾功能不全癌痛患者阿片类药物的选择
肾功能不全患者由于药物的吸收、分布、代谢、排泄,尤其是排泄发生变化,可致药物蓄积,导致不良反应风险增加,对于此类患者应根据阿片类药物的药动学特点选择合适的药物,在镇痛治疗的同时,密切监测肾功能,以达到安全有效的疼痛管理。
肾衰竭患者使用曲马多后可出现幻觉、癫危象和呼吸抑制等严重不良事件,应用曲马多时需要根据GFR来调整剂量或延长给药间隔时间[16,17,18]。
在中重度肾功能不全患者中,可待因及其代谢产物的清除率显着降低,半衰期可达到18 h;此外,代谢产物M6G的蓄积会进一步导致严重的不良反应,如镇静、呼吸抑制和低血压[19]。鉴于目前可替代的阿片类药物很多,肾功能不全患者禁用可待因。
肾功能不全时使用吗啡会致M6G蓄积,可能产生严重的神经毒性[20]。有专家提出可以根据GFR调整吗啡剂量[21],但这一建议并没有被完全接受,特别是当有其他更安全的阿片类药物可用时,应避免在肾衰竭患者中使用吗啡[22]。
与吗啡相比,肾功能不全患者使用羟考酮后血药浓度增幅较小,可以考虑作为轻中度肾功能不全患者的二线用药[23],但需要根据肌酐清除率和患者耐受情况调整剂量及给药间隔。《慢性肾脏病疼痛管理》指南[24]指出,中度疼痛的肾衰竭患者可以考虑使用小剂量羟考酮速释剂型(2.5~5 mg,q8 h或q12 h),缓释制剂在肾功能不全方面缺乏研究数据,应避免使用。
芬太尼在肾功能不全患者中药动学改变不明显,合并肾功能损伤的癌痛患者应用芬太尼透皮贴剂前后,肾功能无明显变化,不良反应轻微[25]。在严密监测的情况下芬太尼可长期安全地应用于肾功能不全患者[26]。
表1 阿片类药物的药动学参数
丁丙诺啡经皮给药避免了肠道阿片受体暴露于活性药物,不易引起便秘。与其他阿片类药物相比,丁丙诺啡呼吸抑制风险低,不抑制免疫系统,肾功能不全患者体内不蓄积,具有良好的安全性[27],在谨慎使用下,可以用于肾功能不全患者。
美沙酮作用时间较长,不易产生耐受性,是良好的阿片类维持治疗药物。肾功能不全时,美沙酮可经肠道代偿性排泄,在体内积聚很少,是治疗患有慢性肾脏疾病的癌痛患者一种相对安全的长效阿片类药物[28]。尽管美沙酮在肾功能不全人群中具有良好的药动学特征,但其药动学较为复杂,个体差异较大,重复给药后,不同个体的半衰期可能在8~80 h,且半衰期随着年龄的增加而延长,临床在使用该药时需要密切监测患者肾功能情况。
氢吗啡酮与吗啡相比,耐受性更好、神经兴奋效应更小,在肾衰竭时不会大量蓄积,是晚期肾病患者首选的短效阿片类药物。研究表明,在未发生严重不良反应的情况下,肾功能不全患者使用氢吗啡酮可以减少65%的疼痛[29]。氢吗啡酮虽主要经历肝脏代谢,但与肾功能正常的患者相比,中度肾功能不全患者对氢吗啡酮的暴露量会增加2倍,重度时增加4倍,因此中重度肾功能不全时建议调整剂量。常用阿片类药物在肾功能不全患者中的应用见表2。
3 、透析患者阿片类药物的选择
对于终末期肾衰竭的患者,最为有效的治疗方式为血液透析。在透析过程中,不同的阿片类药物稳定性可能会有所不同,应用时需特别谨慎。
透析对曲马多的血药浓度没有明显影响,原药和代谢产物M1在4 h的透析期间(血液透析、间断性或持续性血液滤过和腹膜透析)被清除的总量小于所给剂量的7%[30],因此患者可以在透析日接受常规剂量,每天曲马多的最大剂量不超过50 mg,bid。笔者目前还未见关于透析患者接受曲马多缓释制剂的研究报道。透析患者应尽量避免使用曲马多缓释制剂。
可待因在体内分布广泛,不被透析清除,会导致有毒物质的积累,禁用于透析患者。
血液透析可清除吗啡及其代谢产物,使其血药浓度产生较大波动,透析当天应用的吗啡可能会在与靶器官结合前就被透析膜滤过,导致出现反跳痛,患者需求量增加,易诱发严重的毒性反应。腹膜透析不能有效地清除M6G[31],单次静脉注射10 mg吗啡后代谢产物M6G大量积累,浓度几乎是肾功能正常患者的14倍。如有可能,应尽量避免在透析患者中使用吗啡,若无可替代药物,应在严密监测下使用。
表2 阿片类药物在肾功能不全患者中的剂量调整

羟考酮因缺乏血液透析中的药动学数据,曾一度认为不能应用于透析患者。但有研究表明[32],羟考酮能被血液透析清除,在行血液透析的终末期肾病患者中药动学数据无明显变化,可按常规剂量使用。由于羟考酮的蛋白结合率低,低蛋白血症患者在透析过程中或透析后不容易出现反跳痛,无需额外补充剂量。
芬太尼透皮贴剂蛋白结合率高、相对分子质量及表观分布容积大、水溶性低,不易透过透析膜,可以维持稳定的血药浓度,被认为是透析患者镇痛的一线用药[33],但芬太尼可以直接吸附到某些特定的透析膜上,从而降低血药浓度,使用时需注意。
丁丙诺啡不经过肾脏清除,优先考虑用于肾功能不全及透析的患者,但作为阿片受体部分激动药,丁丙诺啡每次最多同时使用2贴,限制了其在癌痛患者中的应用。研究发现,丁丙诺啡及其活性代谢产物去甲丁丙诺啡在透析前后血清总浓度无明显变化,但当患者有明显的低蛋白血症时,处于游离形式的丁丙诺啡可被透析清除,导致药物浓度显着降低[34,35]。为了预防血液透析期间和(或)透析后爆发痛的发生,此类患者应在透析开始时考虑补充丁丙诺啡。
OPDAL等[36]观察了血液透析对美沙酮药动学的影响,结果表明,美沙酮的清除率低,透析过程中不需要额外补充剂量。相较其他阿片类药物,美沙酮具有口服生物利用度高(>80%)、脂溶性、分布体积广(4.1~6.7 L·kg-1)和蛋白结合力高(60%~90%)等特点,可能是需要血液透析的终末期肾病患者阿片类药物的替代选择。
氢吗啡酮的低分布容积(1.22 L·kg-1)、低蛋白结合率(19%)、低相对分子质量和高水溶性,使其能被有效地透析清除,可安全应用于血液透析。患者透析前后血药浓度相比下降了60%[37],透析后出现爆发痛和阿片类药物戒断症状的风险更高[38]。
常见阿片类药物在透析患者中的应用见表3。
表3 阿片类药物在透析患者中应用

4、 结束语
肾功能不全对阿片类药物的药动学可产生显着影响,导致治疗效果下降、不良反应发生率及严重程度升高。对于肾功能不全的癌痛患者,选择合适的阿片类药物是肾功能不全疼痛管理的重要策略之一。可待因禁用于肾功能不全的患者。曲马多、吗啡、羟考酮、芬太尼、氢吗啡酮应用于肾功能不全患者需注意调整给药剂量或延长给药间隔时间;重度肾功能不全者禁用羟考酮。美沙酮和丁丙诺啡在肾功能不全时无需调整剂量,可在某些情况下代替芬太尼应用于透析患者,但需在密切监测下使用。总之,对于肾功能不全的癌痛患者,必须正确评估患者的肾功能状态、尽量准确评估疼痛程度,针对所选药物的常见和严重不良反应进行监测,密切关注肾功能,在全面评估患者病情的基础上合理选择药物。
参考文献
[1]伊佳,侯幸赟,黄立峰,等.临床药师参与癌痛伴肾功能不全患者止痛方案的实践与经验[J].药学实践杂志,2016,34(5):474-477.
[2] LAUNAY-VACHER V,OUDARD S,JANUS N,et al.Prevalence of renal insufficiency in cancer patients and implications for anticancer drug management:the renal insufficiency and anticancer medications (IRMA) study[J].Cancer,2007,110(6):1376-1384
[3] BEAKLEY B D,KAYE A M,KAYE A D.Tramadol,pharmacology,side effects,and serotonin syndrome:a review[J].Pain Physician,2015,18(4):395-400.
[4]ILETT K F,PAECH M J,PAGE-SHARP M,et al.Use of a sparse sampling study design to assess transfer of tramadol and its O-desmethyl metabolite into transitional breast milk[J].Bri J Clin Pharmacol,2008,65(5):661-666.
[5]李倩倩,林忠泽,张清民,等.可待因的人体代谢及药物相互作用研究综述[J].山东化工,2019,48(10):76-78,80.
[6] HAMAMOTO‐HARDMAN B D,STEFFEY E P,WEI-NER D,et al.Pharmacokinetics and selected pharmacodynamics of morphine and its active metabolites in horses after intravenous administration of four doses[J].J Vet Pharmacol Ther,2019,42(4):401-410.
[7] KING S,FORBES K,HANKS G,et al.A systematic review of the use of opioid medication for those with moderate to severe cancer pain and renal impairment:A European Palliative Care Research Collaborative opioid guidelines project[J].Pall Med,2011,25(5):525-552.
[8] LALOVIC B,KHARASCH E,HOFFER C,et al.Pharmacokinetics and pharmacodynamics of oral oxycodone in healthy human subjects:role of circulating active metabolites[J].Clin Pharmacol Ther,2006,79(5):461-479.
[9] KINNUNEN M,PIIRAINEN P,KOKKI H,et al.Updated clinical pharmacokinetics and pharmacodynamics of oxycodone[J].Clin Pharmacokinet,2019,58(6):705-725.
[10]KORNICK C A,SANTIAGO-PALMA J,KHOJAINOVA N,et al.A safe and effective method for converting cancer patients from intravenous to transdermal fentanyl[J].Cancer,2001,92(12):3056-3061.
[11]KURITA G P,LUNDSTROM S,SJOGREN P,et al.Renal function and symptoms/adverse effects in opioid-treated patients with cancer[J].Acta Anaesthesiologica Scandinavica,2015,59(8):1049-1059.
[12] MESKE D S,LAWAL O D,ELDER H,et al.Efficacy of opioids versus placebo in chronic pain:A systematic review and meta-analysis of enriched enrollment randomized withdrawal trials[J].J Pain Res,2018,11:923-934.
[13]MERCADANTE S,PORZIO G,FERRERA P,et al.Sustained-release oral morphine versus transdermal fentanyl and oral methadone in cancer pain management[J].Eur JPain,2008,12(8):1040-1046.
[14]MOODY D E.Metabolic and toxicological considerations of the opioid replacement therapy and analgesic drugs:methadone and buprenorphine[J].Exp Opin Drug Metabol Toxicol,2013,9(6):675-697.
[15] CHANG A K,BIJUR P E,DAVITT M,et al.Randomized clinical trial of an intravenous hydromorphone titration protocol versus usual care for management of acute pain in older emergency department patients[J].Drug Aging,2013,30(9):747-754.
[16] 2019 American Geriatrics Society Beers CriteriaUpdate Expert Panel.American Geriatrics Society 2019 Updated AGS Beers Criteriafor potentially inappropriate medication use in older adults[J].J Am Geriatr Soc,2019,67 (4):674-694.
[17] GARDNER J S,BLOUGH D,DRINKARD C R,et al.Tramadol and seizures:a surveillance study in a managed care population[J].Pharmacotherapy,2000,20 (12):1423-1431.
[18]MRTAGH F E,CHAI M O,DONOHOE P,et al.The use of opioid analgesia in end-stage renal disease patients managed without dialysis:recommendations for practice[J].J Pain Palliat Care Pharmacother,2007,21(2):5-16.
[19]DEAN M.Opioids in renal failure and dialysis patients[J].JPain Symptom Manag,2004,28(5):497-504.
[20] KURTIA G P,LUNDSTRM S,SJGREN P,et al.Renal function and symptoms/adverse effects in opioid-treated patients with cancer[J].Acta Anaesthesiologica Scandinavica,2015,59(8):1049-1059.
[21] NISCLOA P,SCARAMUCCI L,VISCHINI G,et al.The use of major analgesics in patients with renal dysfunction[J].Curr Drug Targets,2010,11(6):752-758.
[22] OBRIEN T,CHRISTRU L L,DREWES A M,et al.European Pain Federation position paper on appropriate opioid use in chronic pain management[J].Eur J Pain,2017,21(1):3-19.
[23]王菲迪,安晶,吴刚,等.羟考酮在特殊人群中的临床应用研究进展[J].国际麻醉学与复苏杂志,2017,38(10):930-934.
[24]KONCICK H M,UNRUH M,SCHELL J O.Pain management in CKD:a guide for nephrology providers[J].Am JKidney Dis,2017,69(3):451-460.
[25]王雅琦,王美鉴,邱志敏,等.芬太尼透皮贴在肾功能不全的癌痛患者中的应用[J].实用癌症杂志,2012,27(5):529-530.
[26] COLUZZI F.Assessing and treating chronic pain in patients with end-stage renal disease[J].Drugs,2018,78 (14):1459-1479.
[27] WEBSTER L,GUDIN J,RAFFA R B,et al.Understanding buprenorphine for use in chronic pain:expert opinion[J].Pain Med,2020,21(4):714-723.
[28] PHAM P C,KHAING K,SIEVERS T M,et al.2017 update on pain management in patients with chronic kidney disease[J].Clin Kidney J,2017,10(5):688-697.
[29]DAVSION S N,KONCICKI H,BRENNAN F.Pain in chronic kidney disease:a scoping review[J].Semin Dial,2014,27(2):188-204.
[30] VIERIA C,BRAS M,FRAGOSO M.Opioids for cancer pain and its use under particular conditions:a narrative review[J].Acta Med Port,2019,32(5):388-399.
[31] SLATER N A,TODD A M,TRIMMIER M C,et al.Morphine use in renal failure:a case report of single-dose morphine toxicity in a patient requiring peritoneal dialysis[J].J Pharm Pract,2019,6(27):1-4.
[32] LEUPPI-TAEGTMEYER A,DUTHALER U,HAMMANNF,et al.Pharmacokinetics of oxycodone/naloxone and its metabolites in patients with end-stage renal disease during and between haemodialysis sessions[J].Nephrol Dial Transplant,2019,34(4):692-702.
[33]RAINA R,KRISHNAPPA V,GUPTA M.Management of pain in end-stage renal disease patients:short review[J].Hemodial Int,2018,22(3):290-296.
[34]PERGOLIZZI J V,MERCADANTE S,ECHABURU A V,et al.The role of transdermal buprenorphine in the treatment of cancer pain:an expert panel consensus[J].Curr Med Res Opin,2009,25(6):1517-1528.
[35] SALILI A R,MULLER D,SKENDAJ R,et al.Breakthrough pain associated with a reduction in serum buprenorphine concentration during dialysis[J].Clin Ther,2016,38 (1):212-215.
[36]OPDAL M S,ARNESEN M,MULLER L D,et al.Effects of hemodialysis on methadone pharmacokinetics and QTc[J].Clin Ther,2015,37(7):1594-1599.
[37] DURNIN C,HIND I D,WICKENS M M,et al.Pharmacokinetics of oral immediate-release hydromorphone (Dilaudid IR) in subjects with renal impairment[J].Proc West Pharmacol Soc,2001,44:81-82.
[38]PERLMAN R,GILADI H,BRECHT K,et al.Intradialytic clearance of opioids:methadone versus hydromorphone[J].Pain,2013,154(12):2794-2800.