紫杉醇( Paclitaxel) 是从红豆杉属植物中提取出来的一种具有高效抗肿瘤活性的天然物质.紫杉醇水溶解性较差,临床应用主要是紫杉醇/聚氧乙烯蓖麻油注射剂,即由乳浮 EL( Cremophor EL,含增溶剂聚氧乙烯蓖麻油) /无水乙醇( 50∶ 50) 配制成的无色黏稠状溶液.
有研究显示增溶剂聚氧乙烯蓖麻油在体内可促使大量组织胺释放因而产生过敏反应; 还可溶解聚氯乙烯输液器中的二乙烯己基邻苯二甲酸盐导致严重的毒性反应[1].目前纳米胶束载药系统有众多研究[2],并已研制出不含有增溶剂的紫杉醇载药纳米胶束新剂型[3 -4].
在首度报道合成可生物降解的聚乙二醇-聚谷氨酸苄酯( polyethylene glycol- polybenzyl-L-glutamate,PEG-PBLG) 两亲型嵌段共聚物,并可作药物的纳米载药系统之后[5],其作为载药纳米胶束平台的研究取得较多成果[6 -9].在紫杉醇/PEG-PBLG 纳米胶束的研究基础上[10],制备紫杉醇/PEG-PBLG 纳米胶束冻干粉针剂[11].本研究合成表征 PEG-PBLG 测定其高分子嵌段共聚物的细胞毒性,评估紫杉醇/PEG-PBLG 冻干粉针剂对 2 种癌细胞的体外细胞毒性,并与临床所用的紫杉醇/聚氧乙烯蓖麻油注射剂进行比较.
1 材料与方法
1. 1 材料与仪
器紫杉醇/PEG-PBLG 冻干粉针剂,采用膜透析法制备紫杉醇载药纳米胶束溶液,加入 3%甘露醇冷冻干燥获得粉针剂( 紫杉醇含量 8. 13%) ; 紫杉醇,福建南方生物技术股份有限公司,批号 JP050901,纯度 99. 2%;紫杉醇注射剂( 6 mg/mL × 5 mL) ,北京四环医药科技股份有限公司; 透析袋( 截留 Mw3500 ~ 5000) ,上海绿鸟科技发展有限公司进口分装; RPMI1640 培养基、小牛血清、胰蛋白酶,美国 Gibco 公司; 25 cm2培养瓶、96孔培养板,美国 Corning 公司; 其他试剂均为分析纯;HeLa 人子宫黏膜上皮细胞、HO-8910 人卵巢癌细胞、A549 人肺小细胞腺癌细胞,中山大学实验动物中心提供.Mercury-Plus 300 核磁共振波谱仪,美国 VAR-IAN 公司; 1 - 4 / LSC 冷冻干燥机,德国 CHRIST AL-PHA; CKX41 倒置相差显微镜,日本 Olympus; Bio-RADMode 1450 酶联免疫检测仪,美国 Microplate Read-er; CO2培养箱,英国 Galaxy R.
1. 2 PEG-PBLG 嵌段共聚物的合成及核磁表征
采用文献[12]方法合成 PEG-PBLG: 谷氨酸在 60%硫酸催化下先进行 γ-苄酯化、再与二( 三氯甲基) 碳酸酯作用生成谷氨酸苄酯羧酸酐( A) ,最后在端氨基聚乙二醇单甲醚( I) 的引发阴离子聚合反应.在不同 ( A/I) 的摩尔比下聚合反应,可生成不同分子量的 PEG-PBLG 嵌段共聚物.利用1HNMR 获得 PEG-PBLG 氢核磁谱图,并根据共聚物的嵌段比,计算出 PEG-PBLG 的分子量.
1. 3 观察 PEG-PBLG 嵌段共聚物的体外细胞毒性
将处于指数生长期的 HeLa 细胞消化,用 RP-MI1640 培养液调整细胞密度 6 × 104个/mL,实验前一天接种于24 孔板中,每孔1 mL.5% CO2、37 ℃培养箱培养 24 h,吸取各孔内培养液弃去,加入各实验组的培养液 1 mL.苯酚阳性对照组,用 RPMI1640 培养液调整苯酚浓度为 6. 4 μL/mL; 阴性对照组用新鲜 RPMI1640 培养液; 溶剂对照组加入增溶剂聚氧乙烯化蓖麻油的 RP-MI1640 分散液,浓度为 2 μL / mL; 实验组加入 PEG-PBLG 胶束冻干样品 RPMI1640 培养液分散溶液,胶束浓度为 200 μg/mL.各组设平行样品 4 个.置细胞恒温培养箱中培养 24 h,通过倒置显微镜观察细胞形态和生长情况.
1. 4 冻干粉针剂对癌细胞的细胞毒性试验
分别将处于指数生长期的 HO-8910、A549 细胞消化,用 RPMI1640 培养液调整细胞密度 1. 5 ×104个/mL,实验前一天接种于 96 孔板中,每孔 200 μL.阴性对照组用新鲜 RPMI1640 培养液交换; 阳性对照组加入用 RP-MI1640 培养液稀释市售紫杉醇 / 聚氧乙烯化蓖麻油注射剂,紫杉醇浓度分别为 50、20、10、5 μL/mL 溶液( 内含增溶剂聚氧乙烯化蓖麻油分别为 10、4、2、1 μL/mL) ;增溶剂对照组加入用 RPMI1640 培养液稀释聚氧乙烯化蓖麻油,浓度分别为 10、4、2、1 μL/mL 溶液; 冻干粉治疗组加入用 RPMI1640 培养液分散紫杉醇/PEG-PBLG 冻干粉针剂样品,配制成紫杉醇含量为 50、20、10、5 μg / mL 溶液,每个试样复种 4 孔.用 PBS 漂洗细胞 2 次后,将上述各组的培养液覆盖在培养细胞上,5% CO2、37 ℃培养箱培养 24 h 后,于每孔加入 5 mg/mL 的 MTT 20 μL,继续培养 4 h,吸尽上液,用 PBS 清洗 2 遍后,每孔加入 DMSO 溶液 150μL,室温放置 15 ~20 min,振摇 15 min 均匀染色,用酶标仪测定 570 nm 处吸光度值( OD) .根据( 1) 式计算细胞相对增殖百分率( relative growth rate,RGR) ,评定细胞毒性级别[13].RGR = ( 试样组 OD 值) / ( 阴性对照组 OD 值) × 100%( 1)
1. 5 统计学方法.
所有数据采用均数 ± 标准差( x珋 ± s) 表示,计量资料分析采用 t 检验,检验水准 α =0. 05,P <0. 05 具有统计学意义.
2 结果.
2. 1 PEG-PBLG 嵌段共聚物的合成.
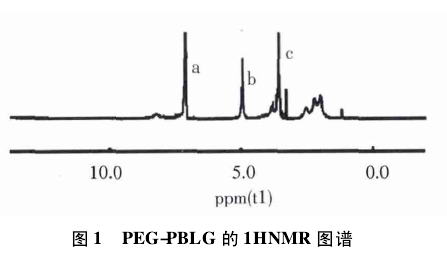
PEG-PBLG 的1H-NMR 如图 1 所示: a 峰,δ7. 25( 苯环 5H) ; b 峰,δ5. 04( 苄基 2H) ; c 峰,δ3. 66( 乙氧基峰4H) ,以上氢核磁谱图证实了 PEG-PBLG 共聚物的合成形成.
1HNMR 可测定共聚物的嵌段比,由 PEG 嵌段的单位乙氧基质子峰面积( c 峰,δ3. 66) 和 PBLG 嵌段的单位苄基质子峰面积比( b 峰,δ5. 04) 获得,由于 PEG分子量已知,因此可计算出 PEG-PBLG 的分子量.本实验采用文献[12]
方法合成 PEG-PBLG,经测定其分子量 Mw =1. 86 ×104.
2. 2 PEG-PBLG 共聚物对 HeLa 细胞形态的影响000.
HeLa 细胞培养 24 h 后在倒置显微镜下观察: PEG-PBLG 组和阴性组,见图 2( a) 、2( c) ,细胞成长梭形或多角形,折光性强,细胞排列密集,连接成片,可见圆形分裂细胞,其周围有明亮的晕,表明细胞生长旺盛; 而溶剂组,见图2( b) ,细胞生长状态不好,没有连接成片而且部分细胞死亡破裂,表现出明显的细胞毒性; 阳性组( 苯酚) ,见图2( d) ,细胞大量死亡,呈重度细胞毒性.

通过观察可得: 临床所用紫杉醇注射剂中增溶剂在较低浓度 2 μL/mL 下就具有较强的细胞毒性,而在PEG-PBLG 在 200 μg / mL 较高浓度下,HeLa 细胞生长情况良好.说明嵌段共聚物 PEG-PBLG 作为高分子材料,对 Hela 细胞毒性较低,安全性较好.
2. 3 冻干粉针剂对癌细胞的细胞毒性实验.
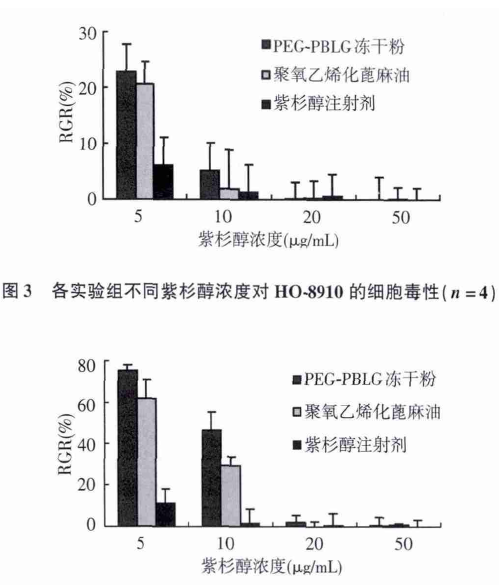
从图 3、图 4 可见,当紫杉醇浓度≥20 μg/mL 时,紫杉醇注射剂的阳性对照组、紫杉醇/PEG-PBLG 的冻干粉治疗组在细胞毒性评分均为 4,表现明显细胞毒性; 而紫杉醇浓度≤10 μg/mL,冻干粉治疗组的体外细胞毒性要远低于紫杉醇注射剂组( P <0. 01) ; 在含有 1μL/mL 的聚氧乙烯化蓖麻油时,增溶剂组毒性评分为3,因此增溶剂也具有较强的细胞毒性; 临床所用紫杉醇注射液采用聚氧乙烯化蓖麻油作为难溶药物紫杉醇的增溶剂,因而由紫杉醇、增溶剂共同构成该制剂的细胞毒性.
3 讨论
载药纳米胶束作为一种新型药物制剂技术,有缓控释药物,靶向长效,降低毒副作用,提高疗效等诸多优点,具有传统普通制剂无法比拟的剂型优势[2].但组成纳米胶束的高分子材料用在人体的安全性,则是需要特别关注的研究问题.我国于 1997 年制定了医疗器械生物学评价标准 GB/T1688. 1,生物材料的相容性及其临床使用的安全性问题越来越受到重视.
目前国内外有多种评价细胞毒性的方法,MTT 法是 1983 年被首次报道使用的一种快速评价细胞增殖和细胞毒性的比色分析法.在测定高分子材料的细胞毒性应用较多的细胞是 1953 年从人类子宫肿瘤中分离出的子宫黏膜上细胞( HeLa 细胞) ,在 1982 年被美国质量标准协会推荐为细胞毒性试验中的标准细胞[14].PEG-PBLG 具有优良的血液相容性[15 -16]和生物降解性[17],其亲水段为 PEG 已被美国 FDA 批准在人体内使用,不产生毒副作用,无免疫原性[18]; 其疏水段为均聚肽 PBLG,在体内可发生降解成为蛋白质的组分谷氨酸,无蓄积和毒副作用.在本研究中高分子材料 PEG-PBLG 在 200 μg/mL 较高浓度时仍未表现出对 HeLa 的细胞毒性,这充分证明该高分子聚合物的安全性良好.
在紫杉醇/PEG-PBLG 冻干粉针剂对 2 种人癌细胞的细胞毒性实验中: 当紫杉醇浓度为≥20 μg/mL 时,阳性对照组、冻干粉治疗组均表明具有很强的细胞毒性.这有可能是因为 2 组溶液中游离紫杉醇量已达到饱和浓度,饱和药物浓度对癌细胞抑制杀灭效果是一样; 而低浓度情况下( ≤10 μg/mL) ,冻干粉治疗组对 2种癌细胞的毒性均明显低于相同药物浓度的临床所用紫杉醇注射剂( P < 0. 01) ,是因为紫杉醇/PEG-PBLG载药胶束包埋药物仅释放部分紫杉醇,并且无增溶剂的细胞毒性,因而显著地降低了制剂的细胞毒性.通过本实验研究可以明确: 紫杉醇/PEG-PBLG 载药纳米胶束可显著降低紫杉醇制剂在体外的细胞毒性后,从而有可能减少紫杉醇制剂的毒副作用,具有较好的临床应用价值与前景.但在纳米胶束降低抗肿瘤药物的细胞毒性后,能否保持对肿瘤组织的治疗效果,有待药效学动物实验的进一步验证.
参考文献:
[1]Gelderblom H,Verweij J,Nooter K,et al. Cremophor EL:the drawbacks and advantages of vehicle selection for drugformulation [J]. Eur J Cancer,2001,37: 1590 - 1598.
[2]R sler A,Vandermeulen GW,Klok HA. Advanced drug de-livery devices via self-assembly of amphiphilic block copoly-mers[J]. Adv Drug Deliver Rev,2012,64: 270 - 279.
[3]Hu QY,Gu GZ,Liu ZY,et al. F3 peptide-functionalizedPEG-PLA nanoparticles co-administrated with tLyp-1 peptidefor anti-glioma drug delivery [J]. Biomaterials,2013,34:1135 - 1145.
[4]Li S,Su ZG,Sun MJ,et al. An arginine derivative con-tained nanostructure lipid carriers with pH-sensitive mem-branolytic capability for lysosomolytic anti-cancer drug deliv-ery[J]. Int J Pharm,2012,436: 248 - 257.
[5]冯敏,吴伟荣,潘仕荣. 萘普生核 - 壳型共聚物纳米胶束的制备及特性[J]. 中国药学杂志,2002,37( 7) : 509 -512.
[6]王安训,李苏,潘仕荣,等. 羟基喜树碱纳米微球的制备及体内外释药特性[J]. 中国肿瘤临床,2006,23( 1) :12 -15.
[7]冯敏,潘仕荣,张静夏,等. 两性霉素 B/聚乙二醇 - 聚谷氨酸苄酯纳米粒的体外细胞摄取研究[J]. 中国药科大学学报,2005,36( 4) : 321 -325.
[8]冯敏,潘仕荣,张静夏,等. 两性霉素 B 长循环纳米粒的研究[J]. 中国药学杂志,2005,40( 15) : 1156 -1159.
[9]李苏,王安训,潘仕荣,等. PEG-PBLG 纳米胶束体外释药及药动学和分布的研究[J]. 中国药学杂志,2005,41( 9) : 699 -702.
[10]余巧,潘仕荣,杜卓. 紫杉醇自组装核壳型纳米胶束的制备与性能[J]. 药学学报,2008,43( 4) : 408 -414.
[11]杜卓,潘仕荣,余巧,等. 紫杉醇纳米胶束冻干粉针剂的制备工艺研究[J]. 中药新药与临床药理,2013,24( 5) : 510 -514.
[12]张国林,吴秋华,潘彤,等. AB 型两亲聚 L-谷氨酸-苄酯-聚乙二醇嵌段共聚物的合成与表征[J]. 高分子学报,2004,( 2) : 223 -227.
[13]邵英,路来金,荣莉,等. 聚 L-乳酸/聚 L-乳酸接枝的羟基磷灰石复合材料的生物相容性[J]. 吉林大学学报( 医学版) ,2007,33( 1) : 57 -60.
[14]Richardson RR Jr,Miller JA,Reichera WM. Polyimide asbiomaterials Preliminary biocompatibility testing [J]. Bio-materials,1993,14( 9) : 627.
[15]王琴梅,滕伟,潘仕荣,等. 聚谷氨酸苄酯/聚乙二醇嵌段共聚物膜的血液相容性研究 [J]. 生物医学工程学杂志,2005,22: 66 -69.
[16]陈俊江,孙月丽,肖芷洁,等. 西地那非和伐地那非逆转MRP7 介导的紫杉醇耐药[J]. 广东药学院学报,2012,28( 2) : 181 - 183.
[17]王琴梅,滕伟,潘仕荣,等. 聚谷氨酸苄酯/聚乙二醇/聚谷氨酸苄酯嵌段共聚物膜的生物降解性[J]. 北京生物医学工程,2004,23: 40 -42.
[18] Lavasanifar A,Samuel J,Kwon GS. Poly ( ethyleneox-ide) -block-poly ( L-amino acid) micelles for drug delivery[J]. Adv Drug Deliv Rev,2002,54: 169 -190.