
黄酮类化合物广泛分布于自然界,许多蔬菜、水果和药用植物中都含有此类成分,如黄芩、槐花、沙棘、甘草等中药中就含有多种黄酮类成分,有些是其主要活性成分.黄酮类化合物不仅分布广泛而且具有多样的生物活性,其中抗肿瘤的活性最为引人注目,抗菌活性已经得到了医学界的广泛认可.
文献中报道了许多具有较好抗菌活性的天然黄酮类化合物.然而很多黄酮类化合物溶解性能较差、生物利用度不高、生物活性不够强,这限制了其临床应用和新药开发.如果以黄酮类化合物作为先导,对其进行结构修饰,研究结构与其活性之间的关系.
通过活性优化就有可能发现活性更好、具有药用开发前景的化合物.因此,设计和合成结构多样性黄酮类化合物库就显得非常必要.
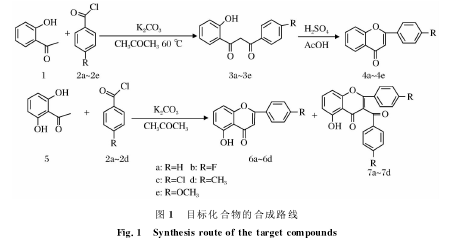
我们以2-羟基苯乙酮和2,6-二羟基苯乙酮为原料,在对改进的Baker-Venkataraman重排反应进行系统研究的基础上,得到了系列黄酮类和它的中间体-丙二酮类化合物,合成路线见图1.
因此,有必要对所合成的黄酮类化合物及中间体进行抗肿瘤筛选,以期发现高效、低毒、选择性好的化合物,并分析其抗肿瘤活性和结构之间的关系,为进一步化学修饰和作用机制研究奠定基础.
1、实验部分
1.1仪器与试剂
实验的主要仪器有R206D旋转蒸发仪,XT5A型显微熔点测定仪(温度计未校订),RET控制型加热磁力搅拌器,美国HPI100质谱联用仪,美国VARIAN INOVA(400MHZ)超导核磁共振仪以及APEX-2高分辨质谱仪.
人宫颈癌细胞株(Hela)引自北京师范大学生命科学院.所有试剂均为分析纯,其中丙酮经干燥处理.
1.2合成(1)1-(2-羟基苯基)-3-苯基-1,3-丙二酮及其衍生物的合成在反应瓶中加入2-羟基苯乙酮162mol,无 水K2CO31.62 mmol及干燥丙酮60mL,60℃油浴回流搅拌下滴加苯甲酰氯及其衍生物486mmol.滴毕,加热回流反应24h,TLC检测反应完毕.将反应液冷却至室温,过滤,用少量丙酮淋洗滤饼.
然后,加入10%乙酸(100mL)中,充分搅拌,待停止冒气泡后过滤.滤饼用水洗涤至中性,真空干燥后用丙酮重结晶得黄色针状晶体(3a~3e).1-(2-羟基苯基)-3-苯基-1,3-丙二酮(3a):淡黄色针状结晶,收率80.3%,熔点:117 ~121 ℃;1H NMR(400MHz,CDCl3)δ:7.94(d,J=9.8Hz,2H,2′,6′-H),7.79(dd,J=9.4,4.7Hz,1H,6-H),7.18-7.56(m,4H,3′,4′,5′-H,7-H),7.01(dd,J=12.7,6.3 Hz,1H,3-H),6.95(m,1H,5-H),6.85(s,1H).1-(2-羟基苯基)(4′-氟苯基)-1,3-丙二酮(3b):淡黄色针状结晶,收率71.8%,熔点:135~136℃;1H NMR(400MHz,CDCl3)δ7.96(dd,J=8.7,5.4 Hz,2H,2′,6′-H),7.78(d,J=8.0 Hz,1H,6-H),7.54-7.42(m,1H,4-H),7.18(t,J=8.5Hz,2H,3′,4′-H),7.01(d,J=8.4 Hz,1H,3-H),6.93(t,J=7.6Hz,1H,5-H),6.79(s,1H).
1-(2-羟基苯基)-3-(4′-氯苯基)-1,3-丙 二 酮(3c):淡黄色针状结晶,收率85.7%,熔点:125 ~127℃;1H NMR(400 MHz,CDCl3)δ7.89(d,J=8.5Hz,2H,2′,6′-H),7.78(d,J=8.0 Hz,1H,6-H),7.48(t,J=8.1Hz,3H,3′,4′,4-H),7.02(d,J=8.4 Hz,1H,3-H),6.94(t,J=7.6 Hz,1H,5-H),6.82(s,1H).
1-(2-羟基苯基)-3-(4′-甲基苯基)-1,3-丙二酮(3d):淡黄色针状结晶,收率73.5%,熔点:111 ~114℃;1H NMR(400 MHz,CDCl3)δ7.85(d,J=8.2 Hz,2H,2′,6′-H),7.81-7.74(m,1H,6-H),7.51-7.42(m,1H,5-H),7.29(t,J=7.3Hz,2H,3′,4′-H),7.00(d,J=8.2Hz,1H,3-H),6.92(t,J=7.6Hz,1H,4-H),6.82(s,1H),2.44(s,1H,-CH3).
1-(2-羟基苯基)-3-(4′-甲氧基苯基)-1,3-丙二酮(3e):淡黄色针状结晶,收率70.9%,熔点:107~111℃;1H NMR(400 MHz,CDCl3)δ7.93(d,J=8.7Hz,2H,2′,6′-H),7.78(t,J=6.5 Hz,1H,6-H),7.46(dd,J=15.6,8.1Hz,1H,5-H),7.03-6.88(m,4H,3′,4′,3,4-H),6.78(s,1H),3.89(3H,-OCH3).
(2)黄酮母核及其衍生物的合成在装有回流冷凝器、磁子、温度计的三颈瓶中加入1-(2-羟基苯基)-3-苯基-1,3-丙二酮及其衍生物50mmol,然后加入20mL冰醋酸和0.16mL浓硫酸,控制反应温度为95~100 ℃加热回流反应3h.TLC检测反应完毕,冷却至室温.
减压蒸馏大约15mL的冰醋酸,将剩余物倒入100mL冷水中.有白色乳状沉淀生成,静置,使沉淀析出完全,过滤,滤饼用水洗涤至中性.真空干燥后用无水乙醇重结晶得到白色针状晶体(4a~4e).
黄酮母核(4a):白色针状结晶,收率75.3%,熔点:96~99 ℃;1H NMR(400 MHz,CDCl3)δ8.25(d,J=8.0Hz,1H,5-H),8.02-7.89(m,2H,2H,2′,6′-H),7.73(t,J=7.7Hz,1H,7-H),7.65-7.49(m,4H,3′,4′,5′,8-H),7.45(t,J=7.5Hz,1H,6-H),6.90(s,1H,3-H);ESI-MS(positive):calcd forC15H10O2([M+Na]+)245.24;found 245.08(M+Na)+.
4′-氟黄酮(4b):灰白色针状结晶,收率60.1%,熔点:152~155 ℃;1H NMR(400 MHz,CDCl3)δ8.24(d,J=7.8Hz,1H,5-H),8.03-7.89(m,2H,2′,6′-H),7.73(t,J=7.7Hz,1H,7-H),7.62-7.52(m,1H,8-H),7.45(t,J=7.5Hz,1H,6-H),7.23(d,J=8.3 Hz,2H,3′,4′-H),6.83(s,1H,3-H);ESI-MS(positive):calcd for C15H9O2F([M+H]+)241.18;found 241.00(M+H)+.
4′-氯黄酮(4c):白色针状结晶,收率57.8%,熔点:191~194 ℃;1H NMR(400 MHz,CDCl3)δ8.24(d,J=7.9Hz,1H,5-H),7.89(d,J=8.5Hz,2H,2′,6′-H),7.73(t,J=7.8Hz,1H,7-H),7.58(d,J=8.4Hz,1H,8-H),7.52(d,J=8.5Hz,2H,3′,4′-H),7.45(t,J=7.5 Hz,1H,6-H),6.83(s,1H,3-H);ESI-MS(positive):
calcd for C15H9O2Cl([M+H]+)257.63;found 257.44(M+H)+.
4′-甲基黄酮(4d):白色针状结晶,收率51.6%,熔点:115~117 ℃;1H NMR(400 MHz,CDCl3)δ8.24(d,J=7.9Hz,1H,5-H),7.85(d,J=8.0Hz,2H,2′,6′-H),7.72(t,J=7.7Hz,1H,7-H),7.59(d,J=8.4Hz,1H,8-H),7.44(t,J=7.5Hz,1H,6-H),7.34(d,J=8.0Hz,2H,3′,4′-H),6.87(s,1H,3-H),2.45(s,3H,CH3);ESI-MS(positive):
calcd for C16H12O2([M+ H]+)237.22;found237.00.
4′-甲氧基黄酮 (4e):白色针状结晶,收率61.6%,熔点:161~163 ℃;1H NMR(400 MHz,CDCl3)δ8.24(dd,J=7.9,1.5 Hz,1H,5-H),7.98-7.86(m,2H,2′,6′-H),7.70(ddd,J=8.6,7.2,1.7 Hz,1H,7-H),7.57(d,J=8.3 Hz,1H,8-H),7.43(dd,J=11.1,4.0 Hz,1H,6-H),7.04(d,J=8.9 Hz,2H,3′,4′-H),6.79(s,1H,3-H),3.90(s,3H,OCH3);ESI-MS(positive):calcd forC16H12O3([M+ H]+)253.28;found 253.08(M+H)+.
(3)5-羟基黄酮及其衍生物的合成在反应瓶中加入2,6-二羟基苯乙酮0.01mmol,无水K2CO30.08mmol及干燥丙酮60mL,60℃油浴回流搅拌下滴加苯甲酰氯及其衍生物2a~2d0.03mmol.
滴毕,反应24h,TLC检测反应完毕.
将反应液冷却至室温,过滤,用少量丙酮洗涤滤饼.
然后转入10%乙酸(100mL)中,充分搅拌,待停止冒气泡后,过滤,滤饼用水洗涤至中性.
真空干燥后用硅胶柱色谱分离得到5-羟基黄酮及其衍生物6a~6d和3-苯甲酰基-5-羟基黄酮及其衍生物7a~7d,6a和7a的展开剂为石油醚∶乙酸乙酯=12∶1;6b和7b的展开剂为石油醚∶乙酸乙酯=8∶1;6c和7c的展开剂为石油醚∶乙酸乙酯=10∶1;7d的展开剂为石油醚∶乙酸乙酯=15∶
1.产物的表征数据如下:5-羟基黄酮(6a):淡黄色结晶,收率41.6%,熔点:160~162 ℃;1H NMR(400 MHz,CDCl3)δ7.93(dd,J=8.0,1.6Hz,2H,2′,6′-H),7.63-7.47(m,4H,3′,4′,5′,7-H),7.02(d,J=8.4 Hz,1H,8-H),6.83(d,J=8.2Hz,1H,6-H),6.75(s,1H,3-H);ESI-MS(positive):calcd for C1 5H1 0O3([M+H]+)239.24;found 239.05(M+H)+.
3-苯甲酰基-5-羟基黄酮(7a):淡黄色棒状结晶,收率45.7%,熔点:178~180 ℃;1H NMR(400MHz,CDCl3)δ12.17(s,1H,OH),7.93(d,J=7.9Hz,2H,2H,2′,6′-H),7.59(m,4H),7.48-7.32(m,5H),7.02(t,J=10.6 Hz,1H,8-H),6.86(t,J=8.2Hz,1H,6-H);ESI-MS(positive):calcd forC22H1 4O4([M+ H]+)343.34;found 343.15(M+H)+.
4′-氟-5-羟基黄酮 (6b):淡黄色结晶,收率39.0%,熔点:162~163 ℃;1H NMR(400 MHz,CDCl3)δ12.54(s,1H,OH),7.93(dd,J=8.0,5.4Hz,2H,2′,6′-H),7.55(q,J=8.5 Hz,1H,7-H),7.23(d,J=8.3Hz,2H,3′,4′-H),7.00(d,J=8.4Hz,1H,8-H),6.83(d,J=8.2 Hz,1H,6-H),6.69(s,1H,3-H);ESI-MS(positive):calcdfor C1 5H9O3F([M+H]+)257.23;found 257.04(M+H)+.
3-(4′′-氟-苯甲酰基)-4′-氟-5-羟基黄酮(7b):淡黄色结晶,收率44.9%,熔点:133~136 ℃,该化合物为首次报道;1H NMR(400MHz,CDCl3)δ12.09(s,1H,OH),8.00-7.90(m,2H,2′,6′-H),7.64(m,3H,Ar-H),7.13-7.01(m,5H,Ar-H),6.88(d,J=8.3Hz,1H,6-H).
IR(KBr),v/cm-1:2 926.76,1 663.62,1 693.04,1 468.73,1 415.99,1 224.22,1 159.79,814.06,729.30,604.61;HRMS(ESI,positive):calcd forC22H12O4F2([M+ H]+)379.077 6;found379.076 8.
4′-氯-5-羟基黄酮(6c):淡黄色针状结晶,收率49.7%,熔点:192~194 ℃;1H NMR(400 MHz,CDCl3)δ12.51(s,1H),7.87(d,J=8.6 Hz,2H,2′,6′-H),7.62-7.47(m,3H,3′,5′,7-H),7.01(d,J=8.4Hz,1H,8-H),6.84(d,J=8.3Hz,1H,6-H),6.72(s,1H,3-H);ESI-MS(positive):calcd forC1 5H9O3Cl([M+ H]+)273.69;found 273.49(M+H)+.
3-(4′′-氯-苯甲酰基)-4′-氯-5-羟基黄酮(7c):淡黄色无定形粉末,收率30.1%,该化合物熔点和1H NMR数据没有文献报道,1H NMR(400 MHz,CDCl3)δ12.05(s,1H),7.86(d,J=8.2 Hz,2H,2′,6′-H),7.64(t,J=8.4Hz,1H,7-H),7.57(d,J=8.2Hz,2H),7.43(d,J=8.3 Hz,2H),7.37(d,J=8.3 Hz,2H),7.03(d,J=8.4 Hz,1H,8-H),6.89(d,J=8.4 Hz,1H,6-H));ESI-MS(positive):calcd for C22H12O4Cl2([M+ H]+)412.23;found 412.05.
3-(4′′-甲基-苯甲酰基)-4′-甲 基-5-羟基黄酮(7d):淡黄色针状结晶,收率76.4 %,熔点:
230~234℃,该化合物熔点和1H NMR数据没有文献报道;1H NMR(400 MHz,CDCl3)δ12.23(s,1H),7.84(d,J=8.1Hz,2H,2′,6′-H),7.65-7.52(m,3H,Ar-H),7.24(d,J=8.0Hz,2H,Ar-H),7.17(d,J=8.1Hz,2H,Ar-H),7.02(d,J=8.4Hz,1H,8-H),6.85(d,J=8.3Hz,1H,6-H),2.39(s,3H,-CH3),2.34(s,3H,-CH3);ESI-MS(positive):calcd for C2 4H1 8O4([M+ H]+)372.40;found372.25.
1.3体外抑制肿瘤细胞增殖活性
按照文献[8]方法,取对数生长期的Hela细胞,细胞密度为5×104个/mL,接种于96孔培养板中.
每孔RPMI-1640培养基200μL,置于37 ℃、5%的CO2及90%湿度条件下无血清孵育48h.
细胞完全贴壁后,更换新鲜培养液.
设空白对照组(普通培养基)、实验组 (10μg/mL、20μg/mL、50μg/mL、100μg/mL药物浓度梯度),每个处理组设3个平行孔,加在96孔板内.
每孔加20μL,加药完毕后放回孵箱继续培养48h后,吸弃上清液,每孔加入新鲜配制的MTT溶液(5mg/mL)20μL,在37 ℃恒温培养箱中继续培养4h.
终止培养,弃除孔内上清液,每孔加 入DMSO 200μL,平板摇床振荡30 min(60次/min)使甲臜沉淀充分溶解.
用酶联免疫检测仪在490nm波长处测定各孔的吸光度(A值),重复测试3次,取平均值为最终结果.
经培养的癌细胞通过孔中药物抑制后,按细胞抑制率=(对照组A值-实验组A值/对照组A值)×100%计算细胞抑制率.
抑制率为正值表示药物对肿瘤细胞的生长具有抑制作用,负值表示药物对肿瘤细胞的生长具有促进作用.
通过回归计算,求出半数抑制浓度,即细胞增殖抑制率为50%时的药物浓度(IC50值).
目标化合物对HeLa细胞的抗肿瘤增殖活性见表1.
从表1可 知,-丙二酮类化合物在浓度<100μg/mL时,对HeLa细胞不但没有抑制活性,相反都表现出促进增殖作用.
而关环后生成的黄酮类化合物在低浓度下(10μg/mL)对HeLa细胞没有抑制活性,但在较高浓度时表现出一定的抑制作用.
这种作用成剂量依赖性关系,这也从侧面证明黄酮类化合物潜在的抗肿瘤活性.
实验结果发现,目标化合物7b对HeLa细胞表现出较强的抗增殖活性,IC50值为95.5μM,值得进一步研究.
从表1也可以看出,在黄酮母核、5-羟基黄酮的4′-位分别引入F、Cl、OCH3、CH3所形成的化合物中,4′-氟黄酮、4′-氟-5-羟基黄酮对HeLa细胞的抑制作用明显强于其他三种基团取代的化合物.
而含F化合物7b具有较强的抗肿瘤活性,这可能是由于氟原子的强吸电子作用使化合物的极性增大,从而使化合物的溶解性能增强所致.
因此在后续的黄酮类化合物结构修饰时,可以考虑在其4′-位引入氟原子来增强它们的抗肿瘤活性.
2、结论
近年来,我们一直致力于黄酮类化合物的结构改造和生物活性研究,该研究通过用不同的原料对改进的Baker-Venkataraman重排反应进行了系统研究.
结果发现,当2-羟基苯乙酮的6-位没有羟基时,例如2-羟基苯乙酮、2,4-二羟基苯乙酮、2,5-二羟基苯乙酮、3-甲基-2,5-二羟基苯乙酮等和苯甲酰氯及其衍生物在碳酸钾的丙酮溶液中发生Baker-Venkataraman重排反应,其酯化、重排一步完成首先得到-丙二酮类化合物,将-丙二酮关环就可得到黄酮类化合物;当2-羟基苯乙酮的6-位有羟基时,例如2,6-二羟基苯乙酮及2,4,6-三羟基苯乙酮,它们与苯甲酰氯及其衍生物在碳酸钾的丙酮溶液中也可发生Baker-Venkataraman重排反应,并且酯化、重排、关环一步完成,直接得到5-羟基黄酮、3-苯甲酰基-5-羟基黄酮及其衍生物和3-苯甲酰基-5,7-二羟基黄酮等.

从目标化合物的体外抗肿瘤活性测试结果可以看出,在黄酮母核的4′-位引入F有利于增强黄酮类化合物的抗肿瘤活性,优选出的化合物7b具有潜在的抗肿瘤增殖活性,具有深入研究的价值.