
甾体母核是激素类药物的基本结构,也是一个很好的新药研发平台[1-3]。对甾体进行结构改造所得到的化合物大多具有很好的生理活性[4,5]。Khan S N等[6]合成了一系列的 7-氟代-3-胺基甾体,结果表明合成的化合物对金黄色葡萄球菌、绿脓假单胞菌、酿脓链球菌和大肠杆菌有高效的抑制作用。Jegham H等人[7]合成的一种新胺基甾体(RM)表现出广谱抗肿瘤的作用,对 9 种癌细胞系有抑制作用,RM 能阻断HL-60 细胞周期的 G0/G1 期。氨基甾体化合物能有效地抑制白血病细胞 K562、MEG-01、WEHI-3B 和HL-60 的增殖,促进细胞凋亡并诱导分化[8,9]。21-氨基甾体化合物具有良好的抗脂质过氧化作用,可治疗心脑血管系统和中枢神经系统疾病[10]。甾体内酰胺和硫代甾体内酰胺化合物可以抑制人宫颈癌(Hela)细胞的增殖,体外实验表明其抗增殖活性呈明显的剂量依赖关系,并且对肿瘤细胞的作用具有选择性[11]。现利用甾体酮肟[12]还原法得到了 20R-胺基甾体,并利用 2D NMR 技术对其进行结构解析和碳谱、氢谱数据归属,为其活性测定起到参考作用。
1 材料与方法
1.1 材料
妊娠烯醇酮、盐酸羟胺、镍铝合金粉、氢氧化钠、浓盐酸等,实验所用各种试剂均为分析纯。
1.2 主要仪器
RE52-99 旋转蒸发器(上海精密仪器仪表有限公司),TH-I 型薄层加热器(上海科哲生化科技有限公司),所有 NMR 实验在 Bruker AVANCE DPX-400超导核磁共振仪上进行,样品以 DMSO-d6为溶剂,TMS 为内标。
1.3 方法
将 1.10 g(3.48×10-3mol) 的妊娠烯醇酮(1)与0.99 g 的盐酸羟胺置于 50 mL 的圆底烧瓶中,用 95%乙醇完全溶解后,加入 2.25 mL 吡啶,室温下搅拌反应 3 h。反应完全后,向反应体系中加蒸馏水 25 mL,搅拌 10 min,析出白色固体。抽滤,真空干燥,得产物3β-羟基-孕甾-5-烯-20-酮肟(2)1.09 g。
将 2.0 g(6.04×10-3mol)的妊娠烯醇酮肟(2),置于 500 mL 的圆底烧瓶内,加 60 mL 的无水乙醇溶解,再加入 60 mL(2 mol·L-1)的氢氧化钠溶液和 3.4 g的镍铝合金粉,室温下搅拌反应 8 h。反应完全后,过滤,用 50 mL 无水乙醇洗涤,滤液用盐酸调节 pH 值至 6,二氯甲烷萃取三次,收集有机相。水相用氢氧化钠溶液调至强碱性,再用二氯甲烷萃取三次,合并有机相。无水硫酸钠干燥,过滤,减压浓缩至 10 mL,趁热再加入 100 mL 的二氯甲烷,白色固体析出,析出的产物再用甲醇重结晶。得到妊娠烯醇酮胺(3)0.59 g。
2 结果与讨论
3β-羟基-孕甾-5-烯-20R-胺的合成路线如图 1所示。
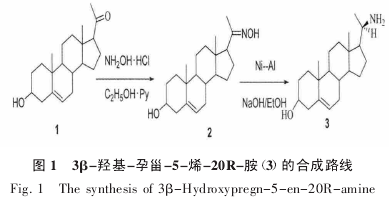
3β-羟基-孕甾-5-烯-20-酮肟(2):收率 95.0%;mp:221~223 ℃;1H NMR (DMSO-d6)δ(ppm):3.10(m,H-3),5.26(s,H-6),0.56(s,H-18),0.94(s,H-19),1.73(s,H-21),10.33(s,N-OH)。
3β-羟基-孕甾-5-烯-20R-胺(3):收率 30.8%;mp:207~209 ℃;1H NMR(DMSO-d6) δ:3.25(m,H-3),5.25(s,H-6),1.46(m,H-17),0.65(s,H-18),0.93(s,H-19),3.02(m,H-20),1.26(d,H-21)。
化合物的13C NMR 数据如表 1 所示。
2.1 反应过程讨论
合成妊娠烯醇酮胺的方法大体可分为两种:一是还原胺化法,二是将肟还原为胺。还原胺化法一般需要加压和氢气,常用在工业生产中,况且这种方法多用在较小的分子合成中,对于多环甾体化合物的合成较少使用[13],而将肟直接还原为胺,只需要提供氨基的胺源,在平常的实验条件下就可完成。根据我们实验室的条件,选择了第二种方法。
2.2 化合物 3 结构解析
化合物 3 与 2 相比,双键未变,可直接 δ 120.2、δ 141.2 归属为 C6 和 C5,根据 HSQC 谱(如图 3 所示),δ 5.25 直接归属为 H-6 的化学位移。
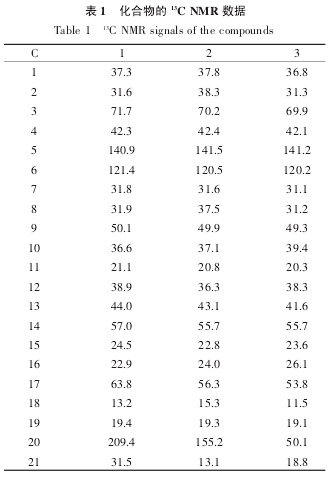
在1H NMR 谱图中,位于 δ 0.65 和 δ 0.93 处的峰型都是单峰,并且质子数是 3,所以判断这两处都是甲基峰。HMBC 谱(图 2)显示,δ 141.2 与 δ 0.93处的氢有交叉关联,说明 δ 0.93 处的氢为 H-19,则可将δ 0.65 归属为 H-18。根据 HSQC 谱,δ 11.5 和 δ 19.1 可分别归属为 C18 和 C19。
根据 HMBC 谱图,H-18 应与 C12、C13、C14 和C17 有相关偶合,质子 H-18(δ 0.65)与 δ 38.3、δ 41.6、δ 53.8 和 δ 55.7 有交叉峰,而 DEPT 谱(图 5)显示,δ 38.3 为仲碳,δ 53.8 和 δ 55.7 为叔碳,δ 41.6 为季碳,因此 δ 38.3 和 δ 41.6 可分别归属为 C12、C13。
HSQC 谱显示,δ 38.3 与 δ 1.88、δ 1.14 处的氢有相关偶合,而 C12 中的两个氢所处的化学环境不同,因此化学位移不同,所以 H-12 的两个化学位移分别是 δ 1.88 和 δ 1.14。
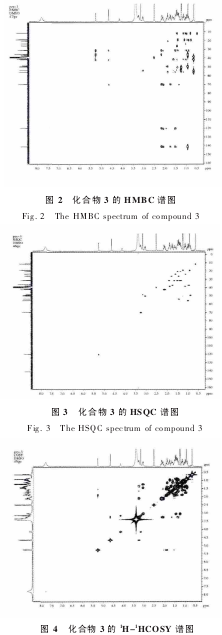
在 HMBC 谱中,H-19 应与 C1、C5、C9 和 C10 有相关偶合,质子 H-19(δ 0.93)与 δ 36.8、δ 39.4、δ 49.3 和 δ 141.2 有交叉峰,DEPT 谱显示,δ 36.8为仲碳,δ 49.3 为叔碳,δ 39.4 和 δ 141.2 为季碳,而δ 141.2 为 C6 的化学位移,则 δ 39.4 可直接归属为 C10,而 δ 36.8 和 δ 49.3 可分别直接归属为 C1 和C9。根据 HSQC 谱显示,δ 49.3 与 δ 0.91 处的氢有偶合,δ 0.91 可直接归属为 H-9,δ 36.8 与 δ 1.75、δ 0.97处的氢有偶合关系,所以 δ 1.75 和 δ 0.97 是 H2-1 的化学位移。
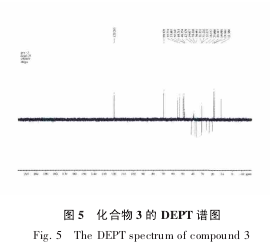
根据1H-1HCOSY 谱图(图 4),δ 5.25 处的 H-6与 δ 1.91、δ 1.51 处的氢有相关偶合,则 H2-7 的化学位移为 δ 1.91 和 δ 1.51,在 HSQC 谱中,δ 31.1 处的碳与 δ 1.51 和 δ 1.91 有偶合,而 DEPT 谱中显示,δ 31.1 处的碳为仲碳,所以 C7 的化学位移为 δ 31.1。
H -6 与 H -8 有远程偶合,结合1H -1HCOSY 谱图,H-8 的化学位移为 δ 1.34,HSQC 谱显示,C8 的化学位移是 δ 31.2,在 DEPT 谱中,此处的碳为叔碳,进一步证实了 C8。与化合物 2 相比,H-21 的单峰消失了,说明 C20 位的肟基被还原,C20 位出现了氢,肟基变成了胺基。C14 与 C17 所处的化学环境不同,C17 受到吸电子基团胺基的影响,化学位移向高场移动,因此 C17 的化学位移是 δ 53.8,C14 的化学位移是 δ 55.7,结合 HSQC 谱图,H-17 的化学位移是δ 1.46,H-14 的化学位移是 δ 1.02。
HMBC 谱显示,δ 53.8 与 δ 1.26 处的氢有相关偶合,且此处的峰裂分为二重峰,说明 H-21 的化学位移是 δ 1.26,结合 HSQC 谱,C21 的化学位移是 δ 18.8,DEPT 谱显示,此处的碳为伯碳,进一步证实了 C21。
HMBC 谱显示,δ 53.8 与 δ 3.02、δ 0.65 处的氢都有相关偶合,且已知 δ 0.65 为 H-18 的化学位移,而 δ 3.02处氢的化学位移值较大,是受到了吸电子基团胺基的影响,因此 δ 3.02 为 H-20 的化学位移,结合HSQC 谱,可知 C20 的化学位移为 δ 50.1,而 DEPT谱进一步证实,此处的碳为叔碳。
由于 C3 位上的羟基未变,所以 C3 的化学位移化合物 2 相比没有太大的改变,结合 DEPT 谱和HSQC 谱,δ 69.9 为 C3 的化学位移,HSQC 谱显示,H-3 的化学位移是 δ 3.25。根据 HMBC 谱,δ 69.9 与δ 2.16、δ 2.08 处的氢有相关偶合,且此处的氢与 C5 也有相关偶合,说明 H2-4 的化学位移为 δ 2.16 和 δ 2.08,结合 HSQC 谱,可知 C4 的化学位移为 δ 42.1,DEPT谱显示此处的碳为仲碳,进一步证实了 C4。
H-3 与 H-2 应有偶合,而1H-1HCOSY 谱显示,δ 3.25 与 δ 1.65、δ 1.38 处的氢有相关偶合,则 H2-2的化学位移为 δ 1.65 和 δ 1.38,HSQC 谱显示,δ 31.3与 δ 1.65、δ 1.38 相偶合,则 C2 的化学位移为 δ 31.3,DEPT 谱显示,此处碳的类型为仲碳,进一步证实了C2。H-14 应与 H-15 直接偶合,而1H-1HCOSY 谱显示,δ 1.02 与 δ 1.61、δ 1.11 处的氢有相关偶合,则H2-15 的化学位移为 δ 1.61、δ 1.11,结合 HSQC 谱和DEPT 谱,可知 C15 的化学位移为 δ 23.6。DEPT 谱显示,δ 26.1 处的碳为仲碳,HSQC 谱显示,δ 26.1 处的碳与 δ 1.45、δ 1.80 处的氢有偶合,则推断 C16 的化学位移为 δ 26.1,而 δ 1.45 和 δ 1.80 为 H2-16 的化学位移。
HMBC 谱显示,δ 1.88 处的氢(H-12)与 δ 20.3 处的碳有偶合,1H-1HCOSY 谱显示,δ 1.88 处的氢(H-12)与 δ 1.49 处的氢有偶合,而 DEPT 谱显示 δ 20.3 处的碳是仲碳,即 C11 的化学位移是 δ 20.3,HSQC 谱显示,δ 1.49 和 δ 1.37 是 H2-11 的化学位移。根据 HMBC 谱,δ 4.65 处的氢与 δ 69.9、δ 42.1 和 δ 31.3 处的碳有偶合,即与 C3、C4 和 C2 有偶合,所以 δ 4.65 为 C3 位羟基上的氢。
1H NMR 谱图显示,δ 7.84 处的氢为单峰,HSQC谱显示,此处的氢没有与碳对应的相关峰,因此推测δ 7.84 是胺基氢的化学位移。20R 和 20S 的区别在于H-20 和 H-21 的化学位移,由于空间距离的差异,20R 型中的氮原子与 H-20 和 H-21 中的氢距离较近(与 20S 型相比),H-20 和 H-21 受到胺基的吸电子作用较大,化学位移值偏大,20R 中的 H-20 化学位移是 δ 3.02,H-21 的化学位移是 δ 1.26,而20S 中的 H-20 化学位移是 δ 2.64,H-21 的化学位移是 δ 0.90。
3 结论
利用酮肟还原法得到胺基甾体,采用重结晶的方法对产物进行纯化。通过1H NMR、13C NMR 和 2DNMR 技术对其结构进行解析,并详细归属了碳谱和氢谱数据,为其他的胺基甾体的合成、结构解析提供了参考。
参考文献:
[1] Maltais R,Tremblay M R,Ciobanu L C,et al. Steroids andcombinatorialchemistry[J].JCombChem,2004,6:443-456.
[2] Poirier D,Maltais R. Solid-phase organic synthesis(SPOS)ofmodulators of estrogenic and androgenic action[J]. Mini-RevMed Chem,2006,6(1):37-52.
[3] Hanson J R. Steroids:partial synthesis in medicinal chemistry[J]. Nat Prod Rep,2007,4(6):1342-1349.
[4] 崔建国,曾陇梅,苏镜娱,等.多羟基甾醇的合成及其机构与抗肿瘤细胞活性关系研究[J]. 高等学校化学学报,2000,21(9):1339-1404.
[5] Mohamed N R,Elmegeed G A,Abd-Elmalek H A,et al.Synthesis of biologically active steroid derivatives by theutility of Lawesson's reagent [J]. Steroids,2005,70(3):131-136.
10-羟基喜树碱 (HCPT) 是一种活性生物碱。通常作用于细胞周期S期, 为细胞周期特异性药物, 在较高质量浓度时对核分裂有抑制作用。10-羟基喜树碱难溶于水, 微溶于多数有机溶剂, 半衰期短, 目前临床上使用的多为钠盐注射液、粉针剂及胶囊剂。...