
1 引言
近年来,程序释药体系引起了人们的广泛关注。相较于传统的给药方法,程序释药技术可以使药物浓度在受药体系内较长时间内维持在有效范围内,并可以按照一定的作用规律缓慢或恒速的释放,从而很好地避免了周期性受药方式中药物释放初期的突释以及后期不能完全释放等问题,既提高了药物的利用率,也降低了药物的毒副作用( Lei Let al. ,2010) .
程序释药技术的原型可以追溯到中国古代的“毒熨”,这是典型的透皮释药技术,特点是利用皮肤作为药物输入体循环的门户,发挥药物的治疗作用。现代医学早期的程序释药技术主要应用于口腔( Wang YZ et al. ,2010) .国外在 20 世纪 50 年代末开始研究口服缓释制剂,70 年代被医学界认可后上市的类型逐渐增加。目前国外上市的药品总计200 余种。我国在 20 世纪 70 年代开始研究口服缓释制剂,目前国内已批准上市的已有 30 余种,正在研制的品种达 80 余种。
在程序释药体系中,药物分子与具有控释性能的药物载体按照一定的物理或化学方式相结合,通过特殊的药物制剂工艺和技术,使药物按要求地释放以达到更好的治疗效果,因而设计出具有控释性能的药物载和制剂技术是程序释药技术发展的关键( Yadav AK et al. ,2010) .例如 20 世纪 60 年代即开始研究的口腔黏膜阿片,药片在口腔湿润的环境中整体溶蚀,其速率可通过改变最外层薄膜处方和制备方法来控制。治疗新观念促进了新释药系统的研发,新技术推动了制剂新产品上市( Jamzad Set al. ,2005) .本文将详细阐述程序释药的类型和实现方式,并对最近一些新的程序释药技术进行综述。
2 程序释药的研究现状
2. 1 程序释药的类型
2. 1. 1 速度控释
1) 缓释 属控释剂的初级剂型,主要是减慢释放速度。其释药过程为一级速率。对血药浓度和有效持续时间控制不严。临床疗效稍好于普通剂,但欠稳定,如何仲贵、唐星等研制出的曲尼司特缓释胶囊( 何仲贵等,1996) .缓释可以分为延时缓释和不延时缓释两类。
2) 速释 将药物高度分散形成均匀黏性混悬液,甚至以分子分散或制成分子包合物,其主要适用于溶解度小、溶解缓慢的药物,如王卓等制备的阿司匹林分散片( 王卓等,1996) 和 Gabr. KhairyE 等制备的氢氯噻嗪分散片( 张秋荣等,2008) ; 或加入吸收促进剂,使药物释放、吸收速度增快,其主要适用于大分子多肽类、蛋白质等吸收慢、生物利用度低或首过效应强的药物。其释药过程亦为一级速率。
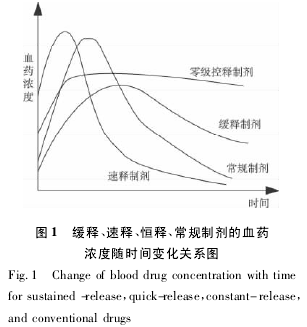
3) 恒释 又称零级控释,属精密释药系统,释药过程为零级速率。血药浓度受给药系统控制,而不受机体吸收过程控制。恒释剂在药剂学上的要求严格得多,一般多为均匀基质全分散溶解控释、膜控释、渗透压控释。苗积生等研究的异烟肼恒释片即属此类。恒释可以分为脉冲式释放和连续式释放两类。以上各种释药的类型和常规制剂的血药浓度随时间变化关系如图 1 所示。
2. 1. 2 靶向控释
此类控释系指可在人体内准确地向靶组织释药的控释系统。该系统可分为三级: Ⅰ级靶向是指控释剂可将药物特异性地分布于某个器官; Ⅱ级靶向是指控释剂可将药物选择性地释放于某个器官的病变部位; Ⅲ级靶向是指控释剂可将药物释放于某个病变部位的病变细胞内。
2. 2 程序释药的实现方式
2. 2. 1 速度控释的实现方式
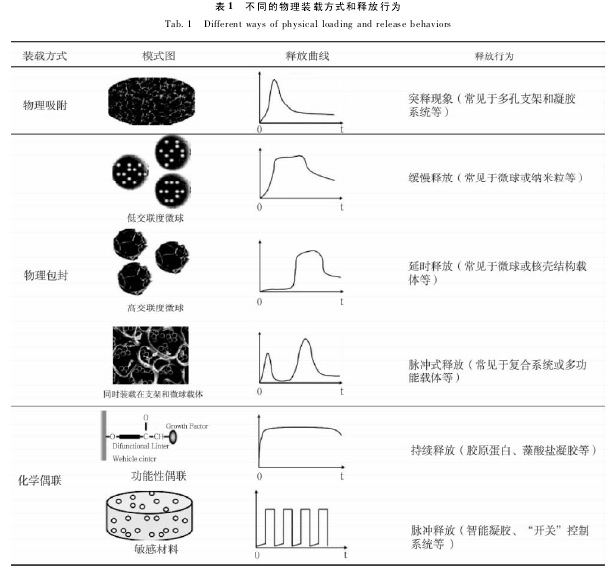
通过不同的药物装载方式可以实现不同的速度控释方式。不同的药物装载方式会形成不同的药物释放行为。目前,实现药物的装载方式主要有物理吸附、物理包封、化学偶联等。
物理吸附过程中,药物主要通过静电等物理作用吸附在载体表面,当载药系统在释放介质时,药物很快从载体表面释放,易引起药物的速释现象。常见于多孔支架和凝胶系统。
物理包封过程中,载体的交联程度是影响药物释放的关键因素之一。交联度不同的载药微球,药物的释放行有所差异,这表现在交联度高的微球载体表现为延时缓释,而交联度低的表现为不延时缓释。而对于同时利用支架和微球装载药物的复合载药系统而言,药物的释放呈明显的脉冲式释放曲线,其原因可能是载药微球从载药系统中释放后,其中的药物还需经过从微球中再释放的过程( SanVicente A et al. ,2000) .
聚合物 - 药物耦合物是目前研究最多的药物装载方式之一。药物的释放主要受环境中某些蛋白酶等的影响。通过水解药物与聚合物间的化学键,实现药物的恒释。由于癌症等病灶部位独特的生理环境,可以应用环境敏感性材料装载药物,实现药物的控制释放( 王伯初等,2012) .
表 1 给出了不同物理装载方式的模式图、释放曲线和释放行为。
2. 2. 2 靶向控释的实现方式
1) 局部靶向 系指将释药系统施于靶区,药物释放和作用亦局限于靶区。如眼科给药系统、子宫内给药系统。绝大多数的常见外用药物,如各类痤疮膏、眼药水、鼻炎滴剂、痔疮膏皆属此类。
2) 感应靶向 利用载体特性,通过磁、电感应使药物于靶区释放。赵趁等采用高压静电法制备了磁性海藻酸钙、壳聚糖微胶囊,考察了不同制备条件对微胶囊形貌、粒径分布及破损率的影响,以超氧化物歧化酶( SOD) 为模型药物,考察磁性微胶囊的包封率、载药量及体外释放性能,并初步研究磁性微胶囊的感应靶向性( 赵趁等,2011) .
3) 物理靶向 依据机体不同组织对微粒的阻留而建立的靶向。例如直径 0. 5 ~ 5 μm 的微粒易潴留在网状内皮系统丰盈的组织( 肝、脾等) .周欣颖,等制备的去甲斑蝥素肝动脉栓塞缓释微球( NCTD-MS) 即属此类( 周欣颖等,2011) .
4) 化学靶向 系指释药和效应过程与体内化学环境有关。例如肠溶载体的释药宜在 pH 中性或弱碱性环境中,pH 敏感脂质体的释药受环境的 pH值支配。国外有人将氟美松制成棕榈,以提高其脂溶性,使其选择性地向炎症部位释放。
5) 生物靶向 利用生物活性大分子与药物进行化学结合,在机体内仍保持生物活性的大分子可将药物选择性地向靶细胞释放。生物靶向药物常常用于恶性肿瘤的治疗。
3 程序释药技术的研究进展
3. 1 纳米释药技术
纳米粒子作为药物和基因的载体显现出极大的潜力并被广泛研究。纳米粒子的超微小体积可使药物输送智能化,靶向定位地将药物投递到病灶局部或专一性地作用于靶细胞。纳米粒子的载体材料可屏蔽药物不良气味、维持药物长期缓慢释放、延长药物半衰期和减小毒副作用等。
Zhanguo Yue 等构建了一种基于磁性氧化铁纳米管的传输体系,实现了难溶抗癌药物紫杉醇的靶向输送和高效给药( Zhanguo Yue et al. ,2011) .通过对结晶过程的控制,可以将紫杉醇纳米晶成功地装载于纳米管内部。该体系不仅可以借助表面修饰的亲水性分子躲避内皮网状系统的识别,在体内具有较长的循环半衰期,而且能够在外加磁场的作用下展示出良好的磁靶向性,大大提高肿瘤细胞对药物的摄取量。上述纳米管在被细胞摄取后还会被溶酶体捕获,其中酸性环境能够促进氧化铁基质的降解,从而加速了难溶药物的释放。基于上述优势,该给药体系与传统商品化制剂相比显示出了更好的抗肿瘤能力和更少的毒副作用,在难溶性抗肿瘤药物输送领域具有广阔的应用前景。相关结果作为封面文章发表在《AdvancedFunctional Materials》杂志上。
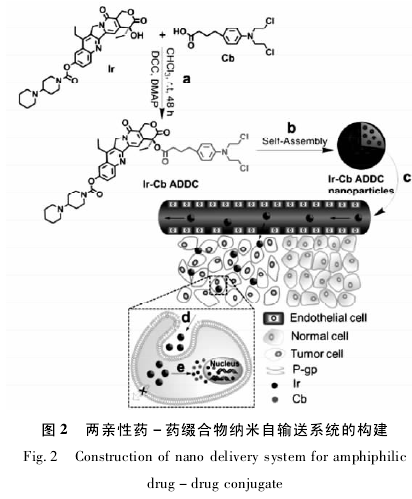
2014 年 7 月 31 日,化学领域顶级期刊《Journal ofthe American Chemical Society》发表了 Yan 等人构建的治疗癌症的纳米给药系统新策略,即两亲性药-药缀合物纳米自输送系统( 图 2) ,将亲水性的抗癌药物与疏水性的抗癌药物通过生物可降解的酯键连接而成两亲性药-药缀合物( Ping Huang et al. ,2014) .由于具有两亲特性,该两亲性药-药缀合物在水中能自组装形成纳米粒子,从而实现了药物分子的纳米化。研究表明,与小分子化疗药物相比,该纳米药物具有较长的血液停留时间,更易在肿瘤部位富集。此外,该纳米药物还能有效地抑制肿瘤细胞的多药耐药性。动物实验结果表明,该纳米药物治疗效果十分显着。与以往所有报道的纳米药物不同,该研究在不需要任何载体的帮助下就能实现小分子药物的自输送,从而达到有效治疗癌症的目的。该项研究不仅为解决纳米药物研究领域的关键问题提供了新思路,而且这一学术思想还可以拓展到其它疾病的早期诊断和治疗。
3. 2 离子渗透透皮释药技术
Vyteris 公司采用离子渗透透皮释药技术制备的利多卡因离子渗透透皮释药系统以温和的电流通过皮肤促进药物释放。麻醉乳膏和贴片释药需长达 1 小时才能使皮肤麻木,而新技术只需10 s.
3. 3 低频超声透皮释药技术
Sontra Medical 公司的利多卡因 SonoPrep 超声皮肤渗透给药装置,用于局麻。SonoPrep 应用低频超声使皮肤产生可通过角质层的可逆微通道,增加透皮和局部治疗的药物渗透性。本品局麻起效时间可将原 60 s 缩短至 5 s 或更快,有助于患者避免静脉注射疼痛( LEE ES et al. ,2007) .
3. 4 pH 响应聚合物胶束技术
pH 响应的聚合物胶束的内核或外壳在肿瘤酸性 pH 下能发生质子化或快速化学反应,导致其物理性能发生改变。胶束对肿瘤酸性 pH 的响应功能可以用来实现药物的快速释放、激活胶束的靶向功能、促进胶束的细胞内吞,以及促使胶束从溶酶体逃逸到细胞质溶质中,并靶向细胞核等细胞器。大量的体内和体外实验表明,pH 响应型胶束输送抗癌药物可以明显增加药物在作用部位如细胞质和细胞核中的浓度,饱和癌细胞的多种抗药机制,从而克服肿瘤细胞的耐药性,提高抗癌药物的治疗效率并减少其毒副作用( 许金霞等,2009) .
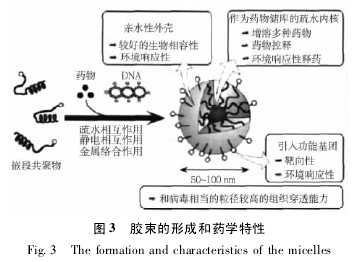
Bae 课题组一直致力于研究肿瘤靶向性聚合物胶束,并取得了可喜的成果。他们在 2002 年成功制备了具有肿瘤细胞外 pH 值响应性的聚组氨酸-聚乙二醇和聚乳酸-聚乙二醇嵌段共聚物混合胶束,并研究了抗癌药物阿霉素从混合胶束中的释放( BAE Y et al. ,2003) .一年后又深入地研究了聚组氨酸、聚乙二醇形成的胶束,以此探索其 pH 响应性释药机制。为了研究胶束的溶胀过程,2007 年他们又合成聚乳酸-聚乙二醇-聚组氨酸三嵌段共聚物,然后将其在二甲亚砜中透析得到花型的胶束( 王晓蕾等,2010) .图 3 描绘了他们研究的胶束的形成过程和药学特性。
3. 5 中药缓释固体分散技术
固体分散技术是将药物高度分散于载体中,形成一种以固体形式存在的分散系统的方法,得到的药物-载体固体分散物称为固体分散体。以水不溶性聚合物、肠溶性材料、脂质材料为载体制备的固体分散体,不但具有提高生物利用度的作用,而且具有延缓药物释放和延长药效的作用。水溶性药物及难溶性药物均可用固体分散技术制得缓控释制剂,选择适宜的载体及用量配比,可获得理想的缓控释释药系统。缓控释固体分散体常用的载体有乙基纤维素、蜡脂等。常用的制备方法有熔融法、溶解法、熔融-溶解法。
4 展望
经过几十年的发展,程序释药体系的研究和开发已经积累了相当多的理论和技术基础,而随着人类基因组框图的绘制完成,功能基因组学、蛋白质组学、代谢组学等研究相继展开; 加上医学、病理学、分子药理学、药物分子设计学、系统工程学等科学的发展和交叉渗透,基因工程技术、干细胞技术、纳米技术、自组装技术、微加工技术等生物、化工和材料新技术平台的不断涌现和逐渐走向成熟,阻碍药物释放系统研究和开发的理论难题和技术瓶颈有望在未来的发展中逐一得到解决,越来越多高效、安全、方便、实用的程序释药技术将会走向临床,在维护人类健康、提高生活质量方面发挥重要作用。
参考文献
何仲贵,唐星,唐磊,1996. 曲尼司特缓释胶囊的研制[J]. 沈阳药科大学学报,13( 1) : 9-12,17.
王卓,韩丽梅,张晓青,1996. 利用均匀设计筛选阿司匹林分散片处方[J]. 沈阳药科大学学报,13 ( 4) : 235-239.
王伯初,曹阳,2012. 纳微多药给药系统的设计与研究[J].
云南民族大学学报,自然科学版,21( 1) : 1-5.
王晓蕾,刘晨光,2010. pH 响应性聚合物胶束及其在抗癌药物给药系统中的研究进展[J]. 中国新药研究,19( 21) :1958-1963.
中药方剂有效成分配伍:配伍一般是指两种或多种药物配合使用,其目的在于调整中药极寒或极阴药性,或者根据患者病情需要,联合用药可增强疗效。而中药方剂有效成分的配伍,是更高级形式的配伍,是在一般配伍基础上发展起来的,以药物中主要作用成分,按照一定比例组...