摘要:叶酸是人体不可或缺的水溶性B族维生素,参与人体中核酸的生物合成、DNA甲基化反应、同型半胱氨酸再生蛋氨酸等重要的代谢活动。大部分乳酸菌的生长是消耗叶酸的,但越来越多的研究发现,很多种属的乳酸菌也具备合成叶酸的能力。使用产叶酸的乳酸菌作为发酵剂发酵食品,提高食品中的叶酸含量,是研发叶酸强化食品的新方向。文章主要对乳酸菌合成叶酸的通路、调控策略、影响因素以及作为发酵剂的应用情况和发酵产物中叶酸含量的检测方法等方面的研究进展及应用情况进行了概述,为乳酸菌叶酸合成机制的深入研究及高产叶酸乳酸菌的应用提供理论依据。
关键词:乳酸菌; 叶酸; 生物合成; 叶酸强化食品;
作者简介: 焦雯姝(1995-),女,硕士研究生,研究方向为食品科学。;
基金: 国家重点研发计划项目(2017YFD0400303);
Research and application of folate biosynthesis by lactic acid bacteria
Abstract:Folate is an indispensable water-soluble B vitamin in the human body. It participates in many important metabolic activities such as nucleic acid biosynthesis, DNA methylation, and homocysteine regenerate methionine. Most lactic acid bacteria consume folate for growing, but more studies have found that many of them have the ability to synthesize folate. The use of folate-producing lactic acid bacteria as a starter to ferment foods to improve the folate content in foods is a new direction for the development of folate fortified foods. This review mainly summarizes the pathways, regulation strategies, influencing factors of folate biosynthesis by lactic acid bacteria, as well as their application as a starter and the detection methods of folate content in fermented products. The review provides a theoretical basis for the further study of the mechanism of folate synthesis by lactic acid bacteria and the application of high-yield folate-producing lactic acid bacteria.
Keyword:lactic acid bacteria; folate; biosynthesis; folate fortified foods;
叶酸分子含有1分子蝶酸和1分子谷氨酸,蝶酸来源于6-羟甲基-7,8-二氢喋呤焦磷酸(DHPPP)与对氨基苯甲酸(pABA)的结合(图1),是一种水溶性维生素,又称VB9或蝶酰谷氨酸,是大多数生物体内一碳单位的供体,在维持人体机能和代谢活动中发挥着不可或缺的作用[1].叶酸摄入量不足或代谢通路受阻会影响人体细胞DNA的正常合成,导致体内同型半胱氨酸水平升高,增加脑卒的发病风险[2].
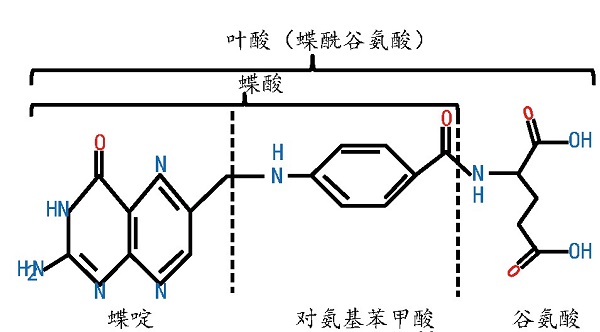
图1 叶酸的化学结构[7]
人类自身缺乏合成叶酸的基因,只能从外界摄取叶酸或由肠道中的微生物代谢合成。人们补充叶酸的形式主要有两种:一是补充膳食来源的天然叶酸,二是补充合成叶酸。然而越来越多的研究发现了过量摄入合成叶酸的危害,如掩盖VB12缺乏症[3]、改变肝脏二氢叶酸还原酶活性[4]、导致胎儿亚甲基四氢叶酸多态性(衰弱性疾病相关)、增加结直肠癌的发病风险等[5].相比之下,天然来源的叶酸安全性更高,且在机体代谢功能缺陷(如MTHFR基因突变)的情况下也可被机体吸收利用[6].补充天然叶酸的传统方法是从动植物组织中摄取,但动植物组织中的叶酸在烹煮后易损失。众所周知,乳酸菌是一种一般公认安全(GRAS)的食品级微生物,肠道中定植的产叶酸乳酸菌可以在肠道内代谢产生叶酸,为宿主提供叶酸。乳酸菌合成的叶酸不仅安全性好,而且由产叶酸乳酸菌制得的发酵食品食用无需加工,叶酸含量更稳定。本文从乳酸菌合成叶酸的通路、调控策略、影响因素以及作为发酵剂的应用情况和发酵产物中叶酸含量的检测方法几个方面进行综述,为乳酸菌合成叶酸机制的深入研究及高产叶酸乳酸菌的应用提供理论依据。
1 乳酸菌叶酸合成通路及调控策略
1.1 乳酸菌叶酸合成通路
在乳酸菌合成叶酸的通路中有2条重要的代谢途径:一条是嘌呤代谢途径,另一条是莽草酸途径[8].如图2所示,乳酸菌通过嘌呤代谢途径形成三磷酸鸟苷(GTP)最终合成6-羟甲基-7,8-二氢蝶呤-二磷酸(DHPPP)。DHPPP的生物合成是由GTP通过连续4个步骤转化而来的,第一步是由GTP环化水解酶I(EC 3.5.4.16)催化,通过Amadori重排,形成喋呤环结构。脱磷酸化后,喋呤分子发生醛缩酶和焦磷酸激酶反应,产生活化的焦磷酸化DHPPP.赤藓糖-4-磷酸和磷酸烯醇式丙酮酸通过莽草酸途径最终合成分支酸,赤藓糖-4-磷酸可通过磷酸戊糖途径合成,而磷酸烯醇式丙酮酸可通过糖酵解途径合成。分支酸是芳香氨基酸和对氨基苯甲酸(pABA)生物合成的分支点,通过氨基脱氧分支酸合成酶(EC 2.6.1.85)转化为4-氨基-4-脱氧分支酸。随后,4-氨基-4-脱氧分支酸被4-氨基-4-脱氧分支酸裂解酶(EC 4.1.3.38)裂解得到pABA,最终用于叶酸的生物合成。而后,通过形成C-N键将DHPPP连接到pABA,该缩合反应由二氢蝶酸合成酶(EC 2.5.1.15)催化,得到7,8-二氢蝶酸(DHP)。DHP经二氢叶酸合成酶(EC 6.3.2.12)谷氨酰胺化,生成二氢叶酸(DHF)。然后通过DHF还原酶(EC 1.5.1.3)还原为具有生物活性的辅因子四氢叶酸(THF),再通过叶酰聚谷氨酸合酶(EC6.3.2.17)加入多个谷氨酸片段,得到THF-聚谷氨酸。多谷氨酸化也可能发生在还原步骤发生之前,由DHF合成酶催化,或者在许多乳酸菌中,由同时负责EC 6.3.2.12和EC 6.3.2.17活性的双功能酶催化[8].
1.2 乳酸菌合成叶酸的代谢工程调控
在许多生产过程中,代谢工程已经成为传统化学合成法的替代方案。目前,乳酸菌合成叶酸的相关基因调控主要分为两个方面:一是采用过表达叶酸生物合成途径中的关键基因来提高叶酸产量;二是根据生物工程原理将叶酸生物合成相关的基因簇,整体导入到乳酸菌中构建高产叶酸的工程菌株。GTP环化水解酶I是叶酸生物合成途径中的限速酶[9],由folE编码。在某些乳酸乳球菌中,由folKE基因编码双蛋白2-氨基-4-羟基-6-羟甲基二氢蝶啶焦磷酸激酶(DHPPPK)和GTP环化水解酶I(GCHI)。Sybesma等研究发现,通过对乳酸乳球菌MG1363中的fol KE基因过量表达,可以实现DHPPPK和GCHI的过表达,从而使该菌株胞外叶酸的产量提高近10倍,总叶酸产量提高3倍[10].folC基因是调节叶酸多谷氨酸尾长度的关键基因,folC基因的过表达会增加多谷氨酸尾的长度,从而增加叶酸在细胞内的保留时间。LeBlanc等[11]以L.lactis NZ9000为载体,以nisA为启动子,过表达了folC和folKE基因,并通过动物实验证明这种工程菌株可以部分恢复由叶酸缺乏引起的巨红细胞贫血症。而dfrA基因的过表达则会因为负反馈调节作用而使叶酸产量下降[12].常用的表达载体是L.lactis NZ9000等,常用的质粒有pNZ7019、pNZ7010、pNZ7011、pNZ7016等。总之,过量表达叶酸生物合成途径中的关键基因(如folKE)能够显着提高乳酸菌的叶酸产量,并且通过选择安全的表达载体(如L.lactis NZ9000),可以得到与天然菌株同样安全的工程菌株。
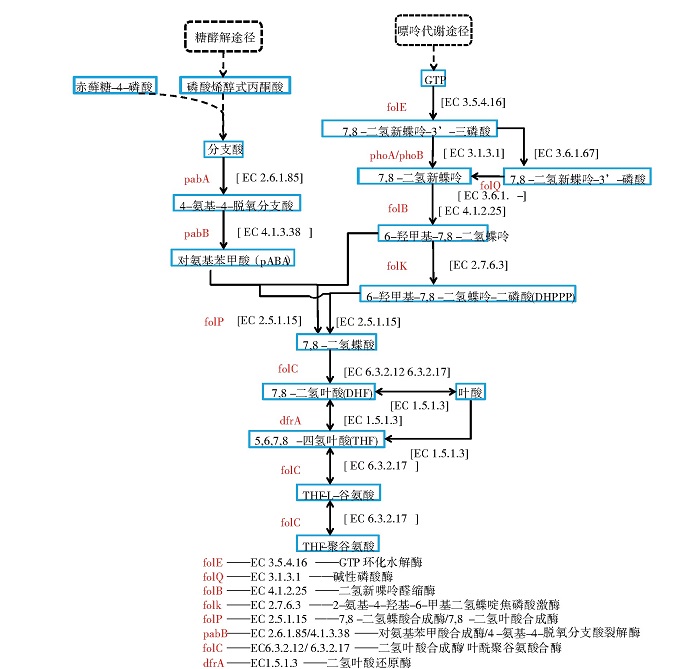
图2 乳酸菌叶酸合成通路
2 乳酸菌合成叶酸能力的影响因素
2.1 不同种属间的基因差异
最早报道的具有产叶酸能力的菌株为乳球菌属Lactococus lactis ssp.cremoris CM 22和Lactococus lactis ssp.lactis CM 28[13].此后,在双歧杆菌属(Bifidobacterium)、链球菌属(Streptococcus)、少数乳杆菌属中也发现了具有叶酸合成能力的菌株。如Lai?o等[14]发现嗜热链球菌CRL803的叶酸产量为(240±14)?g/L,Padalino等[15]发现链状双歧杆菌DSMZ 16992的叶酸产量为(288.2±20.2)?g/L.
不同种属的乳酸菌合成叶酸的能力具有差异性,这与不同种属间基因的差异有关。不同种属间具有差异的关键基因有fol Q(编码EC 3.6.1.-)、phoA/phoB(编码EC 3.1.3.1)、pabA(编码EC 2.6.1.85)、pabB(编码EC 4.1.3.38)。folQ基因或phoA/phoB基因是否存在过表达,影响着乳酸菌合成前体物DHPPP的能力。pabA基因和pabB基因则影响着乳酸菌合成前体物pABA的能力。例如,依据KEGG数据库对可预测代谢途径的基因组序列进行分析,在所有已测序的乳酸乳球菌中,均无folQ基因的存在,但乳酸乳球菌KLDS4.0325、CV56、MG1363、IO-1基因组中存在phoA/phoB基因,因而在基因水平上具有合成叶酸的能力。在所有已测序的乳杆菌属中,从头合成pABA的基因是缺失的[8],将分支酸转化为pABA的基因(pabA和pabB)也是缺失的。只有在植物乳杆菌中,由莽草酸通路产生分支酸的途径是完整的,而在其他的乳杆菌中这个途径也是缺失或不完整的。因此,在没有pABA存在的情况下,乳杆菌一般无法合成叶酸。不同的是,在乳球菌属和链球菌属中,pABA的补充不是必需的[16],因为在被测序的乳球菌和链球菌中,除了极少数以外,都具有完整的莽草酸途径和将分支酸转化为pABA的全部基因。总之,由于种属间基因的差异,叶酸合成能力具有差异。
2.2 生长环境及条件的影响
由于生长环境的不同,同一种属甚至同一菌株合成叶酸的量也有显着差异。如前所述,对氨基苯甲酸(pABA)是乳酸菌合成叶酸的重要前体物质(图2),所以外源添加pABA可以提高乳酸菌的叶酸产量,但提高的程度和pABA的添加量具有菌株差异性。张海燕[17]研究了Lb.plantarum JH-M1-6-30在pABA质量浓度为20 mg/L时,叶酸产量达到最大值1.203μg/mL.刘友群[18]研究发现,嗜酸乳杆菌CH-2在添加3%pABA的MRS液体培养基中的叶酸产量会提高约2倍。这与菌株自身pABA的合成能力及pABA合成途径中关键基因的表达有关,如一些乳杆菌属虽不具备从头合成pABA的能力,但有完整的喋啶代谢支路相关基因,这种情况下pABA的外源添加就可以显着提高叶酸产量。除了pABA外,环境中的GTP(鸟苷三磷酸)和谷氨酸也是合成叶酸及其衍生物的前体物质[19],它们在环境中的含量也会影响乳酸菌的叶酸产量。
除了外源添加前体物质,环境的pH、温度和培养基的碳源、氮源也会对乳酸菌的叶酸产量产生影响。微生物细胞自身对环境中的H+浓度是极为敏感的,不适宜的H+浓度会抑制细胞自身的代谢活动。Wilbert等[20]研究发现,若发酵过程中始终保持培养基的pH为7.0,则有利于嗜热链球菌的总叶酸产量,但较低的pH(5.0)有利于提高嗜热链球菌的胞外叶酸产量。这可能是由于较低的pH使叶酰聚谷氨酸合酶的活性下降,从而使聚谷氨酸尾的长度减短,更有利于叶酸分泌到胞外。此外,Kariluoto等[21]发现大多数乳酸菌产叶酸的最适温度在28℃左右,过高或过低的温度(37℃或18℃)均不利于乳酸菌产生叶酸。pH和温度对于乳酸菌叶酸产量的影响主要与叶酸合成过程中相关酶的最适pH和最适温度有关。
3 产叶酸乳酸菌的应用
3.1 在叶酸强化食品中的应用
随着食品科学技术的不断提高,营养强化食品的出现能够更好地满足人们的营养需求。欧盟建议成年人每日叶酸摄入量为400μg,孕期和哺乳期妇女的每日叶酸推荐摄入量为400~600μg,人体对膳食中叶酸的吸收机制如图3所述。在发酵过程中,产叶酸乳酸菌会将合成的叶酸分泌到食品中,从而增加食品中的叶酸含量。有研究称,叶酸在牛乳中的含量仅为50~100μg/L,但发酵后它的浓度可能会增加到超过200μg/L[22].Tidona等发现使用乳球菌(Lactococcus hircilactis)发酵乳,可以使乳中的叶酸含量提高4倍[23].同时,使用产叶酸的益生菌与嗜热链球菌和/或保加利亚乳杆菌联合发酵乳,叶酸含量高于原乳和传统发酵乳。在发酵乳中,叶酸通过与蛋白质结合,增强了叶酸的稳定性,提高了5-甲基四氢叶酸的生物利用度。除了可以提高发酵乳中的叶酸含量,产叶酸的乳酸菌还可以应用于其他发酵制品。Mosso等研究了使用清酒乳杆菌CRL 2209和CRL 2210来提高发酵马铃薯制品的营养价值,在发酵24 h之后马铃薯制品中的叶酸含量达到730~1484 ng/g[24].Saubade等[25]发现,通过发酵可以将谷物发酵制品中的叶酸含量提高7倍。由此可见,通过选择适宜的菌种和培养条件,产叶酸乳酸菌可以广泛地应用于叶酸强化食品的开发,这种叶酸强化食品含有高水平的天然叶酸,具有更好的稳定性和生物利用度,与化学合成叶酸相比具有一定优势。
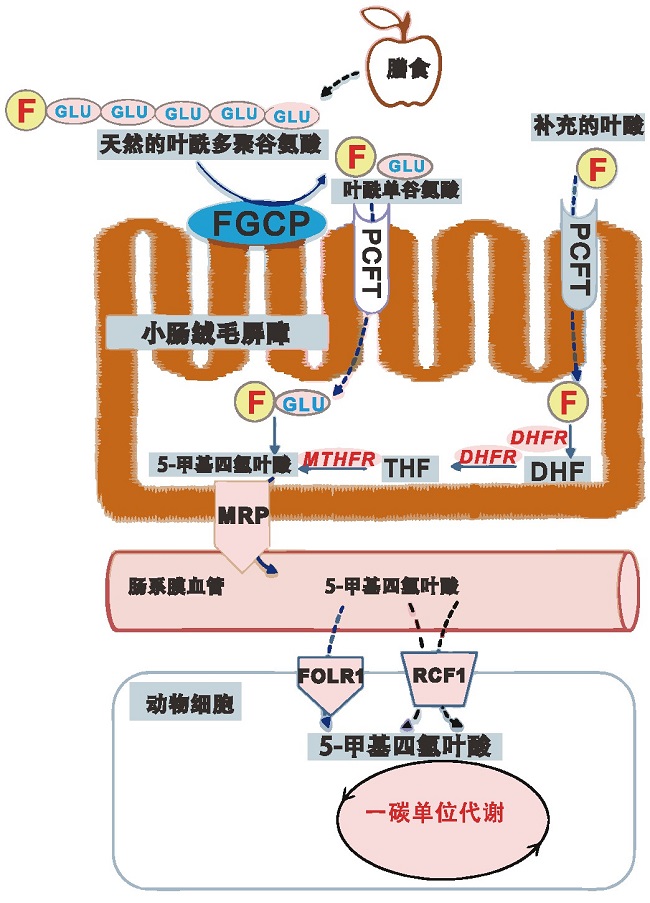
图3 人体对膳食中叶酸的吸收机制[7]
注:F(Folate),叶酸;FGCP(Folylpoly-γ-glutamyl carboxypeptidase):叶酰多谷氨酰羧肽酶;PCFT(Protoncoupled folate transporter):质子对叶酸转运载体;DHF:二氢叶酸;DHFR:二氢叶酸还原酶;THF:四氢叶酸;MTHFR:亚甲基四氢叶酸还原酶;MRP(Multidrugassociated protein):多药相关蛋白;FOLR:叶酸受体蛋白;RFC:还原型叶酸载体。
3.2 在疾病的缓解和改善中的应用
叶酸参与人体两种至关重要的反应:一是参与核酸的生物合成,二是参与与DNA合成和修复有关的甲基化反应。同时,乳酸菌对免疫系统和肠道微生物的组成和功能有积极的影响,已被认为具有治疗或预防感染以及一些自身免疫性和特应性疾病的能力。产叶酸乳酸菌进入肠道后,其所分泌的叶酸能够被结肠上皮细胞利用,从而阻止炎症及结肠癌的发生。Romina等以小鼠为动物模型,验证了嗜酸乳杆菌CRL 808能够减弱5-FU对于癌症患者的副作用(引发肠炎),同时叶酸的衍生物(5,10-甲基四氢叶酸)能够增强5-FU的抗癌作用[26].Lai?o等利用小鼠模型验证了采用食用产叶酸乳酸菌发酵的牛乳可以提高小鼠血浆中的叶酸含量并降低同型半胱氨酸的水平[27].Leblanc等发现高产叶酸的重组乳酸乳球菌可以显着提高叶酸缺乏小鼠器官和血液中的叶酸浓度,并可以部分恢复由叶酸缺乏导致的巨红细胞贫血症[12].这可以用叶酸-甲硫氨酸的循环代谢机制(图4)来解释,叶酸是机体甲硫氨酸代谢的关键因子。当人体的叶酸含量摄入正常时,体内同型半胱氨酸(Hcy)含量维持正常水平,反之,当叶酸缺乏时,同型半胱氨酸含量升高,同时,叶酸会为机体提供DNA甲基化所必需的S-腺苷甲硫氨酸(SAM)。也有研究表明,若用抗二甲双胍的产叶酸益生菌辅助二甲双胍治疗Ⅱ型糖尿病,可以减弱二甲双胍对于患者肠道微生态的破坏,从而减轻二甲双胍的副作用(如腹泻)[28].益生菌辅助疾病治疗的可行性已经经过临床验证,筛选具有叶酸合成能力且安全性高的乳酸菌辅助疾病治疗具有广泛的应用前景。
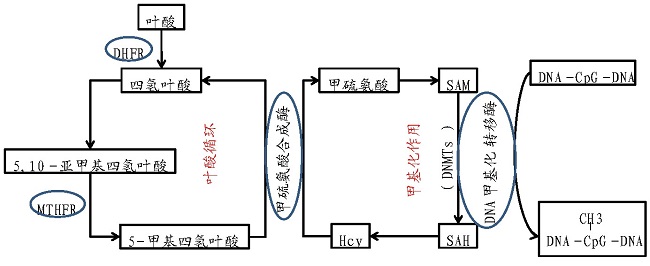
图4 叶酸-甲硫氨酸循环代谢图
4 乳酸菌发酵制品中叶酸含量的检测方法
叶酸对光、氧化、热、酸等敏感,需要高灵敏度的分析方法。用于测定叶酸含量的分析技术有生物学的方法,如微生物法和竞争性蛋白结合法;也有化学方法,如高效液相色谱法(HPLC)。
对于食品或发酵制品中叶酸的定量,微生物法是官方分析化学家协会(AOAC)和美国谷物化学家协会(AACC)正式审查和批准的最常用方法。它是根据微生物特别是鼠李糖乳杆菌(Lactobacillus casei sub sp.Rhamnosus ATCC 7469)在生长和繁殖时对叶酸的营养需求进行分析,用于食物中总叶酸的分析,对大多数天然叶酸都有反应,除了叶酸降解产物、蝶酸和嘌呤。在实验中,微生物的生长取决于培养基中叶酸的含量,微生物的生长速率是由溶液浊度的变化来衡量的,从而反映出样品中叶酸的量。在传统的叶酸微生物测定方法的基础上,Saini等[29]发现使用冷冻保护的鼠李糖乳杆菌可以缩短测定时间,简化的96孔微滴度板技术也被发现可以提高检测限和结果的重现性。微生物法虽然是目前最灵敏、被广泛接受的食品叶酸的测定方法,但也存在一些缺点,如对各种生物活性叶酸形式的反应略有差异,校准范围窄,且无法区分不同的叶酸形式等。
竞争性蛋白结合法是通过微滴定板上的显色反应测定的,显色反应是样品叶酸与放射性标记叶酸附着于叶酸结合蛋白上时竞争的结果。尽管该方法快速、方便,但由于这种方法对不同形式的叶酸有不同的亲和力,只适用于分析含有相同形式叶酸的样品,而不适用于分析同时含有几种叶酸形式的复杂基质。
高效液相色谱技术的发展能够很好地克服微生物法无法区分不同形式叶酸的缺点。高效液相色谱法(HPLC)是根据化学结构的不同进行分离和检测,在检测叶酸时多采用紫外检测器或二极管检测器(280 nm)。HPLC的优点是特异性高,一些研究表明,对于食品或发酵制品中叶酸的定量,HPLC法和微生物法有很好的相关性,但HPLC法的测量值通常较低于微生物法(20%~50%)[30].同时,在高效液相色谱法中,需要使用所有已知形式的叶酸作为标准品来量化总叶酸,而有些形式叶酸的标准品难以得到或是价格昂贵。
此外,样品制备及提取方法对提取的叶酸含量也会有很大的影响。在样品处理的过程中应注意避光操作,所用器皿应采用棕色容量瓶或包裹避光铝箔纸。同时也可以在萃取时加入VC或巯基乙醇等抗氧化剂,保护叶酸,使叶酸不被氧化。
5 总结与展望
叶酸对于人体健康的重要性值得关注,利用乳酸菌制备叶酸或是通过发酵来提高食品中的叶酸含量具有重要意义。目前,研究人员对乳酸菌合成叶酸的通路、调控手段、产叶酸乳酸菌的应用已有了初步的研究进展,用于叶酸含量的检测方法已趋于成熟。
但就目前的研究成果来看,乳酸菌合成叶酸的量不足以满足人体的全部叶酸需要,即使是由高产叶酸乳酸菌所发酵的食品,其叶酸含量也达不到成人每日推荐摄入量(中国居民膳食叶酸推荐成人摄入量为400?g)。因此,仅仅筛选高产叶酸的乳酸菌是远远不够的,如何优化产量是未来研究的一个重要方向,可从喋呤、pABA和叶酸的转运机制以及代谢途径调节机制入手。此外,产叶酸乳酸菌进入肠道后,对于肠道菌群结构的影响还未见深入的报道,乳酸菌所产生的叶酸是否会促进肠道有益或是有害菌的生长,还有待进一步研究。通过动物实验,采集受试动物的肠道内容物进行高通量测序分析可作为一种研究方法。
参考文献
[1] Steluti J, Reginaldo C, Selhub J, et al. Presence of circulating folic acid in plasma and its relation with dietary intake, Vitamin B complex concentrations and genetic variants[J]. European Journal of Nutrition,2018.
[2] Kang W, Chen Y, Lu D, et al. Folic acid contributes to peripheral nerve injury repair by promoting Schwann cell proliferation, migration, and secretion of nerve growth factor[J]. Neural Regeneration Research,2019,14(1):132-139.
[3] Morris M S, Jacques P F, Rosenberg I H, et al.Folate and Vitamin B-12 status in relation to anemia,macrocytosis,and cognitive impairment in older Americans in the age of folic acid fortification[J]. The American Journal of Clinical Nutrition,2007,85(1):193-200.
[4] Tamura T, Picciano M F. Folate and human reproduction[J]. American Journal of Clinical Nutrition,2006,83(5):993.
[5] Kok D E, Steegenga W T, Smid E J, et al. Bacterial folate biosynthesis and colorectal cancer risk:more than just a gut feeling[J]. Critical Reviews in Food Science and Nutrition,2018.
[6] Scaglione F, Panzavolta G. Folate, folic acid and5-methyltetrahydrofolate are not the same thing[J].Xenobiotica,2014,44(5):480-488
[7] Saini R K, Nile S H, Keum Y. Folates:Chemistry, analysis,occurrence, biofortification and bioavailability[J]. Food Research International,2016,89:1-13.
[8] Rossi M, Amaretti A, Raimondi S. Folate Production by Probiotic Bacteria[J]. Nutrients,2011,3(1):118-134.
[9] Serrano-Amatriain C, Ledesma-Amaro R, López-Nicolás Rubén, et al. Folic Acid Production by Engineered Ashbya gossypii[J]. Metabolic Engineering,2016,38.
[10] Sybesma W, Starrenburg M, Kleerebezem M, et al.Increased Production of Folate by Metabolic Engineering of Lactococcus lactis[J]. Applied and Environmental Microbiology,2003,69(6):3069-3076.
[11] Leblanc J G, Sybesma W, Starrenburg M, et al. Supplementation with engineered Lactococcus lactis improves the folate status in de?cient rats[J]. Nutrition,2010,26(7-8):835-841.
[12] Leblanc J G, Sinderen D V, Hugenholtz J, et al. Risk Assessment of Genetically Modi?ed Lactic Acid Bacteria Using the Concept of Substantial Equivalence[J]. Current Microbiology,2010,61(6):590-595.
[13] Gangadharan D, Sivaramakrishnan S, Pandey A, et al.Folate-producing lactic acid bacteria from cow's milk with probiotic characteristics[J]. International Journal of Dairy Technology,2010,63(3):339-348.
[14] Lai?o J E, Juárez Del Valle M, Hébert E M, et al. Folate production and fol genes expression by the dairy starter culture Streptococcus thermophilus CRL803 in free and controlled pH batch fermentations[J]. LWT-Food Science and Technology,2017,85:146-150.
[15] Padalino M, Perez-Conesa D, López-Nicolás R, et al. Effect of fructooligosaccharides and galactooli-gosaccharides on the folate production of some folate-producing bacteria in media cultures or milk[J]. International Dairy Journal,2012,27(1-2):27-33.
[16] Makarova K S, Koonin E V. Evolutionary genomics of lactic acid bacteria[J]. J.Bacteriol,2007,189:1199-1208.
[17]张海燕,柳陈坚,何树芬,等。高产叶酸植物乳杆菌的筛选及应用研究[J].食品与生物技术学报,2018,37(5):0487-0494.
[18]刘友群。乳酸菌发酵代谢合成叶酸的影响因素[J].中国乳品工业,2011,39(3):10-13.
[19] Dhanya Gangadharan K M N. Folate production using Lactococcus lactis ssp cremoris with implications for forti?cation of skim milk and fruit juices[J]. LWT-Food Science and Technology,2011,44:1859-1864.
[20] Wilbert S, Marjo S, Linda T, et al. Effects of cultivation conditions on folate production by lactic acid bacteria[J].Applied and Environmental Microbiology,2003,69(8):4542-4548.
[21] Kariluoto S, Edelmann M, Herranen M, et al. Production of folate by bacteria isolated from oat bran[J].International Journal of Food Microbiology,2010,143(1-2):41-47.
[22] Lai?o J E, Juarez Del Valle M, Savoy de Giori G, et al.Applicability of a Lactobacillus amylovorus strain as coculture for natural folate bio-enrichment of fermented milk[J]. International journal of food microbiology,2014,191:10-16.
[23] Tidona F, Meucci A, Povolo M, et al. Applicability of Lactococcus hircilactis and Lactococcus laudensis as dairy cultures[J]. International Journal of Food Microbiology,2018,271:1-7.
[24] Mosso A L, Jimenez M E, Vignolo G, et al. Increasing the folate content of tuber based foods using potentially probiotic lactic acid bacteria[J]. Food Research International,2018,109:168-174.
[25] Saubade F, Hemery Y M, Rochette I, et al. Influence of fermentation and other processing steps on the folate content of a traditional African cereal-based fermented food[J]. International Journal of Food Microbiology,2018,266:79-86.
[26] Romina L, Graciela S d, Alejandra M L, et al. Folateproducing lactic acid bacteria reduce inflammation in mice with induced intestinalmucositis[J]. Journal of applied microbiology,2018.
[27] Lai?o J E, Zelaya H, Juárez Del Valle M, et al. Milk fermented with selected strains of lactic acid bacteria is able to improve folate status of de?cient rodents and also prevent folate de?ciency[J]. Journal of Functional Foods,2015,17:22-32.
[28] Olgun A.“Metformin-resistant” folic acid producing probiotics or folic acid against metformin's adverse effects like diarrhea[J]. Medical Hypotheses,2017,106:33-34.
[29] Saini R K, Manoj P, Srinivasan K, et al. Relative bioavailability of folate from the traditional food plant[J].Journal of Food Science and Technology,2016,53(1):511-520.
[30] Tyagi K, Upadhyaya P, Sarma S, et al. High performance liquid chromatography coupled to mass spectrometry for profiling and quantitative analysis of folate monoglutamates in tomato[J]. Food Chemistry,2015,179:76-84.