
哺乳动物雄性生殖系统各器官的炎症均可以引起机体生殖功能障碍,主要病理表现为抑制睾丸产生雄性激素、精子数目减少、活力降低、暂时性丧失生育能力及疼痛等[1].Toll样受体(Toll-like re-ceptors,TLRs)是存在于机体内的一类重要的模式识别受体(pattern recognition receptors,PRRs),通过识别多种病原相关分子模式(pathogen associatedmolecular patterns,PAMPs),例如脂多糖(lipopo-lysaccharide,LPS)、肽聚糖(peptidoglycan,PGN)、脂磷壁酸(lipoteichoic acid,LTA)等介导机体的天然免疫应答;该受体还能进一步通过信号传导启动获得性免疫应答,为天然免疫和获得性免疫之间架起了一座桥梁,从而促使机体免疫系统在抵抗病原体方面发挥重要作用。目前发现,TLRs家族至少有13个 成 员,牛 的 组 织 中TLRs包 括TLR1~TLR10[2-5].TLRs主要表达于免疫系统的单核细胞系,同时也表达于其他组织的成纤维细胞、上皮细胞等。最新研究证实,在人、大鼠、小鼠、猪和家兔等动物的生殖组织及细胞中均发现不同TLRs的表达[6],推测TLRs在保护生殖系统免受病原体感染和降低炎症对生殖系统的损害方面发挥了重要作用。
牦牛(Bos grunniens)是青藏高原居民饲养的最重要的牲畜,也是藏族牧民重要的经济来源。然而,高原型牦牛繁育率仅为27.76%~37.87%(平均为32.07%)[7],其原因除了营养的供应不均衡之外,是否与牦牛生殖系统抗感染能力相关,还需深入的研究。为了解TLRs在牦牛生殖系统的表达情况并丰富牦牛生殖系统中先天性免疫功能基因的研究资料,本研究应用RT-PCR技术从牦牛脾组织中克隆TLR1~TLR10基因,并以雄性牦牛生殖器官为材料,通过RT-PCR技术检测雄性牦牛生殖器官(睾丸、附睾头、附睾体、附睾尾、输精管和阴茎)中TLR1~TLR10mRNA的表达水平。
1、材料与方法
1.1、试验样品
成年健康麦洼牦牛,产于四川省阿坝州,由四川省雅安市多营清真屠宰场提供。屠宰后分别采集牦牛的脾、睾丸、附睾头、附睾体、附睾尾、输精管和阴茎,分装于含RNA样品保存液的离心管中,4℃过夜,-80℃保存。
1.2、主要试剂及仪器
RNA样 品 保存 液、RNA Simple Total RNAKit、质粒小提试剂盒、2×Taq PCR Master Mix、DNA Marker、Greenview均购自天根生化科技(北京)有限公司pMD19-T Simple载体购自宝生物工程 (大 连)有 限 公 司。RevertAid First StrandcDNA Synthesis Kit由Fermentas公 司 购 买。EZNATMGel Extraction Kit购自美国OMEGA公司。其余试剂均为国产或进口分析纯。
1.3、引物的设计与合成
根 据 美 国 国 立 生 物 技 术 信 息 中 心 (NationalCenter of Biotechnology Information,NCBI)Gen-Bank中已登录的牛TLR1(NM_001046504)、TLR2(AF368419)、TLR3(NM_001008664)、TLR4(NM_174198)、TLR5(GQ866979)、TLR6(NM_001001159)、TLR7(DQ333225)、TLR8(EF583902)、TLR9(NM_183081)、TLR10(AY634632)和家牛(Bos taurus)看家基因GAPDH(NM_001034034)的序列,利用软件Primer 5.0分别设计1对引物(F和R)用于目的基因的特异性扩增(见表1)。这些引物均由北京华大基因有限公司合成。
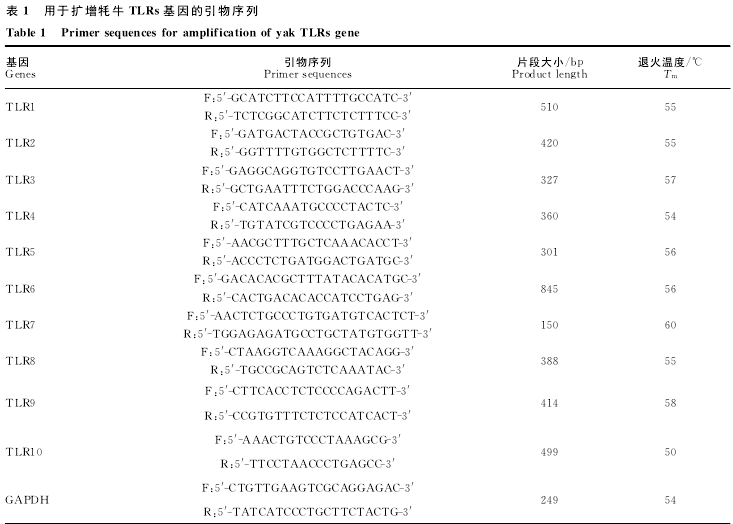
1.4、牦牛TLRs基因的RT-PCR扩增
按照总RNA提取试剂盒说明书提取牦牛脾总RNA,参照RevertAid First Strand cDNA Synthe-sis Kit说明书操作合成cDNA第一链。以合成的cDNA为模板,PCR扩增TLR1~TLR10基因。反应体系如下:cDNA模板1μL,2×Taq PCR MasterMix 10μL,上、下游引物各1μL,补足无RNA酶的ddH2O至20μL.
PCR扩增程序:94℃预变性3min;94℃变性30s,退火30s,72℃延伸45s,30个循环;72℃延伸10min;4℃保存。15g/L琼脂糖凝胶电泳检测PCR产物。
1.5、牦牛TLRs基因的克隆及测序
将50μL扩增产物进行凝胶电泳,按DNA回收试剂盒回收目的片段。将目的片段与pMD19-TSimple Vector载体16℃过夜连接,转化大肠杆菌DH5α感受态细胞,蓝白斑筛选阳性克隆菌落。经菌液PCR和质粒PCR鉴定的质粒送北京华大生物技术有限公司测序。获得的序列进行BLAST比对。
1.6、牦牛TLRs基因器官表达谱及半定量分析
分别提取牦牛脾、睾丸、附睾(头、体和尾)、输精管和阴 茎 中 总RNA,进 行RT-PCR扩 增 (以 基 因GAPDH为内参基因),每份样本半定量RT-PCR重复3次。
PCR反应程序:94℃预变性4min;94℃变性30s,退火30s,72℃延伸45s,共30个循环;72℃延伸10min.
15g/L琼脂糖凝胶电泳检测PCR产物并拍照。电泳图片经Quantity One软件计算各条带灰度值,并按公式计算出TLR1~TLR10mRNA在各组织的相对含量(目的基因mRNA相对含量=目的基因条带灰度 值÷相应 内 参 基 因 条 带 灰 度 值×100%),并对结果进行统计学分析。
2、结果
2.1、牦牛TLRs基因的RT-PCR扩增
琼脂糖凝胶电泳检测结果表明,RT-PCR分别扩增出TLR1~TLR10基因的预期条带(见图1)。
2.2、菌液和质粒的PCR鉴定
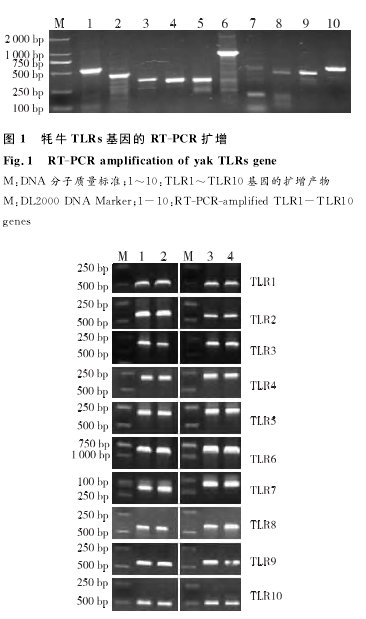
PCR扩增产物的电泳结果显示,菌液和质粒电泳条带处出现与预期相吻合的目的条带(见图2),证实TLRs基 因 序 列 已 被 成 功 插 入 克 隆 载 体。
BLAST比对结果显示,克隆的牦牛TLRs基因序列与NCBI中已登录的家牛TLRs基因编码区核苷酸序列的相似性均在98%~100%之间,说明克隆的基因序列为牦牛TLRs基因。
2.3、牦牛TLRs基因器官表达谱及半定量分析
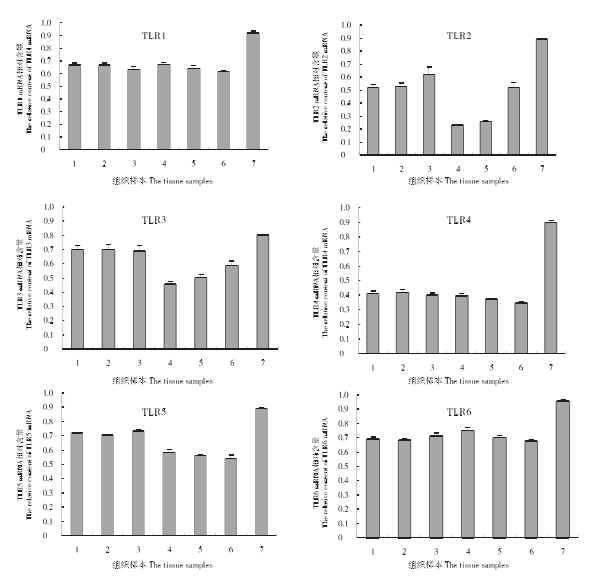
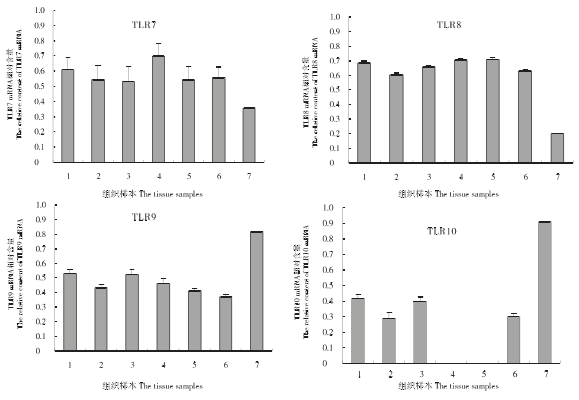
琼脂糖凝胶电泳结果显示,TLR1~TLR10mRNAs在牦牛睾丸、附睾(头、体和尾)、输精管和阴茎中均有不同程度的表达。半定量分析结果(见图3)显示,TLR1mRNA和TLR3~TLR9mRNAs在睾丸、附睾、输精管和阴茎中均相对高表达,各器官之间差异不显著;TLR2mRNAs在附睾尾和输精管中相对低表达,在其他组织中相对高表达;TLR10mRNA在睾丸、附睾头、附睾体和阴茎中相对低表达,而在附睾尾和输精管中不表达。
3、讨论
雄性哺乳动物生殖系统易受细菌、病毒和真菌等病原体感染从而影响生育力,如附睾受大肠杆菌和衣原体感染引起附睾炎和输精管阻塞,通过影响精子运动而降低了雄性哺乳动物的生育力[8];同时细菌产物如LPS,能够诱发睾丸炎症,从而抑制睾丸间质细胞产生雄性激素和生精上皮细胞产生精子。
TLRs是PRRs家族的重要成员,属于胞外模式识别受体,在先天性免疫中发挥重要作用。TLRs不仅在免疫细胞(巨噬细胞和树突状细胞等)中表达,而且雌性哺乳动物的生殖器官存在多种TLRs的表达[9],这说明TLRs对雌性哺乳动物的生殖系统先天性免疫可能非常重要。但是,TLRs在雄性牦牛生殖系统中是否表达及表达丰度还鲜见报道。
TLRs能在人和多种雄性动物生殖器官或细胞中表 达。Naito[10]仅证明了人睾丸表达TLR1~TLR10,而其他生殖器官如附睾、输精管和副性腺等是否表达TLRs未曾报道。Palladino等[11]首次综合分析了TLRs及其配体蛋白在雄性大鼠生殖系统中的表达水平,发现TLR1~TLR9在睾丸、附睾和输精管中高丰度表达,TLR10低表达,TLR11微弱表达。Bhushan等[12]发现,大鼠生精细胞在特定发育时期表达TLR2、TLR3和TLR4,管周细胞高表达TLR3和TLR11,而TLR2、TLR4和TLR6低表达。刘秀芝等[13]研究发现,健康大鼠Sertoli细胞高表达TLR2~TLR8,低表达TLR9和TLR10,未检出TLR1和TLR5表达;体外感染组与对照组比对发现,TLR2和TLR6表达上调,表明TLRs被激活,参与支持细胞的免疫调节。
Wu等[14]研究证明,在小鼠睾丸支持细胞TLR2~TLR5高表达,TLR6、TLR7和TLR13相对低表达。此外,兔睾丸中检测到TLR2和TLR4的表达[15],猪睾丸中检测到TLR4的表达[16].当生殖系统受病原入侵时,TLRs识别 相关PAMPs,通过胞浆功能区向细胞内传递活化信号,从而激活转录因子,诱导促炎性因子IL-1、IL-6、IL-8、IL-12、TNF-α等的产生及表达水平上调,启动机体先天性免疫反应,清除病原体。到目前为止,有少数研究已证明,TLRs相关配体及蛋白在雄性哺乳动物生殖器官中表达。Malm等[17]在人附睾上皮细胞和精子中发现LBP蛋白的表达,该蛋白能够与革兰氏阴性细菌细胞壁的主要成分LPS相结合形成复合物,再与CD14相互作用,激活TLR4信号途径,引起机体防御性反应。Riccioli等[18]通过受体激动剂激活TLR2、3和5,使ICAM-1和MCP-1在睾丸支持细胞中表达水平上调。Palladino等[11]发现,TLR接头蛋白MyD88和TICAM1以及RELA和NFKBIA蛋白在睾丸、附睾和输精管中高丰度表达。Winnall等[19]证明,TLR4共体蛋白MD2和CD14在大鼠支持细胞中表达。Zhang等[20]发现LPS刺激公鸡睾丸和附睾,激活TLR4,从而引起IL-1β、IL-6和CXCLi2表达上调。因此,在雄性哺乳动物的生殖系统中TLRs识别PAMPs后,通过相关信号传导,刺激TLRs关键配体蛋白、促炎性因子及趋化因子等在睾丸、附睾和输精管中的表达水平上调。
本研究应用RT-PCR技术,从牦牛脾中成功克隆了TLRs基因,并对雄性牦牛生殖器官中TLRs基因mRNA表 达 水 平 进 行 了 检 测。结 果 显 示,TLR1、TLR3~TLR9在睾丸、附睾、输精管和阴茎中相对高表达,TLR2在附睾尾和输精管中相对低表达;TLR10在睾丸、附睾头、附睾体和阴茎中相对低表达,在附睾尾和输精管中不表达。结果表明,TLR1~TLR10在牦牛雄性生殖器官中广泛表达,推测可能与其参与生殖器官天然免疫以及诱导获得性免疫密切相关,在抵御牦牛生殖系统感染过程中可能发挥重要作用。
参考文献:
[1]CARLSEN E,ANDERSSON A M,PETERSEN J H,et al.History of febrile illness and variation in semen quality[J].Hum Reprod,2003,18(10):2089-2092.
[2]KUMAR H,KAWAI T,AKIRAS S.Toll-like receptors andinnate immunity[J].Biochem Biophys Res Commun,2009,388(4):621-625.
[3]CHANG J S,RUSSELL G C,JANN O,et al.Molecular clo-ning and characterization of Toll-like receptors 1-10in sheep[J].Vet Immunol Immunopathol,2009,127(1-2):94-105.
[4]UENISH H,SHINKAI H.Porcine Toll-like receptors:thefront line of pathogen monitoring and possible implications fordisease resistance[J].Dev Comp Immunol,2009,33(2):353-361.
[5]MCGUIRE K,JONES M,WERLING D,et al.Radiation hy-brid mapping of all 10characterized bovine Toll-like receptors[J].Anim Genet,2006,37(1):47-50.
[6]MARK P.Toll-like receptors and signalling in spermatogenesisand testicular responses to inflammation:aperspective[J].JReprod Immunol,2011,88(2):130-141.
[7] 张君,余四九。高原型牦牛繁育状况及繁殖母牛体况调查[J].畜牧与兽医,2005,37(8):21-22.ZHANG Jun,YU Si-jiu.Survey of the breeding condition andreproduction body condition of cow of plateau yaks[J].AnimalHusbandry & Veterinary Medicine,2005,37(8):21-22.(inChinese)
[8]CHAN P T,SCHLEGEL P N.Inflammatory conditions of themale excurrent ductal system.PartⅠ。[J].J Androl,2002,23(4):453-460.
[9]ANDERSEN J M,KHAIRY D,INGALLS R R.Innate immu-nity at the mucosal surface:role of Toll-like receptor 3and




