
可吸收钉固定器是用于微创或开放外科手术中修补材料固定( 如疝修补术) 及组织对合的一次性使用、无菌的医疗器械,一般由击发器和可吸收钉两部分组成.可吸收钉常由聚乳酸( PLA) 、聚丙交 -乙交酯( PGLA) 等可吸收材料制备,它可将修补材料固定在修补位置直至形成充分的组织内增长,此后逐步被机体降解吸收.
可吸收钉固定器使用便捷,既具有显着的固定效果又可随时间推移减少病人体内外来异物残留,减小了一些术后潜在并发症的发生率[1],是在软组织修补方面的一大创新.可吸收钉固定器的优势已经在临床上得到认可[2 -3],但由于目前国内尚无自主研制、生产的同类产品,目前可吸收钉固定器在国内的应用远不如在国外广泛.
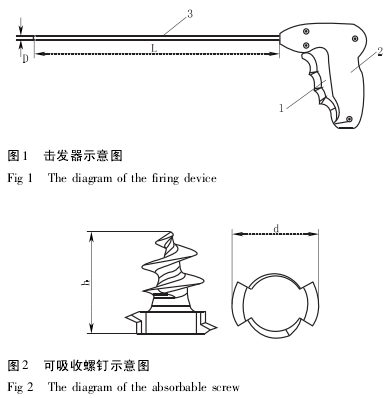
本研究所用的可吸收钉固定器是由国内公司生产的、在国内首次申请注册的Ⅲ类医疗器械.它由击发器( 包括扳机、手柄和钉管) 和可吸收钉螺钉两部分组成.如图 1、2 所示.钉管内放置多枚螺钉,使用时扣动扳机后可成功发射一枚螺钉.螺钉由 PLGA 注塑而成,由溶剂紫 13 进行染色.
作为长期与人体组织接触的植入器械,为保证临床使用的安全性,对其进行合理的生物学评价是必要的.植入试验作为评价活体组织与材料相互作用的试验,在整套生物学评价中占有非常重要的地位.本文在相关物理化学分析及体外生物学试验的基础上,对 PLGA 螺钉进行肌肉植入试验重点评价其植入后的局部组织学反应,结果显示 PLGA 可吸收螺钉在植入周期内呈现较好的组织相容性[4 -6].
本实验结果也为该国产可吸收钉固定器在临床上的应用提供了参考.
1 试验材料
1. 1 试剂
戊巴比妥钠( 美国 Sigma) 、碘酊( 山东利尔康消毒科技股份有限公司) 、乙醇溶液( 北京化工厂) 、甲醛( 西陇化工股份有限公司) 、氯化钠溶液( 石家庄四药有限公司) .
1. 2 设备
显微镜( LEICADM6000B,德国) 、压力蒸汽灭菌器( 上海申安医疗器械厂)
1. 3 试验动物
Wistar 大鼠 25 只,均为雄性,体重 200 ~ 250 g( 中国食品药品检定研究院动物繁育场; 许可证号:SCXK11 - 00 - 0010) ; 并按照 1、4、12、26、36 周 5 个时间点将大鼠均分为 5 组.
1. 4 材料制备
PLGA 棒材( 丙交酯与乙交酯的比例为( 80 ± 5)∶ ( 20 ± 5) ,螺钉的相对分子质量不低于 150000) : 由PLGA 注塑而成且溶剂紫 13 染色,规格为直径 1mm、长 10 mm 的棒状材料,环氧乙烷灭菌( 北京天助畅运医疗技术股份有限公司提供) ; 高密度聚乙烯对照材料( HDPE) : 无菌条件下加工成宽 1 mm、长 10 mm 的片状材料,试验前用 75%乙醇浸泡消毒备用( 原材料购于美国药典委员会,无菌间内剪切、消毒).
2 方法
2. 1 肌肉植入试验
大鼠腹腔注射 30 mg·kg- 1戊巴比妥钠麻醉,背部术野剃毛,按外科常规手术要求以 2% 碘酊和75% 乙醇溶液消毒试验区域.脊柱左右两侧肌肉各植入 2 个植入物,左侧为对照( HDPE) ,右侧为样品( PLGA) ,每个时间点共植入对照 10 个,样品10 个.植入后 1、4、12、26、36 周分别无痛处死试验动物.切取包裹试样周围约 0. 5 ~ 1. 0 cm 的组织,置质量分数为 10% 的甲醛固定液( 用质量浓度9 g·L- 1的氯化钠溶液进行 10 倍稀释) 中固定.
将固定组织石蜡包埋后切片( 材料取出后切片) ,进行 HE 染色,在光学显微镜下观察,观察比较样品与对照材料周围组织反应,如炎症细胞和其他细胞存在情况、试样周围纤维囊腔形成和试样与组织界面处的异常情况.并依据 GB/T 14233. 2-2005 中组织反应分级的方式( 如表 1、表 2 所示)对炎症反应进行分级.
2. 2 组织反应分级
2. 2. 1 炎性反应分级 0 级: 试样周围未见炎性细胞; Ⅰ级: 试样周围仅见少量淋巴细胞; Ⅱ级: 试样周围可见少量嗜中性粒细胞和淋巴细胞,偶见多核异物巨细胞; Ⅲ级: 试样周围可见以嗜中性粒细胞浸润为主的炎性反应,并可见组织细胞、吞噬细胞、毛细血管和小血管.
2. 2. 2 纤维囊腔形成分级 0 级: 囊壁较薄,由少量胶原纤维和 1 ~ 2 层纤维细胞组成; Ⅰ级: 囊壁有变薄而致密趋势,由少量胶原纤维细胞组成,偶见纤维母细胞; Ⅱ级: 试样周围形成囊腔结构,主要由纤维母细胞、胶原纤维和少量纤维细胞组成; Ⅲ级: 试样周围形成疏松的囊腔,可见毛细血管和纤维母细胞.
3 结果
3. 1 肉眼观察
植入后 1、3、5 d 观察植入点皮肤未见出血、红肿、试样排除等异常现象; 各植入周期试验动物术后状况良好,伤口无感染、化脓、坏死等现象.取材时可见材料周围肌肉颜色、质地正常.各时间点对照组材料无明显变化.1、4 周样品组外形无明显变化; 12 周时样品组外形无明显变化但轻度变弯、硬度减小; 26 周时样品组各材料体积减小显着、不到植入前的 1/2,硬度明显减小; 36 周时样品体积较26 周减小,一样品植入部位已无无肉眼可见的残留材料.
3. 2 组织病理学检查
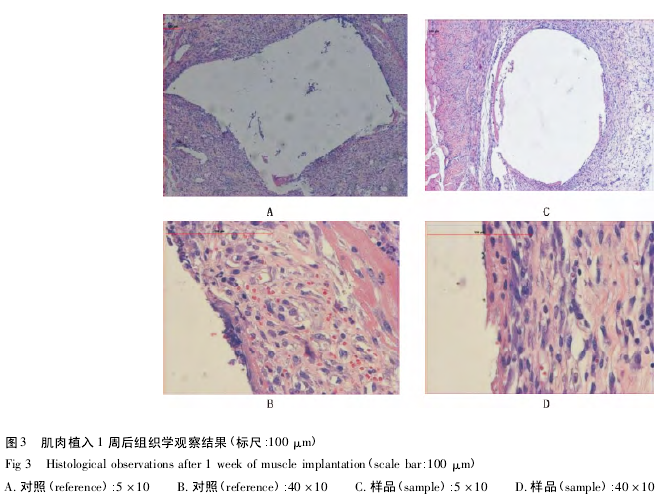
肌肉植入后 1 周( 图 3) : 样品组囊腔内偶见渗出的纤维细胞和淋巴细胞,囊腔由成纤维细胞、纤维细胞、淋巴细胞、吞噬细胞及血管内皮细胞共同包绕而成,四周结缔组织水肿; 偶见中性粒细胞,炎症波及四周的间隙; 肌肉有变性、坏死.对照组囊腔内偶见渗出的纤维细胞和淋巴细胞,囊腔为疏松的成纤维细胞,巨噬细胞,淋巴细胞和血管内皮细胞及水肿的结缔组织,四周肌肉有变性,坏死.偶见粒细胞浸润,个别切片已有较致密的成熟囊壁形成.
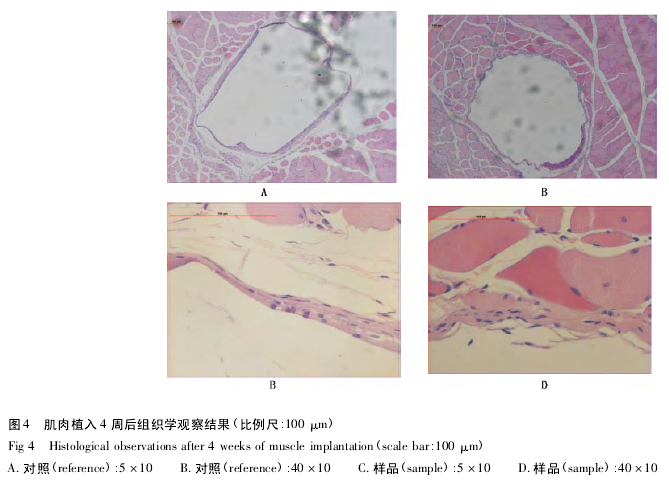
植入后 4 周( 图 4) : 样品组囊壁由致密的纤维细胞和胶原纤维细胞包绕而成,腔壁较厚,偶见淋巴细胞浸润.四周与肌束之间有脂肪结缔组织增生.对照组囊壁由致密胶原纤维和纤维细胞包绕而成,偶见少许淋巴细胞浸润,囊周可见脂肪结缔组织增生.
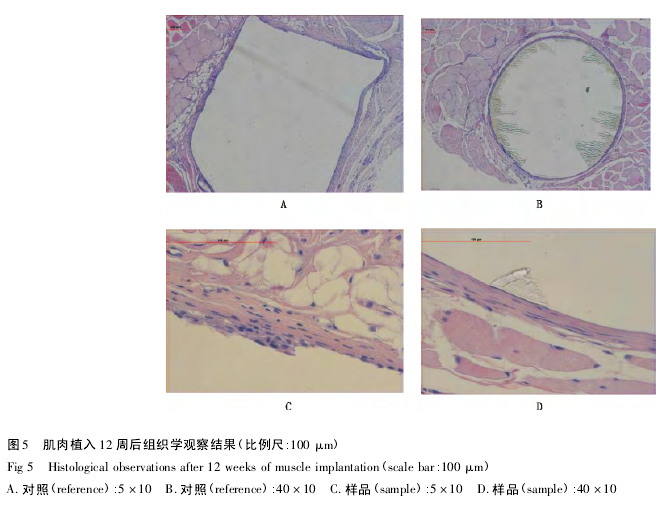
植入后 12 周( 图 5) ,样品组囊壁由致密胶原纤维和纤维细胞包绕而成,偶见淋巴细胞浸润,囊周可见脂肪结缔组织增生,与对照组组织学反应情况相似.
植入后 26 周( 图 6) ,样品组囊壁由致密成熟的纤维细胞和胶原纤维包绕而成,囊壁较厚,偶见几个淋巴细胞浸润,与对照组反应相似.
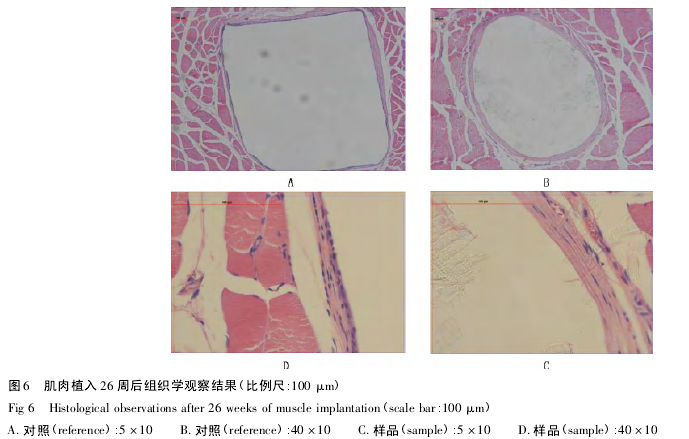
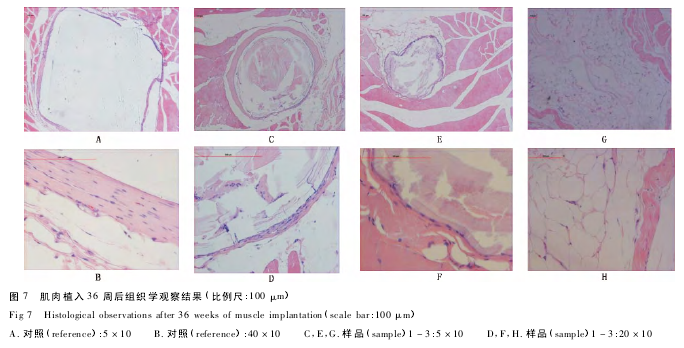
植入后 36 周( 图 7) ,对照组囊壁由致密成熟的纤维细胞和胶原纤维包绕而成,未见炎症细胞,与 26周反应相似.样品组囊壁由致密成熟的纤维细胞和胶原纤维包绕而成; 样品组 10 个样品中有 1 个出现脂肪组织侵入囊腔,未见炎症细胞现象( 样品 3) ; 其余样品囊周可见少量嗜中性粒细胞、多核异物巨细胞且囊周可见脂肪结缔组织增生( 如样品1,2) .
3. 3 组织反应分级
组织反应分级结果如表 1 所示.

4 讨论
PLGA 是目前临床上应用广泛的一可降解材料,在体内水解产物为乳酸和乙醇酸,均可代谢分解生成二氧化碳和水,通过肺、肾脏、尿液排出体外,体内没有蓄积现象.PLGA 的降解速度受其分子结构、乳酸和乙醇酸在共聚物中的组成比例、玻璃化温度、相对分子质量、应力环境等多种因素的影响,因此可根据临床上的不同用途开发相应的 PLGA 聚合物.目前 PLGA 已经用于细胞支架材料、药物控释系统材料、可吸收缝合线等,在临床上应用时间较长且显示了其较好的组织相容性与安全性[7 -9].
本研究中,PLGA 肌肉植入后植入 1、4、12、26周对照组与样品组组织学反应分级结果无差异.植入后 1 周,样品组与对照组均炎症反应明显且有肌肉组织的变性、坏死,炎症反应明显,可能是由手术刺激和机械压迫造成的.随着植入时间的延长,PL-GA 被纤维囊包裹,偶见淋巴细胞,其反应特征与其他种类的高分子材料引起的组织学变化相似,是机体对材料的正常反应[10].植入 36 周对照组与样品组纤维化程度无差异.对照组炎性反应程度与 26周时无差异; 样品组 10 个样品中有 1 个样品出现材料降解完全,未发现炎症细胞、囊腔被脂肪组织充满现象; 其余样品周围可见中性粒细胞、多核异物巨细胞,囊腔有缩小趋势.未降解完全材料周围中性粒细胞与多核异物巨细胞的出现可能是由于 PLGA 在此时间点降解速度较快、降解产物较多,降解产物不能被吞噬细胞及时吞噬而导致局部炎症反应.这一时间点未降解样品炎性反应分级为Ⅱ级; 降解完全样品炎性反应分级为Ⅰ级,与对照组无差异.
本研究对 PLGA 肌肉植入后材料周围的组织学反应进行了客观、合理的评价,结果显示该 PLGA 材料在整个降解周期内呈现出较好的组织相容性,为国产可吸收钉固定器在临床上的应用提供了有价值的依据.但是试验本身也有几点不足之处: 1. 本试验所用对照为美国药典高密度聚乙烯对照材料,是一不可降解材料,用其作为可降解材料的对照其实并不是特别合理.但是限于此可吸收钉固定器在国内首次注册,市面上没有同类产品,国外厂家同类产品原材料难以获得且国际上没有合适的对照材料,不得已选择此对照材料.2. 本试验时间点的设置未能覆盖所有 PLGA 样品完全降解的时间点.PLGA 螺钉具有良好的抗张强度、生物相容性和良好的降解性,对人体无毒、无积累.应用此螺钉进行软组织修复时,可避免金属残留体内和形成永久性疼痛点,同时降低损害神经的风险; 此外,还可防止瘘管和器官穿孔等术后并发症的出现.可吸收钉固定器本身的创新性设计更使修补过程更加安全、简便、快捷.因此,可吸收钉固定器在临床上逐渐发展.本试验结果显示该国产 PLGA 螺钉有较好的组织相容性,为其在临床上的推广提供了依据.
但是必须明确的是可吸收钉固定器虽然操作简便,但是螺钉进入软组织的深度依赖于装置本身的设计、补片的厚度和不同腹壁对螺钉的适用性.目前看来,可吸收钉固定器的效果可靠,但它毕竟在临床上应用时间不长,后续研究可能更应侧重于可吸收钉固定后的长期临床观察[11 -12].
参考文献
[1] Hollinsky C,Kolbe T,Walter I,et al. Tensile strength and adhe-sion formation of mesh fixation systems used in laparoscopic inci-sional hernia repair[J]. Surg Endosc,2010,24( 6) : 1318
[2] Lepere M,Benchetrit S,Bertrand JC,et al. Laparoscopic resorb-able mesh fixation. Assessment of an innovative disposable instru-ment delivering resorbable fixation devices: I - Clip TM[J]. Her-nia,2008,12( 2) : 177
[3] YANG Fu - quan( 杨福全) . The fixation of abdominal wall her-nia repair pathch( 腹壁疝修补术补片固定问题) [J]. Chin JPract Surg( 中国实用外科杂志) ,2008,28( 12) : 1019
[4] ISO 10993. 6 -2007,Biological Evaluation of Medical Devices -Part 6: Test for Local Effects After Implantation[S]. 2007: 12[5] GB/T14233. 2 - 2005,Test Method for Infusion,Transfusion,In-jection Equipment for Medical Use-Part 2: Biological Test Meth-od( 医用输血、输液、注射器具检验方法. 第 2 部分: 生物学试验方法) [S]. 2005: 11
[6] ASTM F1983,Standard Practice for Assessment of Compatibiltiy of Ab-sorbable / Resorbable Biomaterials for Implant Applications[S]. 2008: 1
[7] Makadia HK,Siegel SJ. Poly lactic - co - glycolic acid( PLGA) asbiodegradable controlled drug delivery carrier [J]. Polymers,2011,3( 3) : 1377
[8] Houchin ML,Topp EM. Physical properties of PLGA films duringpolymer degradation[J]. J Appl Polym Sci,2009,114( 5) : 2848
[9] HOU Li( 侯丽) ,WANG Xian - mei( 王贤美) ,LIU Yang( 刘阳) ,et al. Evaluation on biological safety of biodegradable poly-lactide( 可降解材料聚乳酸的生物安全性评价) [J]. J BiomedEng Res( 生物医学工程研究) ,2012,31( 4) : 250
[10] Anderson JM,Rodriguez A,Chang DT.Foreign body reaction to bioma-terials[C]/ / Seminars in Immunology. Academic Press,2008,20( 2):86
[11] Kang BC,Kang KS,Lee YS. Biocompatibility and long - term tox-icity of InnoPolimplant: a biodegradable polymer scaffold. ExpAnim,2005,54( 1) : 37
[12] El - Hayek K,Kroh M. Absorbable Fixation Materials: A CriticalAppraisal[M]/ / The SAGES Manual of Hernia Repair. NewYork: Springer,2013: 475