摘 要: 天然氨基酸基本都以发酵法获得,具有很大的营养价值,但不具有医药价值。生产天然氨基酸的现有发酵工艺已经较为成熟,但随着新型药物的研发,来自非天然氨基酸的手性药物在医药领域的使用量越来越大。因此,研究非天然氨基酸的合成有着重大的意义。基于此,介绍非天然氨基酸合成的方法和发展历程,为非天然氨基酸的合成及应用提供一定的依据和基础。
关键词: 非天然氨基酸; 手性药物; 合成工艺;
Abstract: Natural amino acids are obtained by fermentation and have great nutritional value, but not medicinal value. The existing fermentation technology for producing natural amino acids has been relatively mature, but with the development of new drugs, the use of chiral drugs from non-natural amino acids is increasing in the medical field. Therefore, it is of great significance to study the synthesis of non-natural amino acids. Based on this, the methods and development of the synthesis of non-natural amino acids were introduced, which provided a basis for the synthesis and application of non-natural amino acids.
Keyword: Non-natural amino acids; Chiral drugs; Synthesis processes;
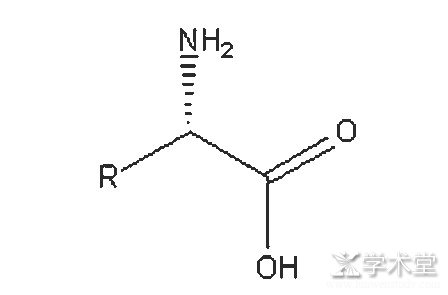
非天然氨基酸是指自然界无法直接获得的一类非蛋白光学性氨基酸。这类氨基酸通常无法通过发酵获得,只能通过化学合成或者构建工程菌发酵产酶,进行酶催化合成。合成工艺在日本起步较早,而中国是在20世纪90年代才开始研究开发。早期的非天然氨基酸大部分以进口为主,价格较高,例如在2004年前后,D-半胱氨酸盐酸盐,D-色氨酸,D-苯丙氨酸等系列非天然氨基酸的价格都在3 000~5 000元/kg不等。随后,国内公司逐渐开始了非天然氨基酸的合成研发,比较早实现工业化的国内公司有南京红杉生科技有限公司、上海瀚鸿化工科技有限公司、湖南福来格生物技术科技有限公司以及洛阳华荣生物科技有限公司等。随着技术的进步,国内合成非天然氨基酸的技术水平得到了很大的提高,成本和价格均大幅下降,目前非天然氨基酸的价格基本都维持在在1 000元/kg以内,甚至一些技术已经领先日本等国家。非天然氨基酸的结构通式如图1所示。
在该通式中,R基团代表烷基、芳香基等各种取代基团,构成了具有特殊手性中心的手性化合物。这个结构上的羧基又可以通过不同的方式进行还原、酯化等保护,形成不同的手性化合物。氨基也可以进行叔丁氧羰基(Boc)、苄氧羰基(Cbz)以及笏甲氧羰基(Fmoc)等各种基团的保护,形成手性化合物进入手性药物的侧链。传统手性药物的手性中心,大部分通过不对称催化或者拆分实现,这种方法效率和手性纯度不高,极大地限制了手性药物的发展。所以解决非天然氨基酸的合成问题对手性药物的发展具有重要意义。
图1 非天然氨基酸的结构通式
1、 非天然氨基酸性质及功能
1.1、 非天然氨基酸性质
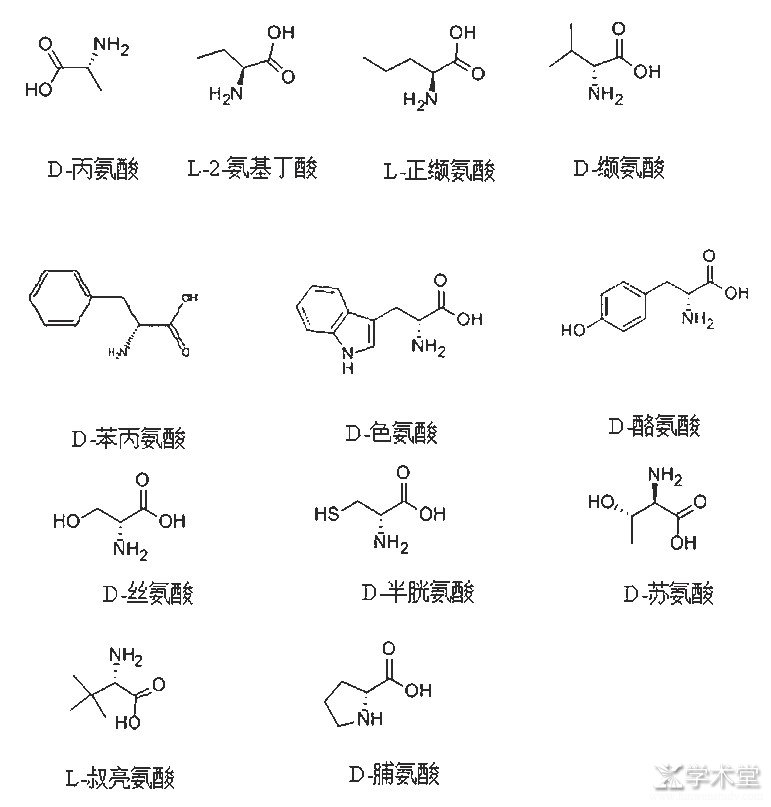
非天然氨基酸和天然氨基酸的结构相似,只是手性方向不同,大部分水溶性较好,熔点较高,一般都在200℃以上,游离状态比较稳定,以内盐形式存在。非天然氨基酸都有氨基和羧基,且比较活泼,在后期的基团转变中有着较大的天然优势。比较常见且用途广泛的非天然氨基酸如图2所示。
图2 常见的非天然氨基酸及其结构式
1.2、 非天然氨基酸功能
图2中各种非天然氨基酸在医药领域用途广泛,具体功能如下。
D-丙氨酸可以合成D-丙氨醇,向下合成R-3-甲基吗啉[1],成为阿尔兹海默症药物的中间体。
L-2-氨基丁酸可以合成L-2-氨基丁酰胺盐酸盐,是合成左乙拉西坦的关键中间体[2]。左乙拉西坦是比利时优时比制药公司(UCB)研发的具有全新抗癫痫机制药物,属于吡咯烷酮类西坦类,是神经系统主要用药系列之一,具有不良反应较少且轻、耐受性好等优点;主要用于成人以及4岁以上儿童癫痫患者部分性发作的治疗;此外,还具有一定的抗炎、镇痛和抗抑郁等作用。
L-正缬氨酸是合成培哚普利的主要中间体[3],培哚普利(Perindopril)为第三代血管紧张素转换酶抑制剂,服后6 h降压效果最好,作用持续时间长。培垛普利可扩张大、小动脉,减少血容量,降低系统血管阻力、左室充盈压和肺毛细血管楔压,增加心排血量和每搏输出量,增加心脏指数而不改变心率,提高患者运动耐量,减轻左室心肌肥厚,改善血流动力学。本品耐受性好,不会引起高血糖,对血脂亦无不良影响。培哚普利服后对血管紧张素转换酶(ACE)的抑制较其他抑制剂起效慢,但对ACE的抑制率达90%以上。
D-缬氨酸是盐酸沃尼妙林的中间体[4],沃尼妙林(Valnemulin,VA)是新一代广谱的截短侧耳素类半合成抗生素,属二萜烯类,是动物专用抗生素。
D-苯丙氨酸是合成那格列奈的中间体[5],那格列奈(Nateglinide)为硬胶囊剂,内容物为类白色,是D-苯丙氨酸衍生物,属于非磺酰脲类降血糖药。其作用机理主要为通过与胰岛B细胞上磺酰脲受体相结合,阻滞胰岛细胞ATP敏感钾通道的开放,导致细胞膜去极化,引起钙通道开放,促进胰岛素分泌。那格列奈是一种新型餐时血糖调节剂,能有效控制餐后血糖水平,具有起效快、作用时间短、引起心血管副作用和低血糖发生率低等特点。
D-色氨酸是合成他达那非的主要中间体,他达那非可以治疗男性勃起功能障碍(ED)。作用原理和西地那非、伐地那非相同,都是依靠磷酸二酯酶抑制剂(PDE-5)通过抑制环磷鸟苷(cGMP)的分解来提高NO的血管扩张作用,使ED病人重新获得阴茎勃起的能力,他达那非服用后通过肠胃吸收。
D-酪氨酸是抗心衰药物沙库必曲的关键中间体[6],entresto是结合sacubitril,一脑啡肽酶抑制剂,和缬沙坦,血管紧张素Ⅱ受体阻断剂,以减少风险心力衰竭患者的心血管死亡及住院治疗慢性心力衰竭(NYHAII-IV级)和射血分数降低。
D-丝氨酸是拉科酰胺的中间体[7],拉科酰胺是治疗癫痫和神经性疼痛的药物。
D-半胱氨酸是合成头孢米诺钠的中间体[8],头孢米诺钠,别名美士灵、Cefminox、meicilin,为头霉素衍生物,由半合成法制取,其作用性质与第三代头孢菌素相近,制成品为七水合物。常用其钠盐,为白色或微黄白色结晶性粉末,溶于水,其作用性质与第三代头孢菌素相近。
D-苏氨酸是合成头孢拉宗的中间体。头孢拉宗(Cefbuperazone)是一种固体化学品,别名头孢布宗、头孢羟哌嗪钠、乙氧哌甲氧头孢菌素、克波阿宗、头孢布哌拉唑、Cefobutazine、Keiperazon、Tomiporan、BMY-25182。分子式为C22H29N9O9S2,分子量627.651,熔点118~120℃。临床上用于大肠杆菌、沙雷菌属、普通及奇异变形菌、流感嗜血菌、肺炎球菌等敏感菌引起的败血病、慢性支气管炎、肺炎、肺化脓性疾病、心内膜炎、胆囊炎、腹膜炎、膀胱炎等。
L-叔亮氨酸是合成抗病毒药物阿扎那韦的关键侧链[9],阿扎那韦以商品名Reyataz销售的阿扎那韦是蛋白酶抑制剂(PI)类的抗逆转录病毒药物。与其他抗逆转录病毒一样,可用于治疗人类免疫缺陷病毒(HIV)的感染。阿扎那韦与其他PI的区别在于,可以每天给予1次(而不是每天需要多次剂量),且对患者的脂质分布(血液中胆固醇和其他脂肪物质的量)具有较小的影响。与其他蛋白酶抑制剂一样,阿扎那韦仅与其他HIV药物组合使用。美国食品和药物管理局(FDA)于2003年6月20日批准阿扎那韦,这是被批准用于每日1次给药的第1个PI,且引起脂肪营养不良和胆固醇升高等副作用的可能性较小,可以不与其他PI交叉耐药。当用利托那韦加强时,会降低阿扎那韦的代谢优势,但其与洛匹那韦的效力等效,可以用于具有一定程度耐药性患者的补救治疗,是世界卫生组织基本药物清单上和基本卫生系统所需的重要药物之一。
D-脯氨酸是合成依来曲普坦的中间体[10],依来曲普坦可用于治疗偏头疼,该药物原研发自美国Pfizer公司,在2001年上市。
2、 非天然氨基酸的合成方法
2.1、 化学拆分剂拆分法
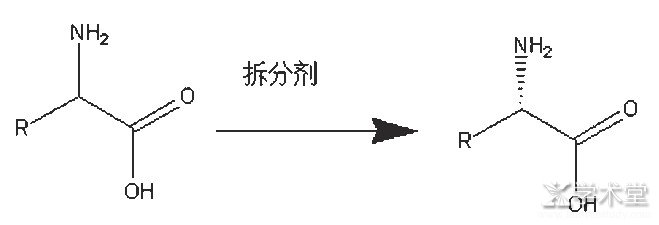
如图3所示,以混旋的DL-非天然氨基酸为底物,用酒石酸、DBTA、樟脑磺酸、扁桃酸等手性拆分剂进行拆分分离[11]。这种拆分剂化学拆分会有天然的弊病,拆分效率只能达到50%,对工艺结晶条件比较苛刻,控制不好,手性容易超标,达到99%以上的手性纯度相对比较困难。
图3 化学拆分剂拆分机理
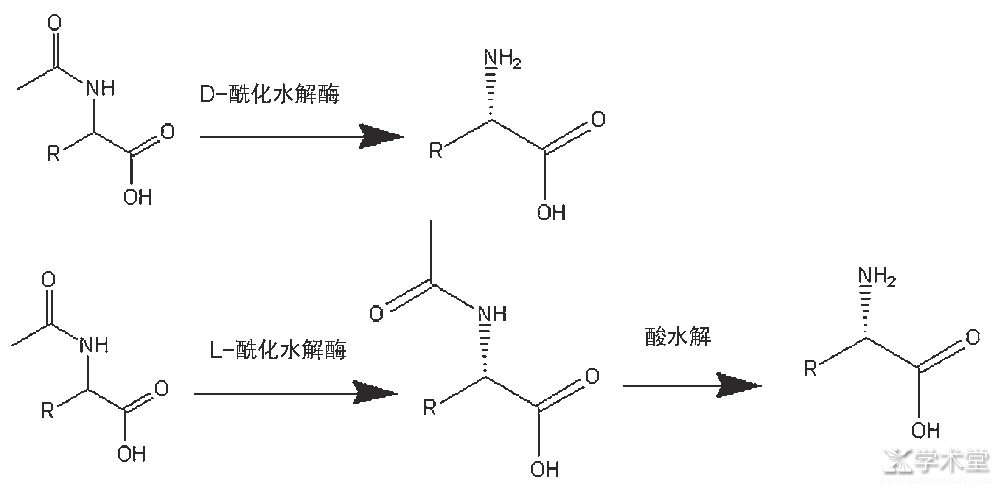
2.2、 酰化水解酶拆分
如图4所示,以N-乙酰-DL-氨基酸为底物,用L-酰化水解酶或者D-酰化水解酶[12]通过化学手段水解或者分离得到非天然氨基酸。酰化水解酶拆分氨基酸中,D-酰化水解酶普遍性不好,很多非天然氨基酸只能用L-酰化水解酶,而L-酰化水解酶需要再通过化学手段酸解来实现D-氨基酸的合成,酸解时对氨基酸会造成破坏,导致整体收率不高,因此工业价值越来越低。
图4 酰化水解酶拆分机理
2.3 、不对称转化法
如图5所示,不对称转化法是以单一构型氨基酸为原料,以有机酸为溶剂,醛类为消旋剂,添加手性拆分剂,通过溶解度差异形成动态拆分的过程[13]。该方法目前在工业中应用较多,但是非天然氨基酸是大类产品,每个产品复盐的溶解度不尽相同,所以在特殊的产品上也无法应用。
图5 不对称转化法动态拆分机理
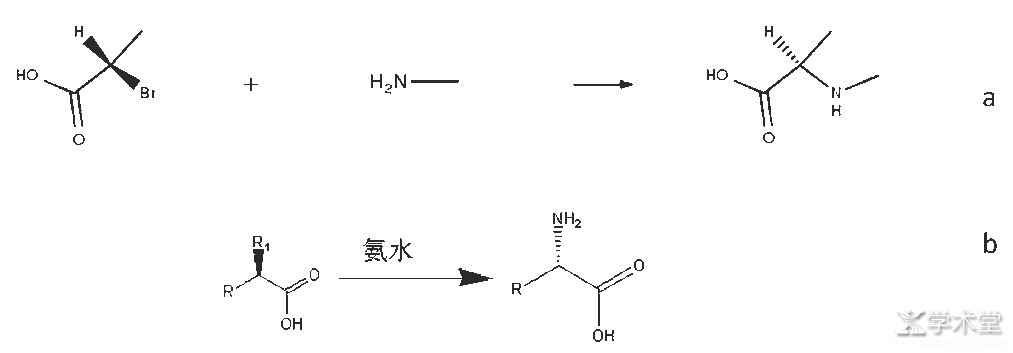
2.4、 化学合成
如图6所示,化学合成是以一个手性化合物为底物,采用化学手段进行合成[14]。R1可以是卤素系列(图6b),这个路线也只能针对少数产品的合成,因为手性前体比较难获得,导致这个路线不能大规模应用,而且在氨化过程中存在手性翻转,得到的手性氨基酸容易出现手性纯度不够。
图6 化学拆分剂拆分机理
2.5、 脱氢酶法
脱氢酶法是通过酮底物利用转氨酶或氨基酸脱氢酶,提供合适的氨供体,加入辅酶NAD,进行酶催化得到手性非天然氨基酸,L-氨基丁酸[15]和L-叔亮氨酸[16]的合成都是用该方法合成。
2.6、 海因法
海因法最早应用在对羟基苯甘氨酸的合成上,包括合成氨基酸海因前体,韦萍[17]通过海因酶和氨甲酰水解酶的共同作用,实现了非天然氨基酸的合成,并提出了氨基酸海因自发消旋的动力学原理。随后,南京红杉生物科技有限公司等也开始研究海因法合成氨基酸。海因法合成氨基酸的原理如图7所示。
海因法比较好地实现了非天然氨基酸的合成,收率和转化率都达到了比较高的水平,每个取代海因的性质不同,海因底物的自发消旋的动力也不尽相同,而海因酶的温度耐受度是有限的,这也就导致了海因酶法无法实现个别氨基酸转化水解的合成目的。因此,有学者研究了海因消旋酶,完整地解决了海因法合成非天然氨基酸的难题[18]。
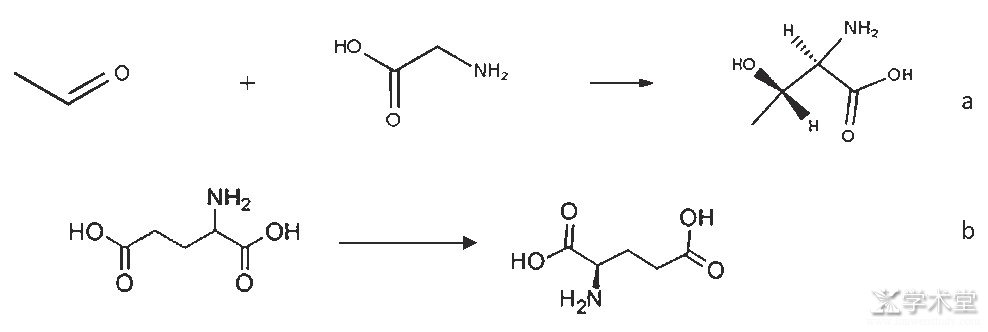
2.7、 诱导拆分法
如图7所示,以混旋的非天然氨基酸为底物,通过过饱和溶液,加入晶种,控制降温速度和搅拌速度,缓慢结晶,通过溶解度差异,达到拆分分离的过程。母液可以重复套用,富集到一定程度则不能再使用,可浓缩结晶回收另外一半非天然氨基酸。D-谷氨酸[19]和D-苏氨酸[20]就是用这种方式合成获得。
图7 诱导拆分法机理
2.8 、氧化酶法
氧化酶法是以混旋的非天然氨基酸为底物,通过工程菌氨基酸氧化酶,根据需要把L-氨基酸或D-氨基酸氧化为酮酸,保留需要的L-氨基酸或D-氨基酸,从来获得需要的手性非天然氨基酸产物[21]。
3 、结论与讨论
合成非天然氨基酸的方法还有很多种,包括膜分离方法、电泳法、层析法等。这些方法无法满足现有工业化条件,意义不大。文中详细论述的几种路线都是可以工业化的路线,也是非天然氨基酸发展史上使用过的方法,其中在工业生产中主要采用不对称转化法、脱氢酶法和海因法3种方法,其他方法因成本问题或拆分弊端而无法实现高手性纯度非天然氨基酸的合成。其中不对称转化法是化学法合成的典型特例,脱氢酶法和海因法是合成非天然氨基酸的生物方法典型特例。
随着社会的发展和环保意识的加强,化学法的压力越来越大,未来生物法合成非天然氨基酸必然取代化学法,而生物法要想长久发展,也需要减少排放和发酵体量,降低COD的处理难度。因此,应将固定化酶生物转化作为现有基础上新的研究方向,或者获得更高效率的工程菌来减少酶的用量。
非天然氨基酸作为非蛋白氨基酸,发展较晚,在人体内也并未发现,前期重视不够,国内合成非天然氨基酸的起步也较晚。但是随着手性药物的发展,研究人员也越来越重视非天然氨基酸的合成。分子生物学的突飞猛进,使得人类基因组计划、定向进化、合成生物学等各学科得到了发展,为非天然氨基酸的合成奠定了强有力的基础。目前,国内非天然氨基酸的市场缺口还很大,随着技术的进步,这类手性氨基酸必将在医药、食品等行业发挥巨大的作用。
参考文献
[1]LLISON B D, HACK M D, PHUONG V K, et al.QUINOXALINE COM POUNDS:US20070950326[P].2008-03-27.
[2]李雷,叶荣魁,张辉.左乙拉西坦的合成工艺研究[J].辽宁化工,2014(9):1134-1135.
[3]钱超.培哚普利及其中间体的合成工艺研究[D].杭州:浙江大学,2006.
[4]付江涛.盐酸沃尼妙林合成及纯化工艺研究[D].石家庄:河北科技大学,2013.
[5]陈文斌,苏小琴,王涛,等.一种那格列奈的合成方法[J].山东化工,2015,44(17):25-26.
[6]Ksander G M, Ghai R D, DeJesus R, et al. Dicarboxylic Acid Dipeptide Neutral Endopeptidase Inhibitors[J].Journal of Medicinal Chemistry,38(10):1689-1700.
[7]纪忠兆,王桂艳.拉科酰胺的合成工艺改进[J].广东化工,2018,45(8):31-32.
[8]周自金,黄军豪,张群芳,等.一种头孢米诺钠的合成方法[P].CN104031070A,2014-09-10.
[9]白跃飞,刘举,周宏,等.HIV蛋白酶抑制剂硫酸阿扎那韦的原料药合成研究进展[J].中国新药杂志,2018(7):767-780.
[10]杨叶伟,张萍,王尊元,等.依来曲普坦的合成工艺改进[J].中国药物化学杂志,2013(5):49-52.
[11]胡建强,黄志平,李晶.氨基酸手性拆分研究进展[J].食品与药品,2012,14(1):60-64.
[12] 张和平,李海滨,邱明建,等.手性D-苯丙氨酸的化学合成方法[P].CN102234241A,2011-11-09.
[13]周锡梁,梅亚红,兰荣华,等.D-半胱氨酸盐酸盐制备研究[J].氨基酸和生物资源,2007,29(1):39-41.
[14]H. Ley,Th. Temme.?ber optisch-aktive Innerkomplexsalze[J].Berichte der deutschen chemischen Gesellschaft(A and B Series),1926,59(11):2712-2719
[15]刘珊,李元,祝俊.偶联基于酮还原酶的NADH再生系统一锅法酶催化合成L-2-氨基丁酸[J].中国生物工程杂志,2017,37(1):64-70.
[16] 朱文骏.l-亮氨酸脱氢酶催化合成叔亮氨酸的研究[D].南京:南京工业大学,2016
[17]韦萍.D-氨基酸的制备研究[D].南京工业大学,2002.
[18]佘雪莲.芽孢杆菌MV0658海因氧化酶基因B的克隆及表达研究[D].成都四川师范大学,2009.
[19]Gil-Av E, Tishbee A, Hare P E. ChemInform Abstract:resolution of underivatized amino acids by reversed-phase chromatography[J].Journal of the American Chemical Society,1980,102(15):5115-5117.Gil-Av E, Tishbee A, Hare P E. ChemInform Abstract:resolution of underivatized amino acids by reversed-phase chromatography[J].Chemischer Informationsdienst,1980,11(43):5115–5117.
[20]Kimura T, Vassilev V P, Gwo-Jenn Shen A, et al. Enzymatic Synthesis ofβ-Hydroxy-α-amino Acids Based on Recombinant d-and l-Threonine Aldolases[J].Cheminform,1997,29(13):11734-11742.
[21]姚皖.基于氨基酸氧化酶的α-氨基酸的手性拆分[D].杭州:浙江大学,2012.