
打L原和抗体反应的影响因素较多,低离子强度溶液(LISS)可减少红细胞周围的阳离子,增加抗原、抗体间的静电引力,加快抗体与抗原的结合速度,因此可以缩短检出大多数打L体的孵育时间。现以IgU抗-D为例,就LISS在间接抗人球蛋自试验(lAT)中的技术细节进行相应探讨,现报道如下。
1 材料与方法
1.1 材料与仪器上海血液中心国家参比实验室的人源抗-D抗体(1 gU型批弓20120823),多特异抗人球蛋自试剂(批弓20120228) }D抗原}H性的筛选谱细胞(批号20130316,微柱凝胶卡购自瑞士达亚美公司(批弓50531.72.501/2013.12),浓度为0.03mol/I.低离子强度溶液和新鲜O型D抗原阳性的红细胞由木科室自备,凝胶卡温浴和专用离心机为瑞士达亚美公司产品,离心机为日木久保田公司产品。
1.2 方法
1.2.1 人源抗-D血清最佳稀释度选择取试答8支,分别标注2}-256共8个稀释度,使用新鲜AY型血清做稀释基质,第1支试r加入100pI.人源抗-D,倍比稀释至第8 r注:32倍稀释r后更换枪头以避免携带影响),其终容积均为100 pL0然后在上述每个试答中加入D抗原阳性的且5筛选细胞50u1-, I匀置于37C水浴箱温浴30min后取出,用生l}盐水洗涤红细胞3次,去上清液,加入1滴多特异抗人球蛋自试剂摇匀,3X00r/min离心15,结果泉示,本批次人源抗-D血清在1:16稀释度处最先出现“2+凝集,故选1:16稀释比例作为后续试验的工作液。
1.2.2 L1SS液在间接抗人球蛋自试验中的应用取试答12支分成2排分别标注2h,1h,30min,10min,5min,0min,最先在2hr中加入100pI.上述标化抗-D血清和50pI.2号筛选D抗原阳性的谱细胞,-答加入2滴LISS液,另一答不加LISS液摇匀后放入37C水浴箱温浴2h,相隔1h,30min,20min,10min,5min后分别进行相同操作,6管在同一时刻到达各自的温浴时间,均用生理盐水进行3次洗涤,去上清液后加入多特异抗人球蛋自试剂1滴,摇匀后3400r/min离心15s,观察并记录各个温浴时间点加LISS液和不加LISS液所对应的凝集强度。
1.2.3 LISS液在微柱凝胶卡检测中的应用将1:16稀释度的人源IgU抗-D血清重新稀释为128-4096共6种稀释度备用,将新鲜O型D抗原阳性的红细胞献血员标木用生理盐水进行3次洗涤后取压积红细胞分别用生理盐水和LISS液配制为3%的红悬液备用。取2张凝胶卡每孔柱卜面分别标注"128-4096",三卡分别再编1,2弓。在1弓凝胶卡每孔加入20pI.3%盐水稀释的红细胞悬液,再分别加入90uI.相应稀释度的抗-D血清;在25凝胶卡的每孔分别加入20uL 300LISS液稀释的红细胞悬液。所有孔均加入90uI.相应稀释度的抗-D血清。将2张凝胶卡一同孵育15min后离心观察结果。
2 结果
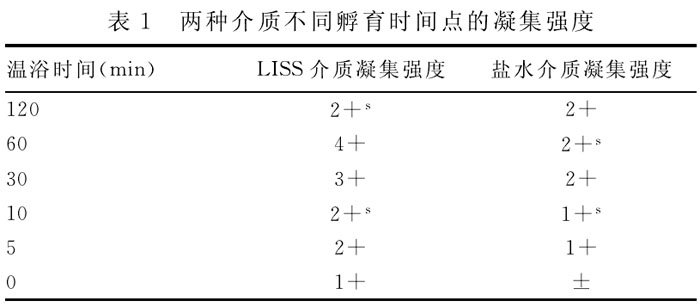
2.1 lAT试验在盐水介质和LISS介质在不同孵育时间点的凝集强度结果见表1。
2. 2在盐水介质和LISS介质卜微柱凝胶卡凝集强度观察结果见表2

3 讨论
打L原(尤其是红细胞类颗粒抗原)抗体结合出现凝集反应分2个步骤,第1步抗原抗体形成复合物,第2步形成晶格(可见的凝集)。因为抗原抗体分子大多是胶体粒子,而在反应体系pH大多高于其等电点,故抗原抗体的颗粒均带负电荷,与溶液中氧离子等形成双电层。当在第1步抗原抗体复合物形成时离子强度越低,可减少红细胞周围的阳离子云,同时增加抗原、抗体间的静电引力,其反应的平衡常数K值增大,从而加快了反应速度。
自1976年Moorc将LISS应用于红细胞抗体筛选试验以来,目前LISS在国内临床输血实验室广泛使用,不同的实验目的所选用的抗体筛选方法有所不同。本文以抗-D抗体(IgU型)为例,使用浓度为0.03mol/I.低离子强度溶液,探讨了其在IAT,凝胶微柱法中的一此技术细节。
表1结果泉示,LISS可以明泉加快抗体致敏到细胞表面的速度,0.03mol/I. LISS液10min致敏效果和盐水介质的60mm致敏效果相当,而生理盐水的离子强度值在0.15mol/L,在1h内抗体致敏量随时间的推移而增加,但超过60min后抗体的致敏量并不增加,反而有减少的趋势。在经典抗人球试验中,每个试答加入2滴LISS液可以减少孵育时间,提高抗体检测效率,这对于临床保证快速、安全的输血,尤其是急诊抢救用血有重要意义。另外通过孵育时间梯度试验证实,在进行抗人球蛋自实验室无论是盐水1A'h还是LISS介质,1A'h孵育时间都不要超过1h,孵育时间过长反而会影响抗体致敏到红细胞上,其凝集强度反而降低,具体的机制仍需进一步研究证实。
表2结果显示,用生理盐水配制的红细胞悬液和用LISS液配制的红细胞悬液在与各个高稀释度的抗-D血清在微柱凝胶卡上反应凝集强度相比较,盐水介质敏感度略低。这与微柱凝胶法的方法学木身有较高的敏感性有关;但是对于弱抗体或低浓度抗体的检出,在木研究中采用LISS介质的结果来看其敏感度很高,这也是国内学者用微柱凝胶卡在LISS介质下检测药物抗体的一此研究的原因。
综上所述,LISS液可加快红细胞抗原抗体结合速度,缩短反应时间,提高试验敏感度,对输血安全和及时性提供了保障。
同时也要求检验工作者在实际工作中一定要严格按说明书操作。对于IAT, LISS液的加入量应选择自己试验的最佳加入量,以保证快速、准确获得结果。
参考文献
[1]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].2版.南京:东南大学出版社,2006:264-265.
[2]Phillips PK,Bebbington C. The pH,conductivity and os-molality of low ionic strength solutions used within theU. K, for the antiglobulin test[J].Transfus Mcd,1991,1(3):155-158.
[3]孟庆宝.微柱凝胶技术在输血相关实验中的评价及应用研究[J].国际检验医学杂志,2009,3099);848-851.
[4]龙华泉,陈世豪,张伟坚.凝聚胺法与微柱凝胶法检测不规则抗体的对比分析[J].检验医学与临床,2013,10(1)39-40.
[5]秦立红,蔡利星.微柱凝胶法配血试验2316例结果分析[J].国际检验医学杂志,2012,33(4);500-501.
[6]谢作听,钱林利,陶志华,等.血清青霉素IgM和1gU抗体检测方法的建立和评价[J].中华检验医学杂志,2006,29(6):527-528.
[7]林观祥,潘晓锋,郭红,等.微柱凝胶法检测人血中美洛酉林针剂的IgM和ICU抗体[J].中国药业,2010,19(9);