摘 要: 基因组不稳定 (genomic instability) 是机体衰老的标志之一, 也是儿童早老症 (HutchinsonGilford progeria syndrome, HGPS) 患者细胞的典型特征。HGPS的发生与早老素 (progerin) 堆积密切相关, 但早老素如何引起基因组不稳定尚缺乏系统性的阐述。基因组的结构稳定与DNA的正确复制、DNA损伤修复、端粒的维持和稳定以及表观遗传学修饰密切相关。本文主要讨论早老素在改变正常核纤层结构的基础上, 通过影响相关通路关键蛋白质的水平或者定位, 引起细胞内氧化应激增强、DNA复制应激和DNA损伤修复障碍, 细胞DNA损伤增多和端粒的加速缩短, 并在改变组蛋白甲基化和乙酰化方面导致基因组不稳定的机制。
关键词: 早老素; DNA损伤修复; 基因组不稳定; 端粒; 表观遗传;
Abstract: Genomic instability is one of hallmarks of aging and the typical characteristics of HutchinsonGilford progeria syndrome ( HGPS) cells. HGPS is the result of progerin accumulation. However, there is a lack of systematic explanation on how progerin causes genomic instability. The stability of genomic structure is closely related with correct DNA replication, DNA damage repair, telomere maintenance and stability, and histone epigenetic modification. This review mainly discusses the mechanism by which progerin, on the basis of structure aberration of nucleus lamina, causes intracellular oxidative stress, cellular DNA replication stress, DNA damage repair disorder, and increases cell DNA damage, telomere shortening, and dysregulation of histone methylation and acetylation, to induce genome instability by affecting the level or localization of key proteins in related pathways.
Keyword: progerin; DNA damage repair; genomic instability; telomere; epigenetics;
细胞或者机体的衰老是一个渐进性的过程,也是机体有害物质累积的过程。损伤的DNA即是有害物质之一,累积到一定程度会引起系统功能紊乱,最终导致死亡[1]。在长期的进化过程中,生物体拥有了一套成熟的DNA损伤检测体系,以及针对不同损伤类型的DNA修复方式,以维持遗传信息的完整性和稳定性。如能正确修复,细胞DNA结构和功能即能恢复正常,细胞得以维持正常状态;若损伤的DNA不完全修复或者无法修复时,DNA发生突变,染色体畸形,可诱导细胞出现功能改变,这与一些衰老相关疾病的发生有密切联系[2]。儿童早老症 (Hutchinson-Gilford progeria syndrome, HGPS) 是由早老素 (progerin) 的累积而引发的早衰疾病,并且与正常的衰老有许多相似之处,是研究人类衰老的理想模型。在HGPS患者的成纤维细胞中,发现有线粒体功能紊乱、氧化应激增强、代谢途径改变和衰老相关通路的激活等方面的变化,以及DNA双链断裂 (DNA double-strand breaks, DSBs) 的累积、端粒加速缩短、组蛋白表观遗传改变等基因组不稳定的现象。本文主要讨论早老素引起基因组不稳定的相关机制 (见Fig.1) 。
1、 早老素的形成及核纤层结构改变
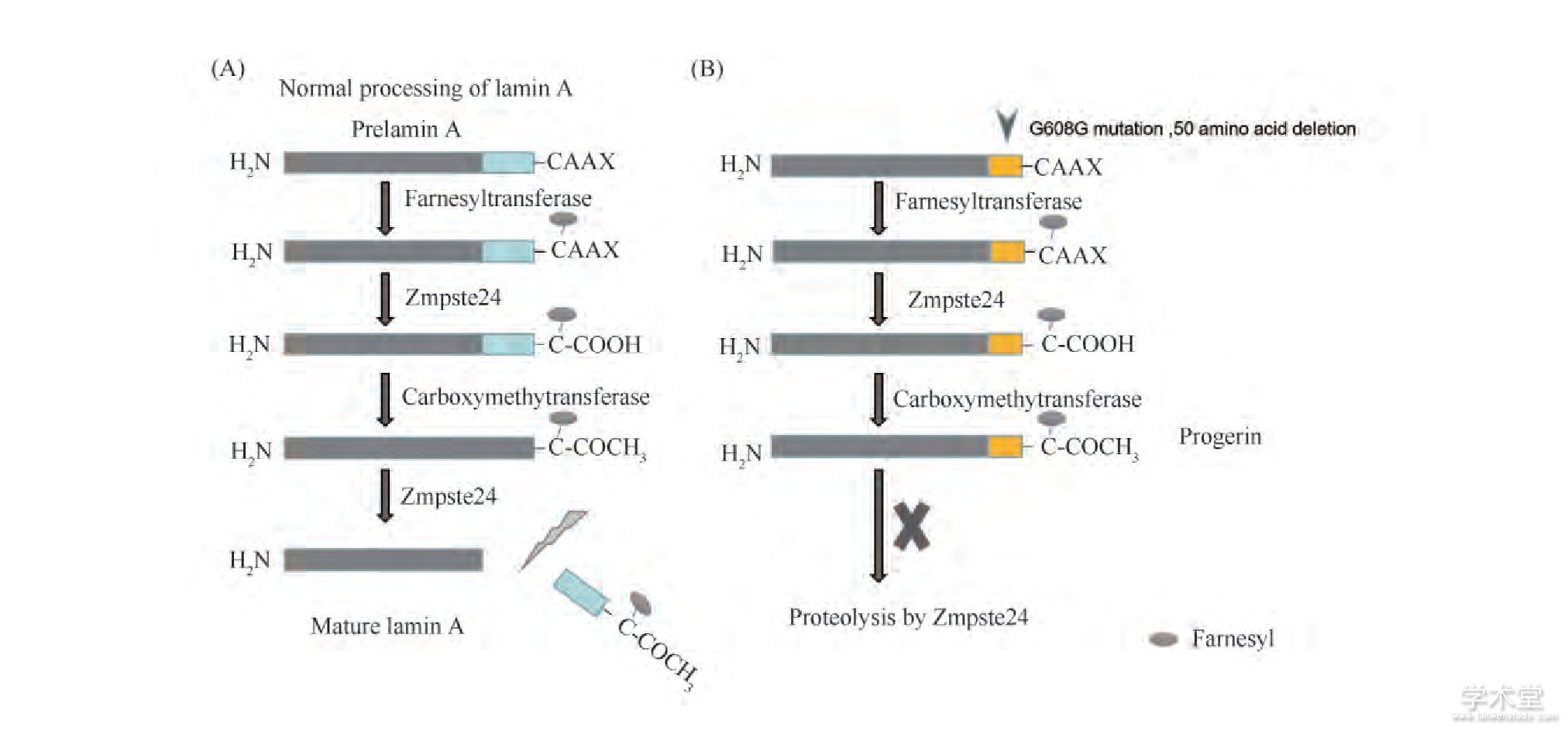
核膜为内核膜和细胞质提供了动态的边界。核膜功能以及细胞核的形态又与核纤层密切相关。核纤层位于内层核膜与染色质之间,对于真核细胞的正常功能至关重要。核纤层蛋白是核纤层的组成成分,在核内与核基质相连,在核外与中等纤维相连,有力地支撑着细胞核和染色质的形态[3,4]。核纤层蛋白与核膜、染色质以及核孔复合体在结构和功能上有密切关系,涉及DNA复制、RNA转录、细胞核的构建、核孔的装配、染色质的功能、细胞周期和凋亡等方面[5,6]。在哺乳动物中,核纤层蛋白分为两种类型:A型核纤层蛋白 (包括lamin A, lamin C, lamin C2及lamin AΔ10) 和B型核纤层蛋白 (包括lamin B1, lamin B2和lamin B3) 。A型核纤层蛋白由LMNA基因编码,lamin B1由LMNB1编码,lamin B2和lamin B3由LMNB2编码[7]。编码核纤层蛋白的基因发生突变导致一系列的细胞功能改变,统称为核纤层蛋白病。HGPS即是一种严重的核纤层蛋白病,表现出早衰特征。通常在出生后的第一年,HGPS患者开始显示身材矮小、体重较轻、脱发、脂肪萎缩、硬皮病、面部衰老和骨质疏松等一系列加速衰老的特征,平均寿命为13.5岁[8]。研究表明,HGPS患者出现早老素的累积。早老素是LMNA的第11个外显子点突变的产物,在LMNA基因第1 824位点碱基C突变成T,虽然这是一个同义突变G608G,但是它激活了mRNA水平上的一个隐蔽剪切位点,造成基因转录的mRNA被剪切了150个碱基 (见Fig.2) 。这150个碱基正好包含lamin A成熟过程中由Zmpste24介导的蛋白酶水解位点,由于丢失这个酶切位点,前体lamin A (prelamin A) 被修饰的法尼基团无法被切除而成为早老素,prelamin A不能成为成熟的lamin A。早老素的堆积及lamin A的缺乏,改变了核内核纤层的组成和形态,HGPS患者出现严重的核畸形。核纤层结构上的变化引起染色质功能异常,导致基因表达改变、基因组不稳定等一系列细胞功能的改变,进而引发早衰[9-11]。本文主要围绕早老素在复制应激、DNA损伤、端粒加速缩短、表观遗传改变等基因组稳定性方面的相关作用机制展开综述。

2、 早老素导致复制应激和DNA损伤增加
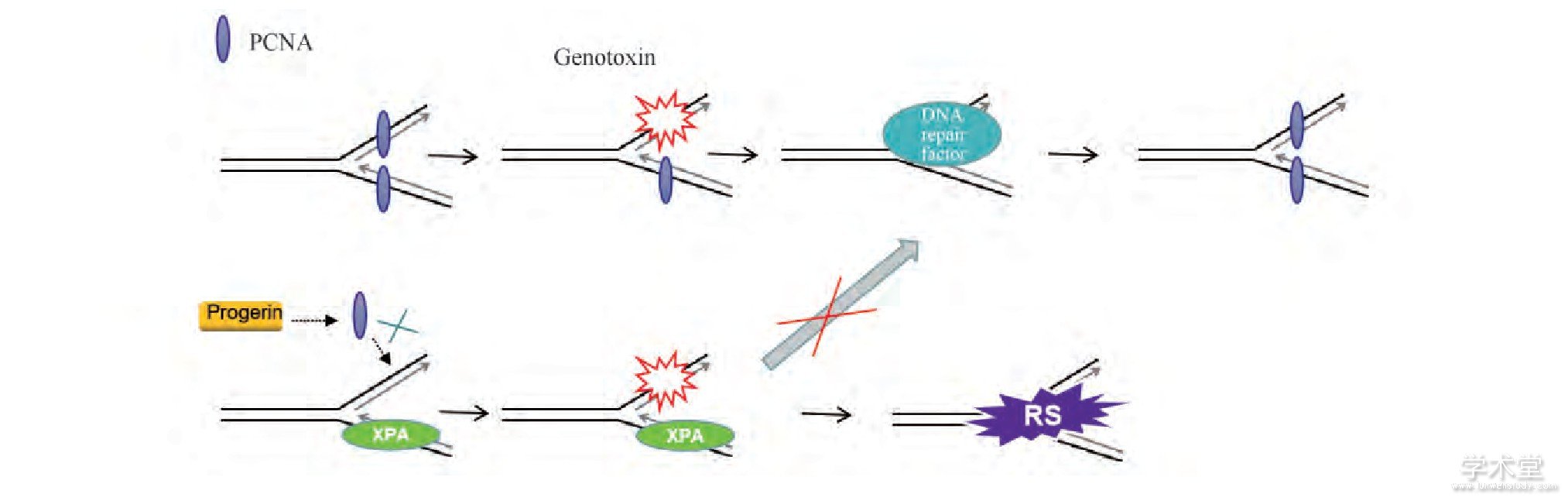
正常情况下,lamin A可以与增殖细胞核抗原 (proliferating cell nuclear antigen, PCNA) 相互作用,重新启动停滞的复制叉,从而共同维护DNA复制的正常进行[12]。PCNA是DNA复制过程中的滑动固定蛋白质,在复制叉处招募DNA聚合酶,并且可以加强DNA持续合成能力,它对正常的DNA复制、合成和延伸过程是必不可少的。在早老素存在的情况下,PCNA无法结合在复制叉上,破坏DNA复制的进程,导致复制叉的停滞和核酶介导的复制叉的降解,最终引起复制应激 (replication stress, RS) [13]。在分裂的细胞中,自发的DSBs主要来源于DNA复制,因此,早老素引发的复制应激可能是HGPS患者细胞中DNA损伤的主要原因[14]。此外,HGPS患者细胞代谢产生的基因毒素 (genotoxin) ,如线粒体氧化应激反应产生的活性氧自由基 (ROS) 等,也会造成DNA损伤的增多[2]。Kubben等发现,在HGPS患者的细胞中,有NRF2 (nuclear factor[erythroidderived 2]-like 2) 抗氧化通路的抑制[15]。NRF2参与调控NADPH生成的4个基因 (葡萄糖-6-磷酸脱氢酶、6-磷酸葡萄糖酸脱氢酶、苹果酸酶1和异柠檬酸脱氢酶1) 的表达,是促进抗氧化反应的关键因子[16]。早老素通过隔离NRF2使其核定位错误,导致NRF2转录活性受损,造成了HGPS细胞内长期的氧化应激。而在HGPS患者细胞中,重新激活NRF2减少了DNA损伤标志物γ-H2AX的水平[15]。
作为DNA损伤应答的一部分,多种DSBs修复蛋白质可以被招募到DSBs损伤部位进行修复。而在HGPS患者的细胞中,早老素破坏DSBs处对修复蛋白质的招募,从而无法修复受损的DNA。在Zmpste24-/-小鼠中,也发现类似的情况[17]。在早老素存在情况下,色素沉积皮肤干燥症A基因 (xeroderma pigmentosum group A, XPA) 错误定位于早老素引发的DNA双链断裂区域,阻挡了正常的修复蛋白质在DSBs部位的招募,损伤的DNA无法被修复,导致DNA双链断裂累积增加和细胞中早期复制的停滞[13] (见Fig.3) 。XPA是核酸切除修复 (nucleotide excision repair, NER) 中特异且必不可少的因子,它可以在核酸切除修复中识别DNA损伤,并且在核酸切除修复中核酶的招募和后续的稳定修复发挥重要的作用,但是它并不涉及DSBs的修复过程[18]。这样一来,XPA与DSBs的错误结合,导致正常的DSBs修复蛋白质无法被招募到DSBs处,同时又破坏了核酸切除修复的通路,致使在同样的外界条件的刺激下,HGPS患者的细胞对DNA损伤更加敏感。同时发现,在HGPS患者的细胞中,γ-H2AX和XPA共同定位于DNA复制蛋白质区域,暗示着DSBs的产生可能来自于停滞的或者坍塌的复制叉[13]。早老素引起复制应激以及氧化应激的增强,同时又破坏了细胞内正常的DNA损伤修复机制,加速了DNA损伤的产生。
Fig.1 Genomic instability caused by progerin
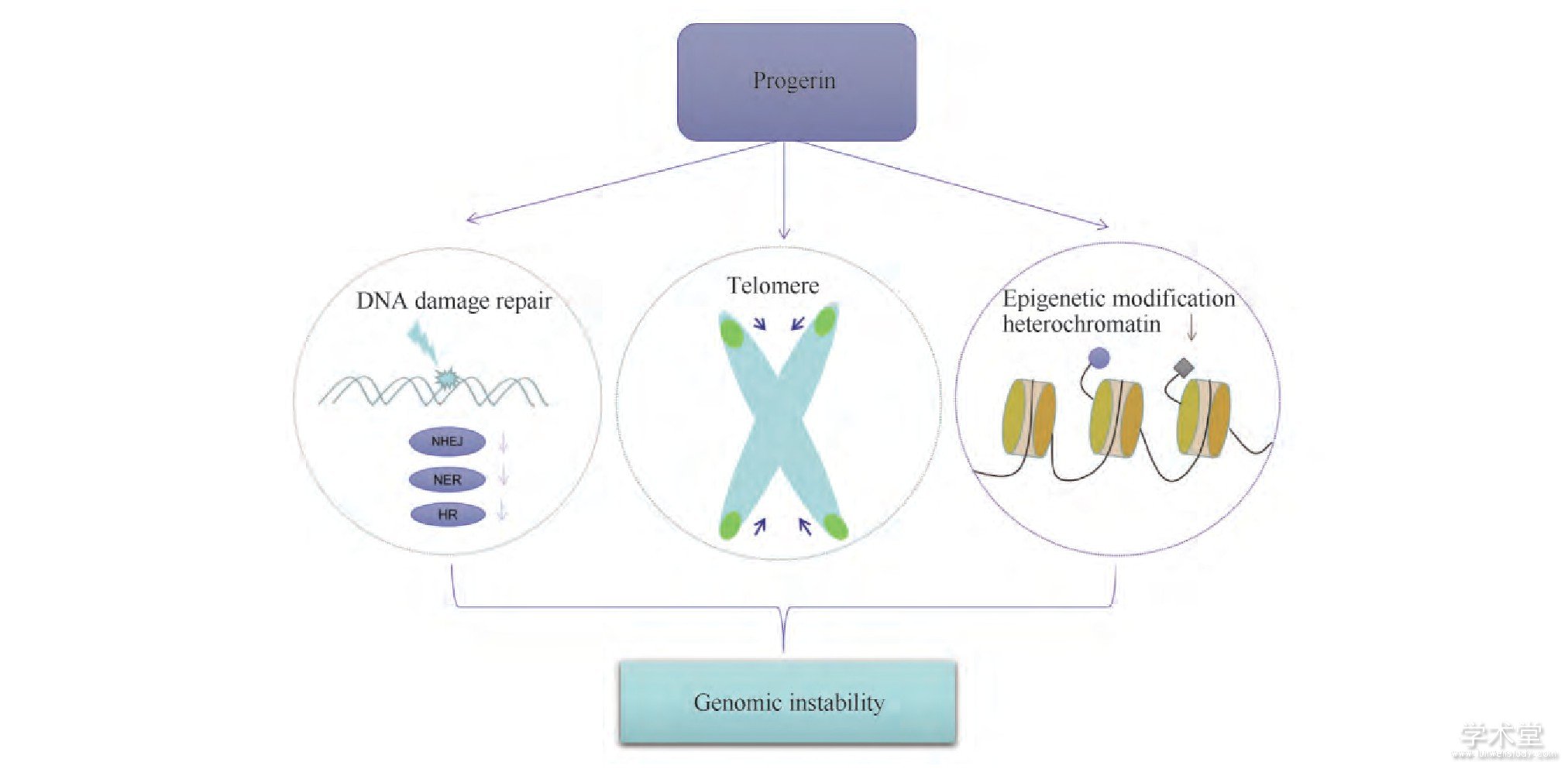
Fig.2Maturation of lamin A and formation of progerin or LAΔ50
最近,在哺乳动物中发现了一种核酸转移酶,它是新型的DNA感受器 (DNA sensor) 即cGAS (cGMP-AMP synthase) ,能产生内源性的cGAMP (cyclic dinucleotide 2'cyc-cyclic GMP-AMP) ,继而激活干扰素刺激基因 (stimulator of interferon genes, STING) 。STING是DNA感受通路的一个关键蛋白质,在免疫启动方面有重要意义,它也可以直接或间接识别dsDNA[19-22]。DNA损伤和复制应激不仅是导致衰老和癌症的基因组不稳定性的基础,而且还有助于激活炎症反应。在某些情况下,促进恶性肿瘤和其他衰老相关疾病[23]的发展。例如,早老素通过复制应激引起了细胞质中零散的核酸的积累,被模式识别受体 (pattern recognition receptors, PRRs) 错误地识别为外来物,激活了免疫应答。cGAS-STNG胞质的DNA检测途径对激活干扰素反应至关重要,并与肿瘤和衰老有关[24,25]。Kreienkamp等[26]对HGPS患者的细胞进行全基因组表达分析发现,细胞中有转录信号转导与激活剂1 (signal transducer and activator of transcription 1, STAT1) 介导的IFN样应答途径的强烈激活,以及超过40个STAT调节的干扰素刺激基因 (interferon stimulation genes, ISGs) 的上调,这些代表了强烈的干扰素样应答。早老素破坏DNA的复制过程,复制应激产生的DSBs和散落在胞质中的核苷酸,激活cGAS-STING胞质内DNA感受信号途径,进而激活STAT-1调节的干扰素样应答,导致细胞内固有免疫反应的发生,可能参与细胞功能缺陷和早老的表型。
Fig.3 A proposed model showing that DNA double-strand break repair activity is impaired in HGPS
STAT介导的对ISGs的调控,激活炎症的发生途径,引起如动脉粥样硬化等炎症性应答,猜测这一过程和早老症患者易死于冠状动脉硬化性心脏病有密切关系[27]。早老素引起复制应激和核酶介导的复制叉的降解,揭示在HGPS患者的细胞中DNA的损伤反应,复制应激伴随着cGAS-STNG途径的上调,以及激烈的由STAT调控的干扰素样应答的激活,这可能是早老素引起早衰的病因学之一[26]。
3、 早老素引发端粒加速缩短
端粒 (telomere) 是存在于真核细胞线状染色体末端的一小段DNA-蛋白质复合体,它与端粒蛋白复合体 (shelterin complex) 一起构成了特殊的“帽子”结构,作用是保持染色体的完整性和控制细胞分裂周期。端粒蛋白复合体包括端粒重复序列结合因子1 (telomeric repeat-binding factor 1, TRF1) 和端粒重复序列结合因子2 (telomeric repeat-binding factor 2, TRF2) ,它们的功能之一是保护染色体末端不被细胞内监督机制识别为DSBs[28]。在正常细胞中,随着复制次数的增加,端粒缩短到一定程度可以激活DNA损伤信号,从而引发永远的生长阻滞,即复制性衰老[29]。体外培养研究显示,在正常的衰老细胞中,早老素的mRNA水平是升高的[30],早老素的累积也会导致细胞早老,那么二者之间存在什么联系?Cao等[31]认为,在正常的成纤维细胞衰老过程中,持续性的端粒受损是早老素产生的原因之一。在细胞衰老的过程中,端粒功能紊乱引发细胞内多种基因可变剪切位点的改变,其中就包括LMNA基因的突变。他们认为,端粒的逐渐丢失是一种上游信号,这个信号激活LMNA隐蔽的剪切位点,导致早老素的产生。反之,在成纤维细胞中,强制性延长端粒,抑制早老素的产生。在永生化细胞中 (拥有端粒酶,端粒长度稳定) ,早老素的mRNA表达水平是显着降低的。
另一方面,在HGPS患者的细胞中表现有端粒DNA损伤信号的增加,且细胞中端粒是缩短的[32,33]。在正常的成纤维细胞中,外源性表达早老素,导致端粒部位的DNA损伤和以生长阻滞为特征的衰老现象。另有研究发现,在LMNA突变的成纤维细胞中,构成端粒复合体的端粒结合蛋白大量减少,其中主要是TRF2的水平[34]。TRF2的减少破坏端粒的t-loops结构的形成。t-loops结构是保护DNA端粒末端免受DSB修复的关键因素。因此,对端粒的保护性下降,引发端粒缩短,DNA损伤应答,染色体不稳定和早衰[35]。更进一步发现,TRF2可与lamin A或者其他的核纤层相关蛋白质结合,lamin A和TRF2结合加固了t-loops的形成[36],早老素却无此作用。HGPS患者的细胞中,发现有端粒DNA损伤信号以及端粒加速缩短。端粒功能紊乱如何导致早老素的产生,或者是其中更有详尽的相互作用,仍然是一个迷,更深入的探究二者之间的关系将对衰老和衰老相关疾病有更深入的理解。
4、 早老素与表观遗传改变
4.1、 早老素影响组蛋白甲基化
染色质改变是衰老的重要原因之一。异染色质稳定性的维持对细胞完整性至关重要,其丢失会导致基因组不稳定和细胞老化[37]。染色质结构改变由DNA甲基化和组蛋白翻译后修饰等共同介导,这些表观遗传调控在基因组的稳定性、基因表达、细胞健康与疾病等方面有密切关系[38,39]。在正常的衰老细胞研究发现,H3K9me3和H3K27me3的水平逐渐下降,这两种组蛋白都有促进异染色质凝集作用。进一步研究发现,随着细胞衰老,HP1α (heterochromatin protein 1 homologue-α) 、NuRD复合物 (nucleosome remodelling and deacetylase chromatin remodelling complex) 和多梳蛋白家族 (polycombgroup proteins, PCG) 的部分蛋白质,如EZH2下调。HP1α是一种异染色质结合蛋白质,它与H3K9me3结合是结构异染色质的特征之一,在维持异染色质功能方面发挥关键作用[40]。NuRD复合物和H3K27甲基转移酶EZH2的表达减少,造成H3K27me3的降低,这些蛋白质的下调和异染色质丢失有密切关系,且都是表观沉默子[41-43]。这些表观遗传改变和衰老息息相关,有研究发现,在线虫中敲除H3K27去甲基化酶UTX1,增加了线虫原来寿命的30%[44]。
在HGPS患者中也报道有以上现象。研究发现,早老素影响了多梳蛋白家族部分蛋白质的定位,造成H3K9me3在基因组上的广泛丢失,而组蛋白修饰异常或者减少会导致DNA损伤修复 (DNA damage repair, DDR) 缺陷[45]。例如,在DNA损伤修复通路中,ATM是γ-H2AX的重要上游激酶,γ-H2AX通过招募下游的修复蛋白质从而进行及时的DNA损伤修复。Zhang等[46]发现,在正常细胞中,用阿霉素诱导DNA损伤,γ-H2AX和H3K9me3水平成正相关。这是因为H3K9me3对ATM的激活至关重要,通过减少H3K9的甲基转移酶如SUV39h1降低H3K9me3水平,可以阻止DSBs通路中ATM的激活[47,48]。HP1α是异染色质H3K9的主要配体[49]。在正常细胞中,H3K9和HP1α富集在核纤层蛋白上,参与DNA损伤修复基因的表达激活,共同维持基因组的稳定[50]。应答DNA损伤时,HP1α促进SUV39h1的招募,从而增加H3K9me3水平,并且起始DDR信号。HGPS患者的细胞中,早老素无法发挥核纤层蛋白的正常功能,导致HP1α功能受损,影响SUV39h1的招募,破坏DNA修复过程中修复蛋白质的招募,导致基因组稳定性下降[46]。与此相反,有人认为在HGPS患者中,H3K9me3的水平升高阻止了DDR[51]。DNA损伤时致密的染色质特别是异染色质,需要经由ATM介导的KRAB-相关蛋白1 (KRAB-associated protein-1, KAP1,也称为Trim28或Tif1b) 的磷酸化,进行广泛的核小体的重塑,从而疏松异染色质的致密结构,让DNA修复蛋白质更易结合在损伤部位进行修复[52]。在正常细胞中,lamin A和许多细胞核蛋白质相互作用,例如Rb、53BP1、ING1等,阻止它们被蛋白酶降解。Lamin A也可以和SUV39h1相互作用,防止其降解,增强其稳定性。而早老素和SUV39h1相互作用的亲和力强于lamin A,使其更不易降解。由于早老素降低SUV39h1的降解,使得细胞中H3K9me3水平升高,造成H3K9me3介导的异染质凝集程度增加,染色质紧密,因此不易招募修复蛋白质,DNA修复障碍,进而基因组稳定性下降,加速早衰。降低SUV39h1水平,拯救了DNA修复和早期衰老,延长Zmpste24-/-小鼠的寿命。以上结论不同的原因可能是实验中应用的细胞传代数不同,以及细胞处于不同的细胞周期所致,所以研究H3K9me3和SUV39h1与衰老之间的关系,必须将细胞传代次数着重考虑进去。早老素通过影响HP1α、EZH2、SUV39h1等蛋白质改变H3K9的表观遗传修饰,通过影响染色质结构和DDR导致基因组稳定性下降,引起早衰。
4.2、 早老素影响组蛋白乙酰化
在HGPS患者的细胞中,广泛的组蛋白甲基化丢失也伴随着H2B和H4的低乙酰化,这可能是由于组蛋白乙酰转移酶KAT8在核纤层上的减少引所致[2]。H4K16的乙酰化可以促进非同源性末端接合 (non-homologous end joining, NHEJ) 和同源重组修复 (homologous recombination repair, HR) 途径,乙酰化H4K16水平的降低和衰老相关。不论是过表达KAT8还是给予组蛋白去乙酰化酶 (histone deacetylase, HDAC) 抑制剂处理,均延长Zmpste24敲除小鼠的寿命[53]。Mof是哺乳动物细胞中H4K16主要的组蛋白乙酰转移酶,它对维持基因组完整性有着重要的作用,Mof的减少会延迟γ-H2AX位点的形成和DNA损伤应答[54,55]。研究发现,preLamin A的累积减少Mof在核基质中的存在且使其定位错误。由于Mof对招募DNA修复过程中的53BP1必不可少,所以prelamin A的累积延迟了DNA的损伤修复,加速了衰老进程[53]。
哺乳动物的沉默信息调节因子 (silent information regulator, sirtuin) 家族是典型的Ⅲ型HDAC。sirtuin家族有7个成员,是抵抗衰老的基因家族。SIRT6是一种去乙酰化酶,它与核小体的相互作用显着降低了H3K9和H3K56的乙酰化水平,并且SIRT6是最早定位在DSBs损伤位点进行修复的因子之一[56]。Ghosh等[57]研究发现,lamin A可以与SIRT6直接相互作用,并且是SIRT6的内源性激活剂。Lamin A通过促进SIRT6依赖的DNA-PKcs招募到染色质、CtIP去乙酰化、和PARP1的单ADP核糖核酸反应来应对DNA损伤,即正常的Lamin A可以促进SIRT6在DNA损伤上的染色质定位,从而协助SIRT6介导的DNA修复。早老素与SIRT6的相互作用更强,但它并未显着增强SIRT6活动。相反,早老素的存在改变了SIRT6在染色质的正常定位和依赖于DNA损伤的下游修复事件。随着早老素和SIRT6之间的结合越来越强,早老素将SIRT6系在核骨架,可能危及DNA损伤时的SIRT6动员。这种结合可能会使酶从其底物中隐藏起来,或者改变其构象,使酶活性受到损害。另外,早老素与SIRT6的相互作用可能会促进其他蛋白质复合体与SIRT6结合,并削弱其活性,进一步加速衰老的发生。在HGPS患者的细胞中,早老素的存在影响Mof的定位和SIRT6的激活,同时早老素无法行使lamin A正常的功能,破坏组蛋白如H4K16的乙酰化,以及SIRT6介导的DNA损伤修复事件加速衰老[57]。
5、 问题与展望
在HGPS患者的细胞中,早老素导致基因组稳定性下降的相关分子机制逐渐被破解,针对这方面的临床治疗的研究也取得一定成果。但是,目前的治疗方案仅在于改善衰老症状和延长寿命方面,真正根除这个疾病还需更深入的研究。另一方面,肿瘤细胞的无限增殖与衰老细胞的周期阻滞是相互对立的现象,让人联想到肿瘤衰老疗法的可行性,而HGPS患者的细胞作为研究人类衰老的理想模型,关于早老素和肿瘤之间的关系,近年来引起了人们的关注。并且有文献报道,早老素可以抑制肿瘤细胞的侵袭和迁移[58,59],提示早老素可能参与肿瘤的信号途径,并起到一定抑制作用,但是具体的分子机制尚不清楚。早老素与基因组稳定性的关系涉及到许多方面,它们相互作用相互联系,进一步研究它们在早衰过程中所起的作用,有助于解开早老症的神秘面纱,并且为探索人类正常的衰老,以及在肿瘤的衰老治疗方面迎来了新的机遇与挑战。
参考文献
[1] Hernandez-Segura A, Nehme J, Demaria M. Hallmarks of cellular senescence[J]. Trends Cell Biol, 2018, 28 (6) :436-453
[2] Kubben N, Misteli T. Shared molecular and cellular mechanisms of premature ageing and ageing-associated diseases[J]. Nat Rev Mol Cell Biol, 2017, 18 (10) :595-609
[3] Dechat T, Pfleghaar K, Sengupta K, et al. Nuclear lamins:major factors in the structural organization and function of the nucleus and chromatin[J]. Genes Dev, 2008, 22 (7) :832-853
[4] Houben F, Ramaekers FC, Snoeckx LH, et al. Role of nuclear lamina-cytoskeleton interactions in the maintenance of cellular strength[J]. Biochim Biophys Acta, 2007, 1773 (5) :675-686
[5] Gonzalo S, Kreienkamp R, Askjaer P. Hutchinson-Gilford Progeria Syndrome:A premature aging disease caused by LMNA gene mutations[J]. Ageing Res Rev, 2017, 33:18-29
[6] Ungricht R, Kutay U. Mechanisms and functions of nuclear envelope remodelling[J]. Nat Rev Mol Cell Biol, 2017, 18 (4) :229-245
[7] Burke B, Stewart CL. The nuclear lamins:flexibility in function[J]. Nat Rev Mol Cell Biol, 2013, 14 (1) :13-24
[8] Hennekam RC. Hutchinson-Gilford progeria syndrome:review of the phenotype[J]. Am J Med Genet A, 2006, 140 (23) :2603-2624
[9] Ahmed MS, Ikram S, Bibi N, et al. Hutchinson-Gilford Progeria Syndrome:A Premature Aging Disease[J]. Mol Neurobiol, 2018, 55 (5) :4417-4427
[10] Musich PR, Zou Y. Genomic instability and DNA damage responses in progeria arising from defective maturation of prelamin A[J]. Aging (Albany NY) , 2009, 1 (1) :28-37
[11]曾涛, 刘新光, 周中军.早老症 (HGPS) 的发病机制与治疗策略[J].生物化学与生物物理进展 (Zeng T, Liu XG, Zhou ZJ.Pathogenesis and treatment strategies of premature aging (HGPS) [J]. Prog Biochem Biophys) , 2007, 34 (7) :687-694
[12] Cobb AM, Murray TV, Warren DT, et al. Disruption of PCNAlamins A/C interactions by prelamin A induces DNA replication fork stalling[J]. Nucleus, 2016, 7 (5) :498-511
[13] Hilton BA, Liu J, Cartwright BM, et al. Progerin sequestration of PCNA promotes replication fork collapse and mislocalization of XPA in laminopathy-related progeroid syndromes[J]. FASEB J, 2017, 31 (9) :3882-3893
[14] Wheaton K, Campuzano D, Ma W, et al. Progerin-Induced Replication Stress Facilitates Premature Senescence in Hutchinson-Gilford Progeria Syndrome[J]. Mol Cell Biol, 2017, 37 (14) . pii:e00659-16
[15] Kubben N, Zhang W, Wang L, et al. Repression of the Antioxidant NRF2 Pathway in Premature Aging[J]. Cell, 2016, 165 (6) :1361-1374
[16] Cuadrado A, Rojo AI, Wells G, et al. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases[J]. Nat Rev Drug Discov, 2019, 18 (4) :295-314
[17] Liu B, Wang J, Chan KM, et al. Genomic instability in laminopathy-based premature aging[J]. Nat Med, 2005, 11 (7) :780-785
[18] Liu Y, Liu Y, Yang Z, et al. Cooperative interaction of human XPA stabilizes and enhances specific binding of XPA to DNA damage[J]. Biochemistry, 2005, 44 (19) :7361-7368
[19] Diner EJ, Vance RE. Taking the STING out of cytosolic DNA sensing[J]. Trends Immunol, 2014, 35 (1) :1-2
[20] Civril F, Deimling T, de Oliveira Mann CC, et al. Structural mechanism of cytosolic DNA sensing by c GAS[J]. Nature, 2013, 498 (7454) :332-337
[21] Ablasser A, Goldeck M, Cavlar T, et al. c GAS produces a 2'-5'-linked cyclic dinucleotide second messenger that activates STING[J]. Nature, 2013, 498 (7454) :380-384
[22] Burdette DL, Vance RE. STING and the innate immune response to nucleic acids in the cytosol[J]. Nat Immunol, 2013, 14 (1) :19-26
[23] Hartlova A, Erttmann SF, Raffi FA, et al. DNA damage primes the type I interferon system via the cytosolic DNA sensor STING to promote anti-microbial innate immunity[J]. Immunity, 2015, 42 (2) :332-343
[24] Yu Q, Katlinskaya YV, Carbone CJ, et al. DNA-damageinduced type I interferon promotes senescence and inhibits stem cell function[J]. Cell Rep, 2015, 11 (5) :785-797
[25] Yang H, Wang H, Ren J, et al. c GAS is essential for cellular senescence[J]. Proc Natl Acad Sci U S A, 2017, 114 (23) :E4612-E4620
[26] Kreienkamp R, Graziano S, Coll-Bonfill N, et al. A cell-intrinsic interferon-like response links replication stress to cellular aging caused by progerin[J]. Cell Rep, 2018, 22 (8) :2006-2015
[27] Szelag M, Piaszyk-Borychowska A, Plens-Galaska M, et al.Targeted inhibition of STATs and IRFs as a potential treatment strategy in cardiovascular disease[J]. Oncotarget, 2016, 7 (30) :48788-48812
[28] Fuster JJ, Andres V. Telomere biology and cardiovascular disease[J]. Circ Res, 2006, 99 (11) :1167-1180
[29] Allsopp RC, Vaziri H, Patterson C, et al. Telomere length predicts replicative capacity of human fibroblasts[J]. Proc Natl Acad Sci U S A, 1992, 89 (21) :10114-10118
[30] Rodriguez S, Coppede F, Sagelius H, et al. Increased expression of the Hutchinson-Gilford progeria syndrome truncated lamin A transcript during cell aging[J]. Eur J Hum Genet, 2009, 17 (7) :928-937
[31] Cao K, Graziotto JJ, Blair CD, et al. Rapamycin reverses cellular phenotypes and enhances mutant protein clearance in HutchinsonGilford progeria syndrome cells[J]. Sci Transl Med, 2011, 3 (89) :89ra58
[32] Benson EK, Lee SW, Aaronson SA. Role of progerin-induced telomere dysfunction in HGPS premature cellular senescence[J].J Cell Sci, 2010, 123 (Pt 15) :2605-2612
[33] Decker ML, Chavez E, Vulto I, et al. Telomere length in Hutchinson-Gilford progeria syndrome[J]. Mech Ageing Dev, 2009, 130 (6) :377-383
[34] Saha B, Zitnik G, Johnson S, et al. DNA damage accumulation and TRF2 degradation in atypical Werner syndrome fibroblasts with LMNA mutations[J]. Front Genet, 2013, 4:129
[35] Denchi EL, de Lange T. Protection of telomeres through independent control of ATM and ATR by TRF2 and POT1[J].Nature, 2007, 448 (7157) :1068-1071
[36] Wood AM, Rendtlew DJ, Lucas CA, et al. TRF2 and lamin A/C interact to facilitate the functional organization of chromosome ends[J]. Nat Commun, 2014, 5:5467
[37] Jeon HJ, Kim YS, Kim JG, et al. Effect of heterochromatin stability on intestinal stem cell aging in Drosophila[J]. Mech Ageing Dev, 2018, 173:50-60
[38] Heyn H, Moran S, Esteller M. Aberrant DNA methylation profiles in the premature aging disorders Hutchinson-Gilford Progeria and Werner syndrome[J]. Epigenetics, 2013, 8 (1) :28-33
[39] Lopez-Otin C, Blasco MA, Partridge L, et al. The hallmarks of aging[J]. Cell, 2013, 153 (6) :1194-1217
[40] Larson AG, Elnatan D, Keenen MM, et al. Liquid droplet formation by HP1alpha suggests a role for phase separation in heterochromatin[J]. Nature, 2017, 547 (7662) :236-240
[41] Scaffidi P, Misteli T. Reversal of the cellular phenotype in the premature aging disease Hutchinson-Gilford progeria syndrome[J]. Nat Med, 2005, 11 (4) :440-445
[42] Pegoraro G, Kubben N, Wickert U, et al. Ageing-related chromatin defects through loss of the NURD complex[J]. Nat Cell Biol, 2009, 11 (10) :1261-1267
[43] Carrero D, Soria-Valles C, Lopez-Otin C. Hallmarks of progeroid syndromes:lessons from mice and reprogrammed cells[J]. Dis Model Mech, 2016, 9 (7) :719-735
[44] Jin C, Li J, Green CD, et al. Histone demethylase UTX-1regulates C. elegans life span by targeting the insulin/IGF-1signaling pathway[J]. Cell Metab, 2011, 14 (2) :161-172
[45] Marullo F, Cesarini E, Antonelli L, et al. Nucleoplasmic Lamin A/C and Polycomb group of proteins:An evolutionarily conserved interplay[J]. Nucleus, 2016, 7 (2) :103-111
[46] Zhang H, Sun L, Wang K, et al. Loss of H3K9me3 Correlates with ATM Activation and Histone H2AX Phosphorylation Deficiencies in Hutchinson-Gilford Progeria Syndrome[J]. PLoS One, 2016, 11 (12) :e 0167454
[47] Sun Y, Jiang X, Xu Y, et al. Histone H3 methylation links DNA damage detection to activation of the tumour suppressor Tip60[J].Nat Cell Biol, 2009, 11 (11) :1376-1382
[48] Ayrapetov MK, Gursoy-Yuzugullu O, Xu C, et al. DNA doublestrand breaks promote methylation of histone H3 on lysine 9 and transient formation of repressive chromatin[J]. Proc Natl Acad Sci U S A, 2014, 111 (25) :9169-9174
[49] Harr JC, Gonzalez-Sandoval A, Gasser SM. Histones and histone modifications in perinuclear chromatin anchoring:from yeast to man[J]. EMBO Rep, 2016, 17 (2) :139-155
[50] Pindyurin AV, Ilyin AA, Ivankin AV, et al. The large fraction of heterochromatin in Drosophila neurons is bound by both B-type lamin and HP1a[J]. Epigenetics Chromatin, 2018, 11 (1) :65
[51] Liu B, Wang Z, Zhang L, et al. Depleting the methyltransferase Suv39h1 improves DNA repair and extends lifespan in a progeria mouse model[J]. Nat Commun, 2013, 4:1868
[52] Ziv Y, Bielopolski D, Galanty Y, et al. Chromatin relaxation in response to DNA double-strand breaks is modulated by a novel ATM-and KAP-1 dependent pathway[J]. Nat Cell Biol, 2006, 8 (8) :870-876
[53] Krishnan V, Chow MZ, Wang Z, et al. Histone H4 lysine 16hypoacetylation is associated with defective DNA repair and premature senescence in Zmpste24-deficient mice[J]. Proc Natl Acad Sci U S A, 2011, 108 (30) :12325-12330
[54] Sharma GG, So S, Gupta A, et al. MOF and histone H4acetylation at lysine 16 are critical for DNA damage response and double-strand break repair[J]. Mol Cell Biol, 2010, 30 (14) :3582-3595
[55] Li X, Corsa CA, Pan PW, et al. MOF and H4 K16 acetylation play important roles in DNA damage repair by modulating recruitment of DNA damage repair protein Mdc1[J]. Mol Cell Biol, 2010, 30 (22) :5335-5347
[56] Toiber D, Erdel F, Bouazoune K, et al. SIRT6 recruits SNF2H to DNA break sites, preventing genomic instability through chromatin remodeling[J]. Mol Cell, 2013, 51 (4) :454-468
[57] Ghosh S, Liu B, Wang Y, et al. Lamin A is an endogenous SIRT6 activator and promotes SIRT6-mediated DNA repair[J].Cell Rep, 2015, 13 (7) :1396-1406
[58] Fernandez P, Scaffidi P, Markert E, et al. Transformation resistance in a premature aging disorder identifies a tumorprotective function of BRD4[J]. Cell Rep, 2014, 9 (1) :248-260
[59] de la Rosa J, Freije JM, Cabanillas R, et al. Prelamin A causes progeria through cell-extrinsic mechanisms and prevents cancer invasion[J]. Nat Commun, 2013, 4:2268