摘 要: 目的 探讨连续性肾脏替代治疗(continuous renal replacement therapy, CRRT)在新生儿遗传代谢性疾病合并高氨血症救治中的有效性及安全性。方法 回顾性收集并分析2016年9月至2020年3月在湖南省儿童医院新生儿科住院的遗传代谢性疾病合并高氨血症并行CRRT的新生儿的病历资料,包括一般情况、临床指标、实验室指标、不良反应等。结果 共11例患儿入组,其中男7例(64%),女4例(36%)。平均胎龄(38.9±0.8)周,平均入院体重(3 091±266)g,CRRT日龄为(5.7±2.0)d。患儿主要表现为呕吐、抽搐(100%),昏迷(55%),原发病以尿素循环障碍性疾病为主(55%)。患儿平均CRRT总持续时间为(44±14)h,CRRT前中位昏迷时间为2 h,中位总昏迷时间为10 h。平均住院时间为(18±10)d,存活率为73%,2例幸存者出现癫痫。患儿治疗后血氨、乳酸、K+浓度较治疗前均下降(P<0.001),治疗后p H值较治疗前上升(P<0.001)。不良反应发生率为27%。结论 CRRT可安全有效地用于治疗新生儿遗传代谢性疾病合并高氨血症。[中国当代儿科杂志,2021,23(5):488-493]
关键词: 遗传代谢性疾病; 连续性肾脏替代治疗; 高氨血症; 新生儿;
Abstract: Objective To study the efficacy and safety of continuous renal replacement therapy (CRRT) in the treatment of neonates with inherited metabolic diseases and hyperammonemia.Methods A retrospective analysis was performed on the medical records of neonates with inherited metabolic diseases and hyperammonemia who were hospitalized and underwent CRRT in the Department of Neonatology,Hunan Children’s Hospital,from September 2016 to March 2020,including general conditions,clinical indices,laboratory markers,and adverse reactions.Results A total of 11 neonates were enrolled,with 7 boys (64%) and 4 girls (36%).The neonates had a mean gestational age of (38.9±0.8) weeks,a mean body weight of (3091±266) g on admission,and an age of (5.7±2.0) days at the time of CRRT.The main clinical manifestations were vomiting (100%),convulsions (100%),and coma (55%),and the main primary disease was urea cycle disorder (55%).The mean duration of CRRT was (44±14) hours,the medium duration of coma before CRRT was 2 hours,and the total duration of coma was 10 hours.The patients had a mean hospital stay of (18±10) days and a survival rate of 73%,and 2 survivors had epilepsy.After treatment,all patients had significant reductions in blood ammonia,lactic acid,and K+ concentration (P<0.001) and a significant increase in pH (P<0.001).The incidence rate of adverse reactions was 27%.Conclusions CRRT is safe and effective in the treatment of neonates with inherited metabolic diseases and hyperammonemia.[Chin J Contemp Pediatr,2021,23(5):488-493]
Keyword: Inherited metabolic disease; Continuous renal replacement therapy; Hyperammonemia; Neonate;

新生儿高氨血症是一种代谢急症,血氨超过200 μmol/L时与神经系统不良预后相关[1]。罹患高氨血症的新生儿常伴有呕吐、肌张力异常、癫痫发作等神经系统功能障碍,需要紧急诊断、营养支持和特殊药物治疗,以及排泄有害代谢产物。阿根廷的一个队列研究显示其病死率高达57%,幸存者的致残率达28%[2]。新生儿高氨血症多由遗传代谢性疾病引起。由于代谢产物随时间累积,及早诊断对于防止神经系统损害和发育障碍至关重要。肾脏替代治疗能够有效清除血氨,并减少患儿暴露于高浓度血氨的时间。新生儿高氨血症时可采取肾脏替代治疗快速排出毒素。目前可用的方法包括腹膜透析、间歇性血液透析,以及各种模式的连续性肾脏替代治疗(continuous renal replacement therapy,CRRT),如连续性静脉-静脉血液滤过(continuous venovenous hemofiltration,CVVH)、连续性静脉-静脉血液透析(continuous venovenous haemodialysis,CVVHD)和连续性静脉-静脉血液透析滤过(continuous venovenous hemodia filtration,CVVHDF)等。2020年新发表的儿童高氨血症管理共识推荐CRRT,尤其CVVHD模式是高氨血症的一线治疗方案[3]。湖南省儿童医院新生儿四科(足月新生儿监护室)自2016年起,开展了CRRT用于新生儿遗传代谢性疾病合并高氨血症的治疗,属于国内较早开展新生儿CRRT的单位,且在治疗过程中创新性地采用双相透析策略,取得了较好的治疗效果,总结了一定的经验,现报道如下。
1 、资料与方法
1.1 、研究对象
回顾性收集2016年9月至2020年3月在湖南省儿童医院新生儿四科住院,考虑诊断为遗传代谢性疾病合并高氨血症并行CRRT患儿的病历资料。遗传代谢性疾病通过气相色谱/质谱法行尿有机酸分析、血液酯酰肉碱谱分析和血液氨基酸分析进行诊断。新生儿高氨血症实验室诊断标准定义为血氨>100 μmol/L[4]。遗传代谢性疾病合并高氨血症患儿的纳入标准为:(1)新生儿期即表现出意识障碍、反复抽搐、肌张力异常等神经系统症状;(2)起病迅猛,合并多器官功能障碍;(3)表观畸形或有遗传代谢性疾病家族史;(4)反复代谢性酸中毒;(5)血氨>100 μmol/L。高氨血症患儿行CRRT指征:血氨>300 μmol/L[4]。整体排除标准:(1)血小板计数低于5×109/L;(2)入院48 h内死亡或自动出院者。共11例患儿符合入组标准,研究过程中无病例脱失、剔除。所有入组患儿监护人均已签署中心静脉置管及血液净化知情同意书,本研究已获得湖南省儿童医院伦理委员会批准(HCHLL-2020-102)。
1.2 、方法
(1)支持治疗:所有患儿均常规给予一般支持治疗,包括呼吸和循环支持及纠正内环境失衡等,在确诊前予葡萄糖溶液喂养,根据患儿的原发病,还给予了如下相应治疗:鸟氨酸氨甲酰转移酶缺乏症(ornithine transaminase deficiency,OTCD):停止蛋白质摄入,静脉滴注精氨酸注射液360 mg/(kg · d),静脉滴注左卡尼汀注射液100 mg/(kg · d);瓜氨酸血症(citrullinemia,CTLN):停止蛋白质摄入,静脉滴注精氨酸注射液360 mg/(kg · d)、左卡尼汀注射液100 mg/(kg · d);枫糖尿病(maple syrup urine diseas,MSUD):提供足量热卡120~140 kcal/(kg · d),口服维生素B1 300 mg/d,静脉滴注精氨酸注射液250 mg/(kg · d);甲基丙二酸血症(methylmalonic acidemia,MMA):静脉滴注精氨酸注射液250 mg/(kg · d)、左卡尼汀注射液300 mg/(kg · d),肌肉注射维生素B12 1 mg/d;丙酸血症(propionic acidemia,PA):静脉滴注精氨酸注射液250 mg/(kg · d)、左卡尼汀注射液300 mg/(kg · d)。
(2)CRRT方法:使用德国费森尤斯多功能血液净化机、AV paed滤器及配套的儿童管路。股静脉或脐静脉留置双腔中心静脉导管。上机前滤器以肝素0.9%NaCl溶液预冲,管路以红细胞悬浮液预冲。治疗模式为CVVHD。抗凝方式选择普通肝素,负荷剂量为50 IU/kg,维持剂量为10 IU/(kg · h),肝素剂量根据活化部分凝血活酶时间(activated partial thromboplastin time,APTT)进行调整。APTT目标靶值为正常值的1.5~2倍,当治疗过程中有出血倾向或APTT高于靶值时予下调或停止肝素注入。根据患儿体重和血压选择适当的血流速和透析液流速,起始血流速设定为3 mL/(kg · min),根据血压逐渐调整到5 mL/(kg · min),起始透析液流速设为8 000 mL/(h · 1.73 m2)。透析液采用商品化血液滤过置换基础液,生产商为成都青山利康药业有限公司(国药准字H20080452),不含碳酸氢盐、钾离子,配方如下:无水葡萄糖10.6 mmol/L、总钙1.6 mmol/L、Na+ 113 mmol/L、Cl-118 mmol/L、Mg2+ 0.797 mmol/L,B液为5%碳酸氢钠,根据上机前患儿血钾水平加入适量10% KCl。CRRT治疗中动态监测生命体征,每6 h监测血气分析、血常规、凝血功能、电解质等。根据患儿病情酌情调整CRRT参数。当血氨下降至200 μmol/L且神经系统功能好转时定为CRRT治疗的终点。
1.3 、观察指标
(1)一般情况:记录研究对象的性别、胎龄、入院体重、新生儿危重病例评分(Neonatal Critical Illness Score,NCIS)、CRRT日龄、重要临床表现、原发病等。
(2)临床指标:记录患儿CRRT总持续时间、CRRT次数、CRRT前昏迷时间、总昏迷时间、住院时间、出院转归、随访幸存者神经系统后遗症等。
(3)实验室指标:记录CRRT前后血氨浓度、pH值、乳酸(lactic acid,LAC)水平、K+浓度、Na+浓度等。
(4)不良反应:记录CRRT及中心静脉置管相关不良反应。
1.4 、统计学分析
采用SPSS 22.0统计学软件对数据进行分析。符合正态分布的计量资料以均数±标准差(x?±s)表示,治疗前后比较采用配对t检验;非正态分布计量资料采用中位数(四分位数间距)[M(P25,P75)]表示,治疗前后比较采用Wilcoxon符号秩和检验;计数资料以例或百分率(%)表示。P<0.05为差异有统计学意义。
2 、结果
2.1 、一般情况
对11例诊断为遗传代谢性疾病合并高氨血症的新生儿进行了CRRT治疗,其中男7例(64%),女4例(36%);平均胎龄(38.9±0.8)周,平均入院体重(3?091±266)g;NCIS评分为(82±4)分,CRRT日龄为(5.7±2.0)d。最主要的临床表现为呕吐、抽搐(100%),6例(55%)患儿出现昏迷,原发病以尿素循环障碍性疾病(包括OTCD、CTLN)为主,占55%。见表1。
表1 11例患儿一般情况
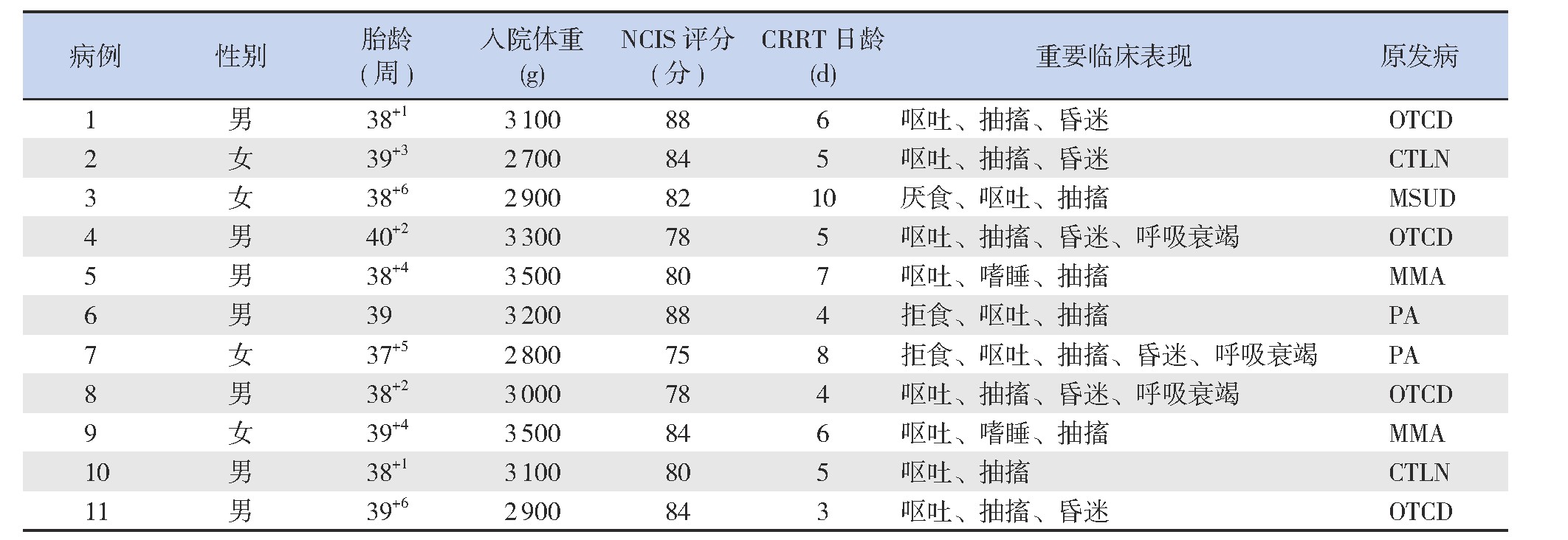
注:[NCIS]新生儿危重病例评分;[CRRT]连续性肾脏替代治疗;[OTCD]鸟氨酸氨甲酰转移酶缺乏症;[CTLN]瓜氨酸血症;[MSUD]枫糖尿病;[MMA]甲基丙二酸血症;[PA]丙酸血症。
2.2、 临床指标
患儿平均CRRT总持续时间为(44±14)h,11例患儿共行15次CRRT治疗,CRRT前昏迷时间为2(0,13)h,总昏迷时间为10(0,60)h,6例出现昏迷的患儿CRRT前血氨水平均在1 000 μmol/L以上。平均住院时间为(18±10)d,存活率为73%,8例幸存者目前已随访6个月至4年,有2例(25%)出现癫痫,6例暂未发现喂养困难、癫痫、共济失调等神经系统后遗症。见表2。
表2 11例患儿临床指标情况
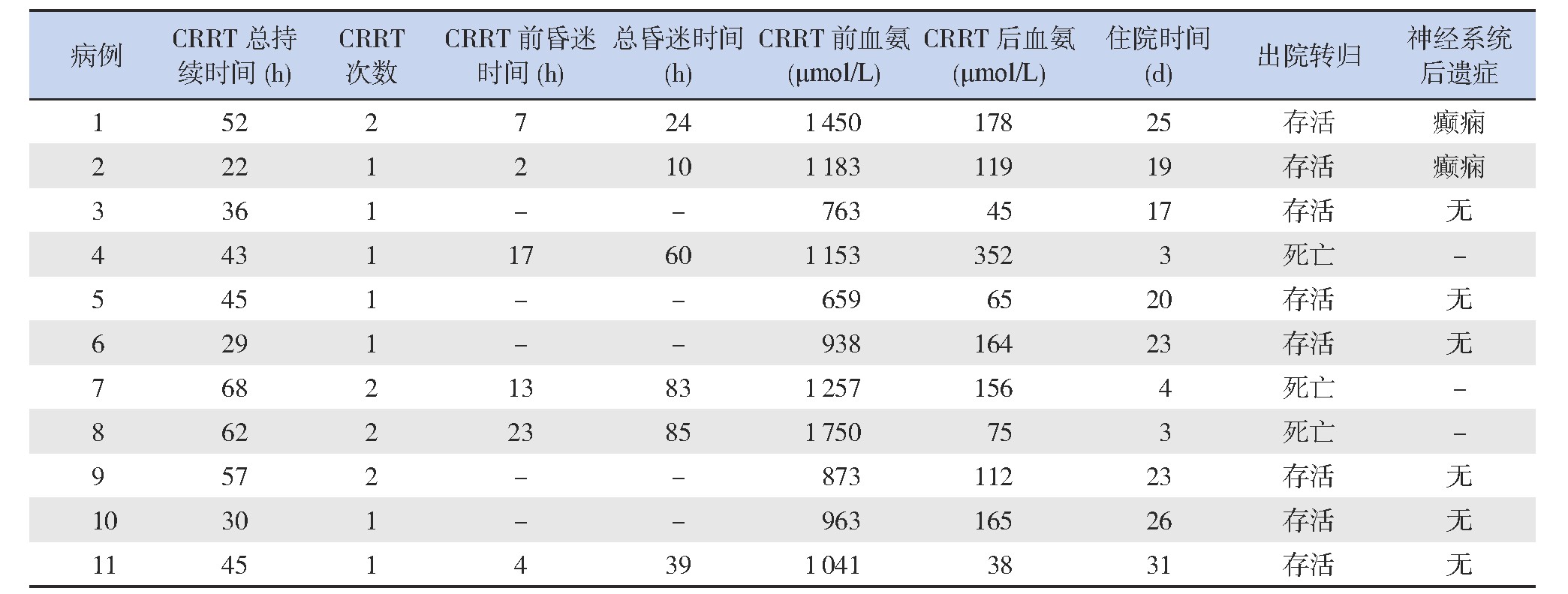
注:[CRRT]连续性肾脏替代治疗。-示未发生或未记录。
2.3、 实验室指标
患儿治疗后血氨、LAC、K+浓度较治疗前均下降(P<0.001),治疗后pH值较治疗前上升(P<0.001),治疗前后Na+浓度比较差异无统计学意义(P=0.533),见表3。
表3 11例患儿实验室指标变化
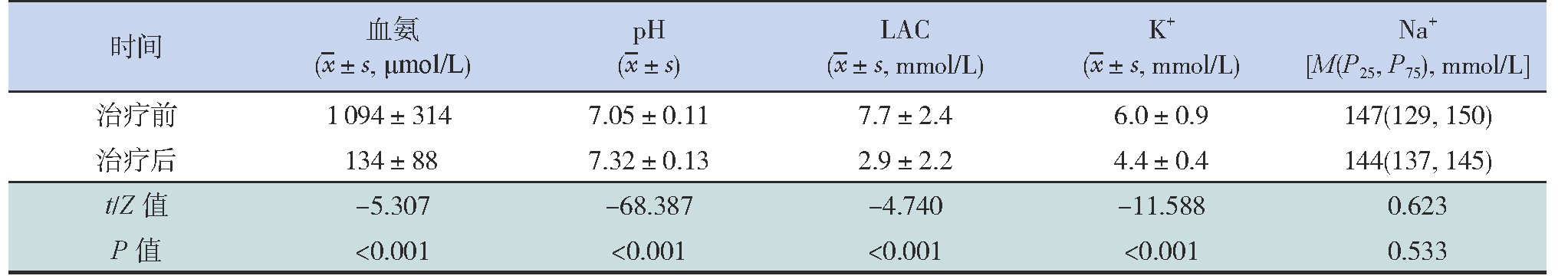
注:[LAC]乳酸。
2.4 、不良反应
11例患儿共行15次CRRT治疗,不良反应包括低血压(1例次)、体外凝血(1例次)、低体温(1例次)、置管处渗血(1例次)等,总发生率为27%(4/15)。经积极对症处理后均可恢复。未观察到血栓、内脏出血、感染等相关并发症。
3、 讨论
遗传代谢性疾病患儿毒性代谢物的累积可引起急性代谢危象甚至死亡,幸存者可能遗留长期的神经功能障碍。降低这些代谢物的浓度可以减轻神经系统损伤并可能挽救生命[5]。肾脏替代治疗已被成功用于降低血氨水平[6,7]。CRRT在儿童中的应用经验日益增长,目前CRRT也已经应用于新生儿。本研究是国内少数报道使用CRRT治疗新生儿期遗传代谢性疾病危象的研究之一[8]。本研究通过对遗传代谢性疾病合并高氨血症的新生儿的回顾性分析,证实CRRT可有效用于快速降低血氨、治疗新生儿代谢危象。
罹患遗传代谢性疾病的新生儿体内神经毒性代谢物氨的堆积会导致细胞肿胀和脑水肿。血氨≤35 μmol/L被认为是正常的,而高浓度的血氨则可能产生毒性作用,尤其是当血氨升高超过200 μmol/L时与神经系统损伤高度相关[1]。新生儿高氨血症主要与遗传代谢性疾病如尿素循环障碍、有机酸血症等相关。与高氨血症预后相关的因素包括高氨性昏迷时间、血氨峰值、持续升高的血氨水平和血氨下降的时间等[9,10]。据文献报道遗传代谢性疾病导致的高氨血症幸存者遗留严重神经系统后遗症比例高达28%~50%[2,11],病死率高达27.5%~57%[2,11,12]。本研究中病例显示CRRT前血氨水平越高,患儿越可能出现昏迷,昏迷发生率高达55%,所有死亡患儿均存在昏迷症状,6例出现昏迷的患儿血氨水平均在1?000 μmol/L以上,其预后相对更差,其中3例死亡,2例存活后遗留癫痫后遗症,死亡的3例患儿CRRT前昏迷时间相对更长,25%的幸存者遗留神经系统后遗症,与既往报道的高氨血症预后相关因素相吻合[9]。
应用CRRT治疗后患儿的血氨水平可显着下降。CVVHD降低血氨水平50%的平均时间约为1.7 h,而CVVH则需要2~14.5 h[13];相比CVVHD,腹膜透析对氨的清除则要慢得多,腹膜透析对高氨血症患儿效果有限[14]。对婴儿来说,CRRT优于传统的血液透析和腹膜透析,因其血流动力学更稳定[15,16]。所有模式的CRRT对高氨血症都是安全有效的方法,但CVVHD比CVVH具有更高的氨清除率,目前儿童高氨血症管理共识亦推荐高氨血症患儿行CRRT治疗时,CVVHD为一线治疗模式[3]。Spinale等[17]报道2例入住新生儿重症监护病房的日龄分别为5 d和6 d的新生儿,入院血氨分别为881 μmol/L和776 μmol/L,后被确诊为OTCD。5日龄患儿予有创机械通气及高剂量CVVHD治疗,透析液流速为1?000 mL/h[相当于8?650 mL/(h · 1.73 m2)],CVVHD启动前血氨为1?454 μmol/L,该患儿的血氨水平在2 h内下降到367 μmol/L,并在CVVHD治疗1 h出现自主运动和神经系统功能改善。6日龄患儿CRRT治疗前血氨水平已升高至1?387 μmol/L,予高剂量CVVHDF治疗,总治疗剂量为1?000 mL/h[相当于7?700 mL/(h · 1.73 m2)],分别为透析液流速900 mL/h和置换液流速100 mL/h,患儿的血氨水平在CVVHDF治疗2 h后下降至814 μmol/L。考虑到血氨下降的时间与高氨血症患儿预后密切相关,对于高氨血症的患儿,我们需要积极地清除血氨,减少患儿在高水平血氨的暴露时间,以减少神经系统损伤。本研究中的患儿根据CRRT对氨的清除能力,选择了高剂量CVVHD来降低血氨,且在这个过程中未出现明显的电解质紊乱,并且还有效降低了血LAC、血K+水平,提高了pH值,很好地维护了患儿的内环境平衡。Hanudel等[18]研究认为采取双相透析策略,不仅能迅速清除血氨减轻氨的神经毒性,还能避免长时间高流量透析诱发低磷、低钾血症。本研究中我们对患儿亦采取了双相透析策略,初始以8?000 mL/(h · 1.73 m2)的高剂量透析迅速清除血氨,待血氨降至200 μmol/L时下调透析液流速至2?000 mL/(h · 1.73 m2),并以该流速继续维持一段时间以防止血氨反弹。11例患儿中的8例在CVVHD治疗过程中随着血氨浓度的下降,神经系统功能逐渐改善,达到73%的存活率,后续随访发现幸存者中25%的患儿出现神经系统后遗症,略低于国外报道的病死率及神经系统后遗症发生率[2,11,12],可能与本研究时间相对较晚,对高氨血症患儿启动CRRT更积极有关。
CRRT在新生儿遗传代谢性疾病合并高氨血症的应用中,不论是国内还是国外目前均缺乏大样本多中心的研究,因此,CRRT在新生儿中应用的安全性问题备受临床医生关注。CRRT及中心静脉置管相关的并发症是评价CRRT安全性的重要指标。CRRT予肝素抗凝治疗期间最常见的并发症是出血和血栓形成。土耳其的一个单中心回顾性研究[11]中,观察到12.5%的患儿出现出血,停用肝素后缓解,37.5%的患儿出现管路凝血。本研究亦采取肝素抗凝,根据凝血功能及时调整剂量,其间有1例患儿出现体外凝血及1例患儿出现置管处渗血,未观察到内脏出血及血栓形成等并发症。另外,本研究中还各有1例患儿在CRRT治疗中出现低体温及低血压,均为可逆性,予对症处理后均能缓解。新生儿因体重低、血管细、绝对血容量少等特殊性,在CRRT治疗期间更应密切监护,动态观察患儿的血流动力学、凝血功能、内环境等,尽量降低CRRT相关并发症。
综上所述,CRRT虽无法根治新生儿遗传代谢性疾病,但当出现代谢危象时,其能迅速降低代谢物浓度,调节机体内环境,且不良反应发生率低,总体而言是安全的,是遗传代谢性疾病合并高氨血症的有效治疗措施。但本研究亦存在一定的局限性,一是本研究为回顾性研究,其次本研究的样本量偏少,因而未对幸存者和死亡者进行对比研究。今后我们应着力于开展多中心大样本的临床研究,以期进一步改善遗传代谢性疾病合并高氨血症新生儿的预后。
利益冲突声明:所有作者均声明不存在利益冲突。
参考文献
[1] Gupta S,Fenves AZ,Hootkins R.The role of RRT in hyperammonemic patients[J].Clin J Am Soc Nephrol,2016,11(10):1872-1878.
[2] Silvera-Ruiz SM,Arranz JA,H?berle J,et al.Urea cycle disorders in Argentine patients:clinical presentation,biochemical and genetic findings[J].Orphanet J Rare Dis,2019,14(1):203
[3] Raina R,Bedoyan JK,Lichter-Konecki U,et al.Consensus guidelines for management of hyperammonaemia in paediatric patients receiving continuous kidney replacement therapy[J].Nat Rev Nephrol,2020,16(8):471-482.
[4] Alfadhel M,Mutairi FA,Makhseed N,et al.Guidelines for acute management of hyperammonemia in the Middle East region[J].Ther Clin Risk Manag,2016,12:479-487.
[5] Yetimakman AF,Kesici S,Tanyildiz M,et al.Continuous renal replacement therapy for treatment of severe attacks of inborn errors of metabolism[J].J Pediatr Intensive Care,2019,8(3):164-169.
[6] Aygun F,Varol F,Aktuglu-Zeybek C,et al.Continuous renal replacement therapy with high flow rate can effectively,safely,and quickly reduce plasma ammonia and leucine levels in children[J].Children (Basel),2019,6(4):53.
[7]Aygun F,Aygun D,Erbek Alp F,et al.The impact of continuous renal replacement therapy for metabolic disorders in infants[J].Pediatr Neonatol,2018,59(1):85-90.
[8] 卢刻羽,赵非,郭艳,等.连续性肾脏替代治疗6例新生儿高氨血症疗效观察[J].中华新生儿科杂志(中英文),2020,35(2):133-136.
[9] Porta F,Peruzzi L,Bonaudo R,et al.Differential response to renal replacement therapy in neonatal-onset inborn errors of metabolism[J].Nephrology (Carlton),2018,23(10):957-961.
[10] Kim JY,Lee Y,Cho H.Optimal prescriptions of continuous renal replacement therapy in neonates with hyperammonemia[J].Blood Purif,2019,47(1-3):16-22.
[11] Akduman H,Okulu E,Emino?lu FT,et al.Continuous venovenous hemodiafiltration in the treatment of newborns with an inborn metabolic disease:a single center experience[J].Turk J Med Sci,2020,50(1):12-17.
[12] Gündüz M,?nal S,Okur ?,et al.Neonates with inborn errors of metabolism:spectrum and short-term outcomes at a tertiary care hospital[J].Turk J Pediatr,2015,57(1):45-52.
[13] Lai YC,Huang HP,Tsai IJ,et al.High-volume continuous venovenous hemofiltration as an effective therapy for acute management of inborn errors of metabolism in young children[J].Blood Purif,2007,25(4):303-308.
[14] Arbeiter AK,Kranz B,Wingen AM,et al.Continuous venovenous haemodialysis (CVVHD) and continuous peritoneal dialysis (CPD) in the acute management of 21 children with inborn errors of metabolism[J].Nephrol Dial Transplant,2010,25(4):1257-1265.
[15] Osgood M,Muehlschlegel S.POINT:should continuous venovenous hemofiltration always be the preferred mode of renal replacement therapy for the patient with acute brain injury?yes[J].Chest,2017,152(6):1109-1111.
[16] Redant S,Beretta-Piccoli X,Mugisha A,et al.Hyperammone-mia,the last indication of high-volume hemodiafiltration in adult and children:a structured review[J].Blood Purif,2019,48(4):330-335.
[17] Spinale JM,Laskin BL,Sondheimer N,et al.High-dosecontinuous renal replacement therapy for neonatal hyperam-monemia[J].Pediatr Nephrol,2013,28(6):983-986.
[18] Hanudel M,Avasare S,Tsai E,et al.A biphasic dialytic strategy for the treatment of neonatal hyperammonemia[J].Pediatr Nephrol,2014,29(2):315-320.