摘 要: 大血管血管炎包括大动脉炎和巨细胞动脉炎,病因涉及遗传、感染、环境、免疫反应等因素,发病机制仍待明确。在遗传背景研究方面发现,大动脉炎与HLA-Ⅰ类基因区(HLA-B*52)关系最为密切,参与炎症反应的相关基因(IL12B、IL6、RPS9/LILRB3)也发挥着重要作用。在巨细胞动脉炎中,HLA-Ⅱ类(HLA-DRB1*04、HLA-DQA1)基因区发挥着主要作用,PTPN22等非HLA基因也与巨细胞动脉炎的发病相关。
关键词: 大血管血管炎; 大动脉炎; 巨细胞动脉炎; 遗传因素; 发病机制;
Abstract: Large vessel vasculitis includes Takayasu arteritis and giant cell arteritis. The pathogenesis of large vessel vasculitis remains to be clarified, though genetics, infection, environment, immune response, and other factors may be involved. In terms of genetic factor, it has been found that Takayasu arteritis is most closely related to HLA-I gene region(HLA-B*52), while genes involved in inflammation(IL12 B, IL6, RPS9/LILRB3) also play an important role. HLA-Ⅱ(HLA-DRB1*04, HLA-DQA1) gene region is mainly associated with giant cell arteritis. In addition, non-HLA genes such as PTPN22 are also related to the pathogenesis of giant cell arteritis.
Keyword: large vessel vasculitis; Takayasu arteritis; giant cell arteritis; genetics; pathogenesis;
大血管血管炎(large vessel vasculitis, LVV)主要包括大动脉炎(Takayasu arteritis, TAK)和巨细胞动脉炎(giant cell arteritis, GCA)两种类型,是主要累及主动脉及其一级分支的慢性肉芽肿性血管炎,治疗主要是糖皮质激素联合免疫抑制剂或生物制剂,预后与器官缺血性损伤的严重程度有关。与TAK相比,GCA的好发人群较为年轻化,颅内外血管受累及主动脉瘤样扩张较多见,两者对生物制剂治疗反应也存在差别。

GCA是一种免疫介导的疾病,在GCA易感人群中,潜在的危险信号导致血管树突状细胞(vascular dendritic cells, vas DCs)受损,引起T细胞活化及一系列的炎症级联反应[1];TAK的发病机制与GCA相似,主要由辅助T细胞(helper T cell, Th)1和Th17介导DC引发的炎症级联反应,与GCA发病机制不同的是,可能存在未知的刺激导致热休克蛋白65kDA(heat shock protein 65 kDA, HSP-65)过表达,引起细胞表面蛋白MICA的表达,介导血管炎症和损伤[1]。TAK和GCA的病因和发病机制复杂,包括遗传学、体液及细胞免疫、细胞因子、环境、激素、炎症性肠病等炎性疾病等。这两种类型的大血管血管炎临床表现各有特点,在遗传机制上也不尽相同,本文对TAK和GCA发病机制中遗传因素的主要研究成果进行总结(表1,2)。
1、 HLA基因区域
根据人类白细胞抗原(human leukocyte antigen, HLA)的编码蛋白结构和功能不同,将其分为Ⅰ类、Ⅱ类和Ⅲ类基因。
1.1 、HLA-Ⅰ类基因区
经典的HLA-Ⅰ类基因包括HLA-A、HLA-B、HLA-C位点,非经典的HLA-Ⅰ类基因主要是主要组织相容性复合物Ⅰ类链相关基因A(major histocompatibility complex class Ⅰchain-related protein A, MICA)与GCA相关。
1.1.1 、TAK与HLA-Ⅰ基因区
在TAK发病机制中,主要发挥作用的HLA-Ⅰ类基因是HLA-B,包括HLA-B*52和HLA-B*39。
HLA-B*52被认为是TAK发病的易感位点[2]。1977年,Naito等[3]发现并证实了HLA-B5及其Bw52亚型在日本人群中与TAK的发病密切相关。HLA-B*5201是中国、日本、韩国、土耳其、希腊(样本量较小)等国家TAK患者的共同易感基因,还与某些并发症密切相关,例如,在韩国TAK患者中与急性心肌梗死等心血管疾病显着相关[4];在日本TAK患者中与溃疡性结肠炎等炎症性肠病有关[5]。一项日本研究发现,位于HLA-B蛋白的肽结合槽的第171位组氨酸和第67位苯丙氨酸,与HLA-B*5201密切相关,其突变可能影响TAK的易感性[6]。
HLA-B*39在不同人群中的不同亚型与TAK发病相关:HLA-B*39061和HLA-B*39062亚型主要出现在墨西哥患者中[7];而日本患者则主要表现为HLA-B*3901和HLA-B*3902亚型[7];美国TAK患者则主要表现为HLA-B*3908[8]。
HLA-B*52与HLA-B*39061、HLA-B*39062内含子2的3′端末尾以及外显子3的5′端末尾部分基因序列相同,提示不同人群中易感基因的异质性,可能与一些特定的基因序列导致TAK发病有关[7]。
1.1.2 、GCA与HLA-Ⅰ基因区
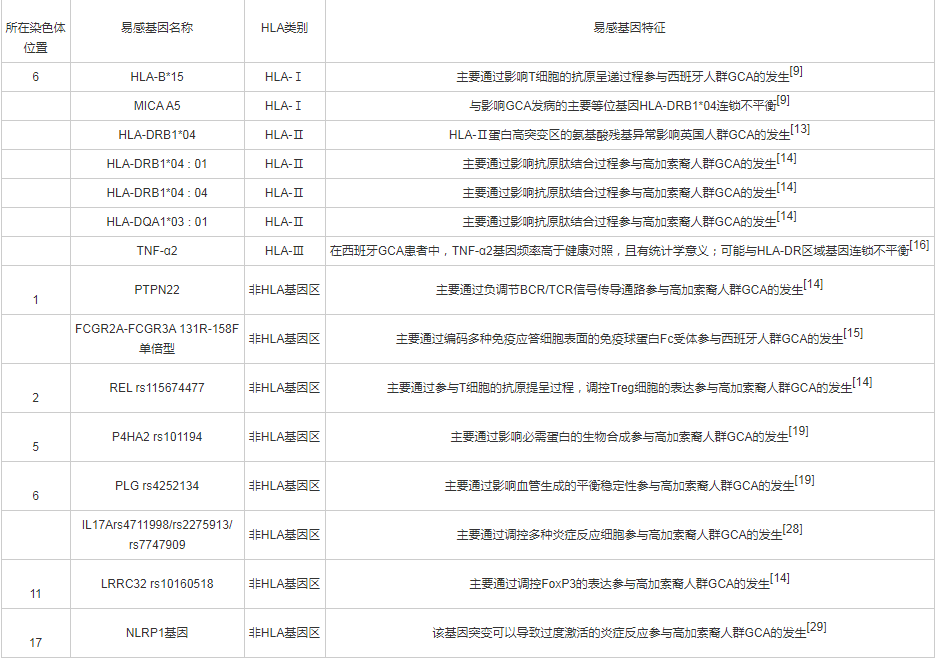
在西班牙GCA患者中,HLA-B*15的表达水平增高,主要通过影响T细胞的抗原呈递过程参与GCA的发病机制[9]。MICA位于MHC-Ⅰ类区域中,MICA A5是GCA发病的易感基因之一,与影响GCA发病的主要等位基因HLA-DRB1*04连锁不平衡[9]。同时存在HLA-DRB1*04和 MICA A5,或HLA-B*15和MICA A5,会导致GCA患病风险升高,且具有累加效应;而这些风险基因的缺失会对GCA起保护作用[9]。
1.2、 HLA-Ⅱ类基因区
经典的HLA-Ⅱ类基因包括HLA-DR、HLA-DQ、HLA-DP,每个基因座分为A、B基因,分别编码HLA-Ⅱ分子的α链和β链。
1.2.1、 TAK与HLA-Ⅱ类基因区
中国汉族人群中,TAK的易感性与HLA-DRB1*04[10]、HLA-DRB1*07[10]、HLA-DPB1*09[11]、HLA-DPB1*1701[11]等位基因相关,且HLA-DPB1*1701等位基因可能使TAK患者的发病年龄提前[11]。近期一项中国汉族TAK患者研究发现,HLA-DRB1*07表达水平增高,但HLA-DRB1*04与TAK的发病无明显关联,可能与该研究样本量较小有关(n=100)[12]。
1.2.2 、GCA与HLA-Ⅱ类基因区
GCA的疾病易感性与HLA-Ⅱ类基因关系更密切,包括HLA-DRB1和HLA-DQA1,主要影响抗原呈递和免疫细胞自我识别。在一项英国研究中,HLA-DRB1*04的基因频率与患者的发病相关,而HLA-DRB1*01和HLA-DRB1*15可能对GCA发病具有保护作用[13]。结合数据库分析,HLA-Ⅱ蛋白的第一高突变区和第二高突变区中的第11、13和33位氨基酸残基,与HLA-DRB1在GCA中的易感性有关[13]。在欧洲人群中,HLA-DRB1*04∶01、HLA-DRB1*04∶04、HLA-DQA1*03∶01均可增加GCA的患病风险[14],其中与GCA易感倾向相关性最高的等位基因是HLA-DRB1*04∶04[14]。HLA-DRβ1蛋白第13位氨基酸和HLA-DQα1蛋白第47、56、76位氨基酸分别位于各自的肽结合槽中,直接参加与抗原肽结合的过程,可能与HLA-DRB1*04和HLA-DQA1*03在GCA发病中的易感性有关[14]。
1.3、 HLA-Ⅲ类基因区
HLA-Ⅲ类基因区域位于HLA-Ⅰ类和HLA-Ⅱ类基因区域之间,主要编码炎症相关基因,包括补体系统、细胞因子以及热休克蛋白等成分。在大血管血管炎的遗传研究中,目前尚未发现TAK与HLA-Ⅲ类基因区之间的关联[15]。在西班牙GCA患者中,位于HLA-Ⅲ内的肿瘤坏死因子(tumor necrosis factor, TNF)基因区域有5个微卫星基因座a、b、c、d、e, 其中TNF-a2微卫星基因座与GCA的发病相关,该基因座对GCA发病的影响与HLA-DRB1*04无关[16]。
2 、非HLA基因区
近年来,非HLA基因区成为大血管血管炎易感性研究的热门领域,并取得了重大进展。主要分为两类:(1)调节免疫应答相关基因,主要包括:蛋白酪氨酸磷酸酶非受体22型(protein tyrosine phosphatase non-receptor type 22,PTPN22)、IgG的Fc片段受体Ⅱa(Fc fragment of IgG receptor IIa, FCGR2A)、IgG的Fc片段受体Ⅲa(Fc fragment of IgG receptor Ⅲa, FCGR3A)、v-rel网状内皮增生病毒癌基因同源物(v-rel avian reticuloendotheliosis viral oncogene homolog, REL)、脯氨酰4-羟化酶α多肽Ⅱ(prolyl 4-hydroxylase subunit alpha2,P4HA2)、纤溶酶原(plasminogen, PLG)、富含亮氨酸重复序列的蛋白32型(located in the leucine-rich repeat containing 32,LRRC32)、白细胞免疫球蛋白样受体亚家族 (leukocyte immunoglobulin-like receptor subfamily, LILR),可通过调节T/B细胞及其功能影响GCA的发病[14,15,17,18,19];(2)参与炎症反应相关基因,主要包括:白介素17A(Interleukin 17A,IL17A)、炎性小体1基因(inflammasome 1,NLRP1)、白介素12B(Interleukin 12B,IL12B)、白介素6(Interleukin 6,IL6),通过影响炎症相关细胞因子参与GCA的发病机制[17,18,20,21]。
表1 大动脉炎主要易感基因
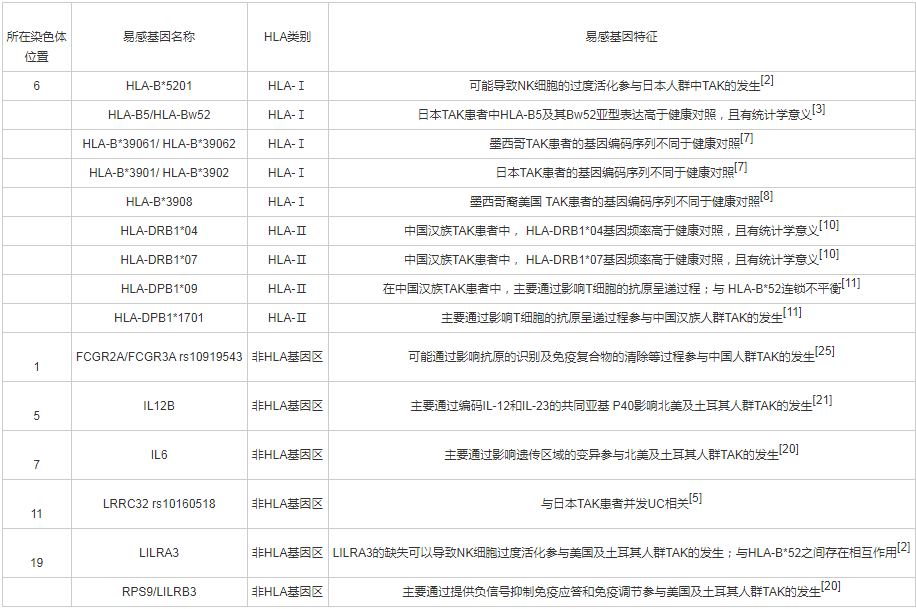
表2 巨细胞动脉炎主要易感基因
2.1、 TAK与非HLA基因区
IL12B基因位于5号染色体,编码IL-12和IL-23蛋白共同的β亚基p40[22],IL-12是促进幼稚T细胞向Th1分化的关键因素,而IL-23主要影响Th17细胞的分化[22]。IL12B rs6871626在日本人群中与TAK的疾病易感性有显着关联,可能与TAK疾病严重程度有关[21]。IL12B rs56167332和IL12B rs6871626在北美及土耳其人群中也显示出与TAK发病存在较强的关联性[23]。
IL6基因位于7号染色体,编码细胞因子IL-6。IL6基因的内含子上有一个增强子调控区域,该遗传区域的变异是TAK发病的危险因素之一[20]。在TAK患者中检测到血清IL-6的水平显着升高,抗IL-6受体拮抗剂(tocilizumab)治疗难治性TAK患者有效,提示IL-6参与TAK的发病机制[20,24]。
LILR基因家族定位于19q13.4的白细胞受体复合物(LRC)区域,由13个激活性或抑制性受体成员组成,其中LILRA3是唯一的分泌型LILR,是其他LILR家族成员的调节剂[2]。LILRA3与HLA-B*52之间存在相互作用,LILRA3的缺失可以导致NK细胞过度活化,从而导致TAK的发生发展[2]。RPS9/LILRB3基因座通常通过提供负信号来抑制免疫应答和免疫调节,增加了美国及土耳其人群的TAK发病风险[2,20]。
此外,FCGR2A/FCGR3A rs10919543在中国人群中与TAK的易感性相关[25];LRRC32 rs10160518与TAK患者并发溃疡性结肠炎有较强的相关性[5,14]。
2.2、 GCA与非HLA基因区
PTPN22基因位于1号染色体上,编码一种蛋白酪氨酸磷酸酶(Lyp),PTPN22 rs6679677/rs2476601主要通过负调节BCR/TCR信号传导通路而影响GCA的发生[14]。在高加索裔人群中,PTPN22与GCA强关联[14]。PTPN22 rs2476601(R620W)和PTPN22 rs33996649(R263Q)在西班牙GCA患者的遗传易感性中发挥着重要作用[26]。
FCGR2A和FCGR3A基因也位于1号染色体上,是免疫球蛋白基因超家族成员,编码多种免疫应答细胞表面的免疫球蛋白Fc受体影响GCA的发病[15]。FCGR2A-FCGR3A 131R-158F单倍型是与西班牙GCA患者相关性最强的易患基因,FCGR2A-131R等位基因纯合个体与不携带该等位基因的人群相比发生GCA的风险增加[15]。FCGR2A-131R的纯合性与HLA-DRB1*04阳性之间可能存在乘法联合效应[15]。
REL基因位于2号染色体上,编码NF-κB家族的c-Rel转录因子,参与T细胞的抗原提呈过程,调控调节性T细胞(Regulatory cells, Treg)的表达从而参与GCA的发病[14]。REL rs115674477在欧洲人群中与GCA的发病呈现出较强的关联性[14]。
P4HA2位于5号染色体上,编码4-脯氨酰羟化酶α亚基Ⅱ蛋白,催化脯氨酸残基形成4-羟脯氨酸(胶原生物合成所必需)。P4HA2是重要的缺氧反应基因,其表达受缺氧诱导因子1(hypoxia inducible factor-1,HIF-1)调控[19]。因此,P4HA2基因可能影响GCA的纤维化、炎症、血管重塑等病理生理过程。P4HA2 rs101194可能影响其在主动脉中的表达[19]。
PLG位于6号染色体上,编码一种血液酶原蛋白,PLG水解激活后可以转化为纤溶酶和血管抑素。纤溶酶是血管形成、淋巴细胞募集等过程中的重要蛋白酶,而血管抑素主要抑制血管生成[19]。PLG可能通过影响纤溶酶和血管抑素在血管形成过程中的相对稳定性,从而导致GCA的发生[19]。PLG内含子中的rs4252134是PLG与GCA关联性最强的位点[19]。PLG也与ANCA相关性血管炎和冠状动脉粥样硬化性心脏病相关[27],机制与PLG在GCA中的作用机制假说相似。
LRRC32 位于11号染色体上,在活化T细胞中高表达,主要通过调控转录因子叉头框蛋白P3(forkhead box P3,FoxP3)的表达而发挥作用,FoxP3主要调节Treg的发育和功能,LRRC32 rs10160518与GCA的发病密切相关[14]。
Th17在GCA的发病机制中起重要作用,Th17细胞通过产生IL-17诱导慢性炎症,IL-17激活多种表达其受体的细胞,如树突状细胞、巨噬细胞、内皮细胞和平滑肌细胞等,这些细胞参与了GCA的动脉损伤过程[28]。IL17A位于6号染色体上,编码细胞因子IL-17。IL17A上的三个单核苷酸多态性(single nucleotide polymorphism, SNP):rs4711998、rs2275913、rs7747909,增加了高加索裔人群GCA的遗传易感风险,其中rs2275913的关联性最强[18]。
炎性小体是在细胞中形成的多聚蛋白复合物,是人体中的一种应对感染原和异常生理变化的重要防御机制。NLRP1基因位于17号染色体上,参与形成NLRP1炎性小体。NLRP1基因突变可以导致过度激活的炎症反应,该突变是多种自身免疫性疾病常见的危险因素[29]。NLRP1基因与高加索裔患者的发病相关,而NLRP1 rs8182352与GCA患者的缺血性视神经病变有关[17]。
3 、小结与展望
大血管血管炎发病机制遗传方面的研究发现,HLA基因区和非HLA基因区在发病机制中均有参与。在大动脉炎中,主要是HLA-Ⅰ类分子发挥主要作用,其中HLA-B*52在不同国家的多种族患者中均表现出明显的相关性;参与炎症反应的相关基因IL12B、IL6、RPS9/LILRB3等也发挥重要作用。在巨细胞动脉炎中,主要是HLA-Ⅱ类分子发挥主要作用,其中HLA-DRB1*04∶04和HLA-DQA1关系最为密切;PTPN22等非HLA基因也发挥重要作用。 GCA与TAK在遗传基因上存在差异,可能与两者临床表现及发病机制的差异相关,为进一步研究大血管血管炎的发病机制及治疗提供新的思路,为基因治疗等新疗法提供理论依据。
参考文献
[1] Stamatis P.Giant Cell Arteritis versus Takayasu arteritis:An update[J].Mediterr J Rheumatol,2020,31:174-182.
[2] Terao C,Yoshifuji H,Matsumura T,et al.Genetic determinants and an epistasis of LILRA3 and HLA-B*52 in Takayasu arteritis[J].Proc Natl Acad Sci USA,2018,115:13045-13050.
[3] Naito S,Arakawa K,Saito S,et al.Takayasu’s disease:association with HLA-B5[J].Tissue Antigens,1978,12:143-145.
[4] Lee SW,Kwon OJ,Park MC,et al.HLA alleles in Korean patients with Takayasu arteritis[J].Clin Exp Rheumatol,2007,25:S18-22.
[5] Terao C,Matsumura T,Yoshifuji H,et al.Takayasu arteritis and ulcerative colitis:high rate of co-occurrence and genetic overlap[J].Arthritis Rheumatol,2015,67:2226-2232.
[6] Terao C,Yoshifuji H,Ohmura K,et al.Association of Takayasu arteritis with HLA-B 67:01 and two amino acids in HLA-B protein[J].Rheumatology (Oxford),2013,52:1769-1774.
[7] Rodriguez-Reyna TS,Zuniga-Ramos J,Salgado N,et al.Intron 2 and exon 3 sequences may be involved in the susceptibility to develop Takayasu arteritis[J].Int J Cardiol,1998,66 Suppl 1:S135-S138;discussion S139.
[8] Adams EJ,Little AM,Arnett KL,et al.Three new HLA-B alleles found in Mexican-Americans[J].Tissue Antigens,1995,46:414-416.
[9] Gonzalez-Gay MA,Rueda B,Vilchez JR,et al.Contribution of MHC class I region to genetic susceptibility for giant cell arteritis[J].Rheumatology (Oxford),2007,46:431-434.
[10] Dang A,Wang B,Zhang Y,et al.Association of the HLA-DRB1 gene with susceptibility to aortoarteritis in a Chinese Han population[J].Hypertens Res,2002,25:631-634.
[11] Lv N,Dang A,Wang Z,et al.Association of susceptibility to Takayasu arteritis in Chinese Han patients with HLA-DPB1[J].Human Immunology,2011,72:893-896.
[12] Lv N,Wang Z,Dang A,et al.HLA-DQA1,DQB1 and DRB1 alleles associated with Takayasu arteritis in the Chinese Han population[J].Hum Immunol,2015,76:241-244.
[13] Mackie SL,Taylor JC,Haroon-Rashid L,et al.Association of HLA-DRB1 amino acid residues with giant cell arteritis:genetic association study,meta-analysis and geo-epidemiological investigation[J].Arthritis Res Ther,2015,17:195.
[14] Carmona FD,Mackie SL,Martin JE,et al.A large-scale genetic analysis reveals a strong contribution of the HLA class II region to giant cell arteritis susceptibility[J].Am J Hum Genet,2015,96:565-580.
[15] Morgan AW,Robinson JI,Barrett JH,et al.Association of FCGR2A and FCGR2A-FCGR3A haplotypes with susceptibility to giant cell arteritis[J].Arthritis Res Ther,2006,8:R109.
[16] Mattey DL,Hajeer AH,Dababneh A,et al.Association of giant cell arteritis and polymyalgia rheumatica with different tumor necrosis factor microsatellite polymorphisms[J].Arthritis Rheum,2000,43:1749-1755.
[17] Serrano A,Carmona FD,Castaneda S,et al.Evidence of association of the NLRP1 gene with giant cell arteritis[J].Ann Rheum Dis,2013,72:628-630.
[18] Marquez A,Hernandez-Rodriguez J,Cid MC,et al.Influence of the IL17A locus in giant cell arteritis susceptibility[J].Ann Rheum Dis,2014,73:1742-1745.
[19] Carmona FD,Vaglio A,Mackie SL,et al.A Genome-wide Association Study Identifies Risk Alleles in Plasminogen and P4HA2 Associated with Giant Cell Arteritis[J].Am J Hum Genet,2017,100:64-74.
[20] Renauer PA,Saruhan-Direskeneli G,Coit P,et al.Identifica-tion of Susceptibility Loci in IL6,RPS9/LILRB3,and an Intergenic Locus on Chromosome 21q22 in Takayasu Arteritis in a Genome-Wide Association Study[J].Arthritis Rheumatol,2015,67:1361-1368.
[21] Matsumura T,Amiya E,Tamura N,et al.A novel susceptibility locus for Takayasu arteritis in the IL12B region can be a genetic marker of disease severity[J].Heart Vessels,2016,31:1016-1019.
[22] Nakajima T,Yoshifuji H,Shimizu M,et al.A novel suscepti-bility locus in the IL12B region is associated with the pathophysiology of Takayasu arteritis through IL-12p40 and IL-12p70 production[J].Arthritis Res Ther,2017,19:197.
[23] Saruhan-Direskeneli G,Hughes T,Aksu K,et al.Identification of multiple genetic susceptibility loci in Takayasu arteritis[J].Am J Hum Genet,2013,93:298-305.
[24] Nakaoka Y,Isobe M,Takei S,et al.Efficacy and safety of tocilizumab in patients with refractory Takayasu arteritis:results from a randomised,double-blind,placebo-controlled,phase 3 trial in Japan (the TAKT study)[J].Ann Rheum Dis,2018,77:348-354.
[25] Qin F,Wang H,Song L,et al.Single Nucleotide Polymorphism rs10919543 in FCGR2A/FCGR3A Region Confers Susceptibility to Takayasu Arteritis in Chinese Population[J].Chin Med J (Engl),2016,129:854-859.
[26] Lester S,Hewitt AW,Ruediger CD,et al.PTPN22 R620W minor allele is a genetic risk factor for giant cell arteritis[J].RMD Open,2016,2:e000246.
[27] Schaefer AS,Bochenek G,Jochens A,et al.Genetic evidence for PLASMINOGEN as a shared genetic risk factor of coronary artery disease and periodontitis[J].Circ Cardiovasc Genet,2015,8:159-167.
[28] Samson M,Audia S,Fraszczak J,et al.Th1 and Th17 lymphocytes expressing CD161 are implicated in giant cell arteritis and polymyalgia rheumatica pathogenesis[J].Arthritis Rheum,2012,64:3788-3798.
[29] Zhong FL,Mamai O,Sborgi L,et al.Germline NLRP1 Mutations Cause Skin Inflammatory and Cancer Susceptibility Syndromes via Inflammasome Activation[J].Cell,2016,167:187-202 e117