摘 要: 母性行为是一种复杂的高度进化保守的基础社会行为,研究母性行为与子代发育的关联,是妇幼保健优生优育工作的基础。本文介绍了以内侧视前区为中心的母性行为基本神经环路,性激素、催产素、精氨酸后叶加压素等调控因子的作用,从母体基因风险和负面环境经历讨论了异常母性行为的发生,及其对子代神经发育的影响。
关键词 : 母性行为;神经-内分泌;激素;子代发育;综述;
Abstract: Maternal behavior is a complex and highly evolutionary conservative basic social behavior, relationship between maternal behavior and the development of offspring is the foundation of eugenic maternal and child health care.This article introduces the basic neural circuit for maternal behavior centered on the medial preoptic area(MPOA),the role of sex hormones, oxytocin, arginine-vasopressin and other regulatory factors, then discusses the occurrence of abnormal maternal behavior induced by maternal genetic risks and negative environmental experience and the interference on the neurodevelopment of offspring.
Keyword: maternal behavior; neuroendocrine; hormone; offspring development; review;
为了实现遗传信息的传递及物种的延续与发展,大部分哺乳动物在进化上表现出高度保守的亲代养育行为(parental behavior),以保证后代的生存质量。哺乳动物中,从怀孕到生产以及产后对幼崽的哺乳和护理这个过程中,母亲通常承担着亲代养育的主要责任,而大部分父亲则表现出无视甚至攻击幼崽的行为,因此母性行为(maternal behavior)在亲代养育行为中占据着重要的地位。母性行为从发生到功能执行,同时受到源于自身的动机驱动与环境刺激的诱发驱动,并伴随着复杂的神经调控。由于成为母亲的过程中存在巨大的生理改变和心理压力[1],有一部分母亲由于自身疾病或负面经历在产后表现出焦虑或抑郁情绪,并且这种负面情绪会直接影响子代的早期发育[2]。于子代而言,母婴关系是哺乳动物的基本社会关系之一,母婴纽带的建立是哺乳动物种内社会关系建立的基础神经调控模板[3],并且母亲的照料可以提供充分的刺激和训练,使婴儿在运动、感知、认知和社会情绪能力等方面得到良好发展。因此母性行为的研究对于产妇的产前预防、产后护理以及子代的早期发育都有着重要的意义。
1 、文献检索资源与检索策略
以“母性行为/maternal behavior”(包括maternal care, motherhood, mother-child attachment)和“神经内分泌/Neuroendocrine”、“子代发育/offspring development”以及孕产期负面因素(包括“围产期压力/prenatal stress” ,“母体免疫激活/ maternal immune activation”,“产后抑郁/postpartum depression”)为关键词,检索了PubMed数据库,检索条件:(“maternal behavior”[Title/Abstract] OR “motherhood”[Title/Abstract] OR “mother child attachment”[Title/Abstract] OR “maternal care”[Title/Abstract]) AND (“neuroendocrine”[Title/Abstract] OR “offspring development”[Title/Abstract] OR(“prenatal stress”[Title/Abstract] OR “maternal immune activation”[Title/Abstract] OR “postpartum depression”[Title/Abstract])),共获得文献440篇,近五年发表的文献有154篇,其中原始研究论文128篇,明确母性行为与子代发育关联有26篇;检索维普中国科技期刊数据库,以“母性行为+孕产妇行为+ maternal behavior”为关键词检索到138篇,联合“子代+offspring+幼崽”检索到21篇,明确与本主题相关的仅有15篇,近五年内发表为6篇。可以发现,涉及关联母性行为与子代发育的内容多为国外报道,国内目前尚缺乏相关的系统研究和综述。因此本文将回顾前人的研究,阐述哺乳动物母性行为的基础调控以及异常母性行为对子代发育的影响,希望能够对妇幼保健工作提供帮助。

2、 母性行为简介
2.1 、母性行为表现
雌性个体从青春期到性成熟的整个发育过程中都具备表现出母性抚育(maternal care)的能力。在非人哺乳动物中,根据是否与幼崽互动,可将一系列母性行为分为两大类,幼崽直接相关(young-directed responses)与幼崽非直接相关(non-directed maternal behaviors),见表1。
表1 哺乳动物母性行为分类[4]
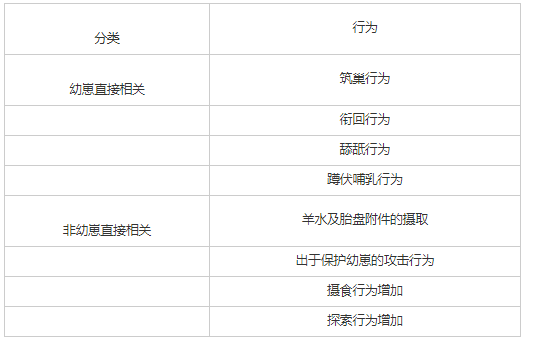
在分娩之前,母性行为主要表现为筑巢以及针对于入侵者的攻击行为。巢穴为新出生的幼崽提供温暖适宜的环境,处于对自身生存资料和生存环境安全的保障,妊娠期母亲对陌生入侵者的应激反应升高。母性行为表现在分娩时达到峰值,母亲会积极反应新生儿发出的信号,并在分娩时摄取羊水并食用幼崽的胎盘附件。这些行为为分娩后虚弱的母亲提供了营养补充,并且胎盘可以促进泌乳素的分泌,对于后续母性行为的调控有着积极作用。于后代而言,去除胎盘等附件、舔舐幼崽、保持幼崽生存环境干燥清洁,有利于幼崽的生长。在分娩后的哺乳期,大部分哺乳动物[5]表现出针对于幼崽的一系列反应,例如衔回散落的幼崽、舔舐清理幼崽皮肤、舔舐幼崽生殖器以促进幼崽的排泄、蹲伏哺乳等积极的护理反应。与之相对的非幼崽直接相关的行为,包含了母亲自身生存资料的收集(包括由于哺乳而增加的摄食量)、对于环境的探索、对于入侵者的攻击行为。在维护自身生存质量与保持幼崽的健康成长之间达到平衡,也是产后母性行为执行过程中的一个重要的部分。
在人类的母性行为研究中,通常以母乳喂养为筛选条件,选择以母亲为主要照顾者的家庭,进行相关的心理学研究,由于伦理的限制,主要局限于心理行为学中的母性反应性(maternal responsiveness)研究[6],从视觉、听觉及互动等多方面评估产妇对婴儿做出的母性反应。例如,通过给予婴儿面部情绪图片、婴儿的声音刺激来评估产妇对于婴儿的情绪反应;或通过与自己的婴儿或与陌生婴儿之间的互动,来评估产妇母性行为的执行功能。一项关于产妇母性行为的跨文化调查中,通过研究产妇对婴儿的抚触,声音交流以及对婴儿注意力程度,发现母亲们在感受婴儿需求、与婴儿进行沟通、喂养婴儿的方式上存在很大差异[7]。尽管早期孕产妇行为会受到社会环境中文化差异的影响,但许多研究还是提出了人类孕产妇行为的普遍模式。例如,母亲的反应与特定的婴儿行为有着高度的关联:哺乳行为与婴儿负面情绪的声音紧密关联,引导模仿学习的行为与婴儿非负面情绪的声音紧密关联。无论孕产妇的行为方式由于社会环境产生了怎样的差异,所有母性反应的共性都是确保婴儿的生存质量。
2.2、 母性行为基础神经调控
母性行为的发生和执行受到内分泌和神经系统的复杂调控,由Bridges[4]首先提出了母性行为的内分泌-神经基础理论。母亲妊娠和分娩期间的激素水平变化是启动母性行为的关键因素,外周分泌的激素作用于中枢神经系统,调节母亲对幼崽刺激的反应,以启动下游神经化学水平的调控,实现母性抚育的功能执行。参与母性行为调控的激素主要有雌激素、孕酮、催乳素。雌激素是激素调控系统的基本组成部分,对于哺乳动物的母性行为的发生具有决定性的关键作用,因为其他激素调控分子(如孕酮、催乳素、催产素)只有在同时暴露于雌激素时,才可以发挥相关的作用。孕酮在调节母体行为的表达和催乳中起着重要作用[8],它可以增加母亲大脑的兴奋性,使其在分娩时对于来自幼崽的刺激更加敏感。催乳素和胎盘催乳素主要功能是刺激乳汁分泌,于此同时催乳素还能调节视上核中的催产素能神经元和中脑边缘多巴胺-伏隔核系统,帮助刺激母性行为的发生。
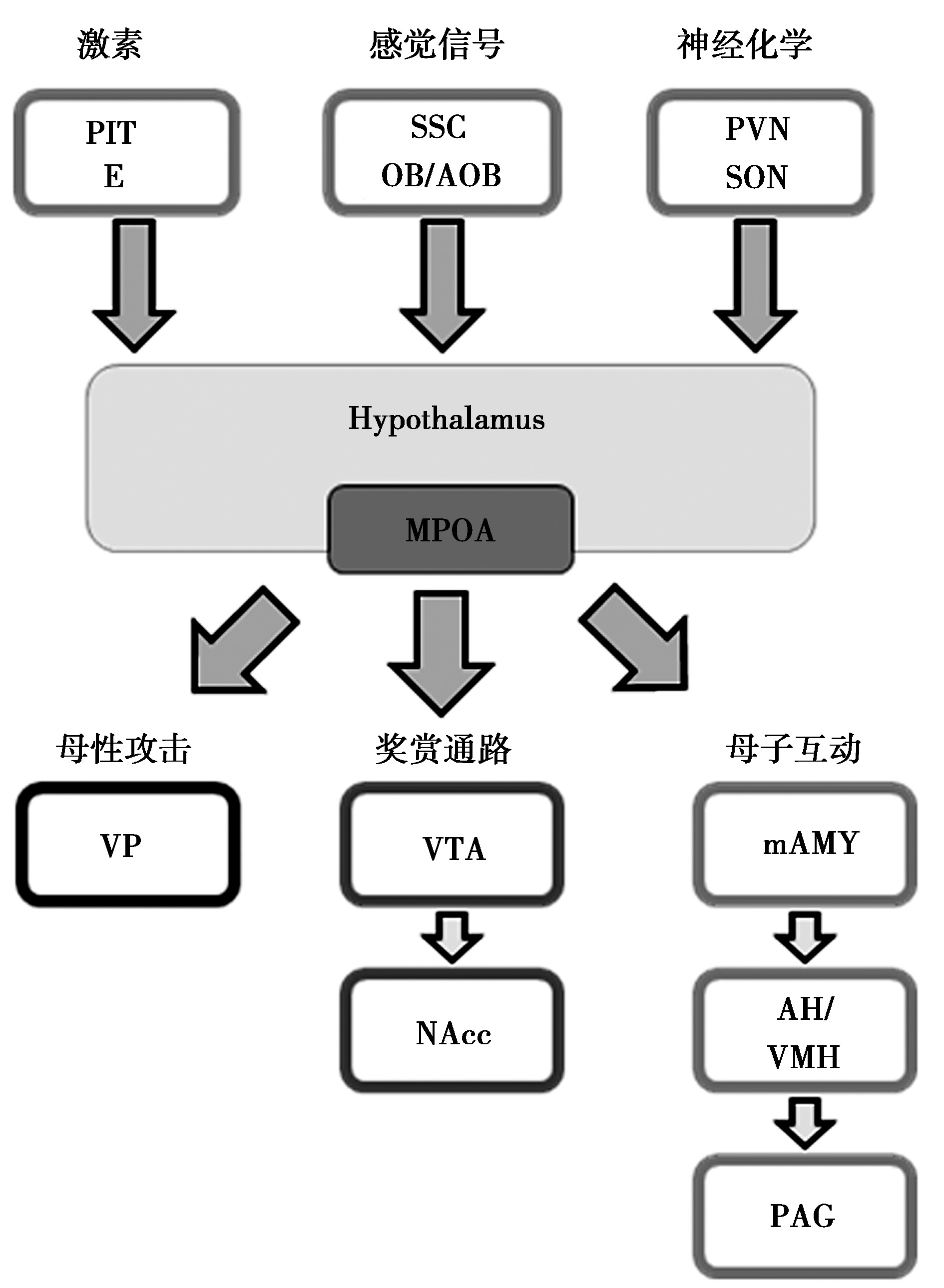
下丘脑的内侧视前区(medial preoptic area, MPOA)[9]是母性行为调控的核心脑区,是接收外部刺激,调控功能执行的关键整合部位,见图1。MPOA不仅从垂体(pituitary, Pit)、卵巢等外周内分泌器官(peripheral endocrine, E)中接收来自外周激素的刺激,也接收来自神经系统的刺激,包括由感觉皮层(somatosensory cortex, SSC)[10]传入的幼崽刺激,嗅觉系统(olfactory system/accessory olfactory system, OB/AOB)[11]传入的幼崽信息以及由视上核(paraventricular nucleus, PVN)和室旁核(supraoptic nucleus, SON)分泌的神经递质。MPOA将复杂的输入信号进行整合,以刺激下游母性护理行为的发生:通过建立幼崽刺激与社交参与的奖励系统,即中脑腹侧被盖区(ventral tegmental area, VTA)至伏隔核(nucleus accumbens, NAcc)[12]之间的连接,刺激中脑边缘多巴胺奖赏系统,增强了母亲在母性行为过程中获得的奖赏并巩固母性记忆,以增强母性行为的动机,同时抑制了腹侧苍白球(ventral pallidum, VP)的神经活动,调控非幼崽直接母性行为的发生;激活内侧杏仁核(medial amygdala, mAMY)以启动与幼崽之间的社交互动,抑制下丘脑前部/腹侧下丘脑(anterior hypothalamus/ ventromedial hypothalamus, AH/VMH)-导水管周围灰质(periaqueduct gray matter, PAG)[13]环路降低母亲的幼崽回避行为,实现母性行为的功能执行。
图1 母性行为的基础中央环路[4]
此外,已知许多基础神经递质都参与介导母性行为的发生,包括催产素(oxytocin, OXT)、精氨酸后叶加压素(arginine-vasopressin, AVP)、经典神经递质多巴胺(dopamine, DA)和5-羟色胺(5-hydroxytryptamine, 5-HT)。OXT的主要功能为介导母婴联结的形成、增强母性护理。一些临床研究表明,OXT水平的增加与母亲依恋的程度有关[14];妊娠前3个月的OXT水平能够预测产后母性行为水平的高低,人类母亲在高水平情感接触的母婴互动后表现出血浆OXT的增加[15]。AVP的主要功能是调节母性攻击行为,提高母亲在受到干扰时的防御水平,与母亲自身的焦虑水平相关联[16]。DA与5-HT都是通过社交奖赏通路参与到母性行为的调节[17]:DA激活了母性护理的动机,血清素5-HT浓度与母性护理效果呈正相关,激活5-HT1B受体可以实现由OXT诱导的突触可塑性[18],这种神经化学系统普遍地反映了包括母亲护理在内的依恋关系的建立过程。
3 、异常母性行为的发生及对子代的影响
3.1、 异常母性行为的可能诱因
导致异常母性行为的原因是多种多样的,某些母性行为关键分子的突变是内源性的诱因之一。有临床研究表明[19],某些突变会使雌激素受体基因(ERS1)的表达降低,具有这种突变的母亲们的育儿习惯更严苛。在一项关于产妇催产素受体(oxytocin receptor, OXTR)的临床研究中发现,OXTR表达水平更高的母亲,育儿质量以及对孩子图像的神经反应也明显更好[20]。
孕期或哺乳期受到负面环境影响也是造成母性行为异常的原因,常见的两种因素是环境压力和妊娠期母体免疫激活。压力对于母性行为最直接的影响就是会抑制泌乳素的分泌,直接影响哺乳行为以及妊娠期间的神经元发育,进而导致产后焦虑增加和产后护理行为较差[21]。一些临床研究表明[22],母亲育儿期间承受的压力水平与其对婴儿图像的母性反应明显相关,降低母亲的焦虑水平,会使母婴依恋增加。压力产生的负面影响主要通过下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis, HPA)的功能实现,压力会激活HPA轴使母亲体内的皮质醇水平增加,进而降低母亲对婴儿啼哭的神经反应[23]。VTA等涉及母性动机的脑区激活可以降低HPA轴对压力的反应,与之伴随着外侧前额叶和背侧前扣带等边缘系统的激活[24],证明了压力主要通过影响母亲的情绪调节,进而影响母性反应性表现。
母体免疫激活是一个经典的“生命早期逆境”模型,常用来研究早期经历逆境对个体发育的影响。有研究者认为[25],母体免疫激活是通过影响母性行为,进而对子代神经发育造成损伤。妊娠期免疫系统激活的母鼠,舔舐幼崽的时间显着减少,而舔舐幼崽的频率影响了幼崽DNA甲基化和组蛋白乙酰化的修饰水平,使后代的ERS1基因转录因子降低,影响MPOA雌激素受体系统的表达,对母性行为质量产生一个代代传递的负面影响。目前临床上没有直接关联母体免疫激活与母性行为的研究,但是已经明确母体免疫激活与子代神经系统疾病的关联。在某些以双胞胎为对象的自闭症和精神分裂症的研究发现[26],出生于流感发生季节(12月至5月)的新生儿中,精神分裂症发病率增加。
3.2 、异常母性行为对子代的影响
常见的异常母性行为研究,集中在产后焦虑、抑郁情绪对于母性行为的干扰。临床研究表明,大约15%~25%的女性会在妊娠期经历较为严重的焦虑和抑郁[27],而糟糕的情绪状态会破坏母亲的认知功能,导致患者无法正常表达母性行为。临床研究发现,约27%~38%的母亲在产后出现不同程度的抑郁症状,而产后抑郁会破坏患者的情绪表达能力,使患者的母性行为较差[28],在随后的育儿中更少地表现出对自身情绪的积极陈述和对他人情绪的正确判断,在与孩子互动中无法正确及时地捕捉孩子的情感变化,甚至拒绝互动。临床研究发现[28],患产后抑郁的母亲母性行为质量低下,影响了子代的情感表达能力,加重了子代患精神疾病的风险。对于孤独症儿童家庭的研究表明[29],家庭中孤独症儿童的存在使母亲的压力、焦虑和抑郁增加,这种不良的精神状况会导致孤独症儿童母亲的育儿行为受损,育儿行为的损伤又会对子代从早期发育到成年的身心健康和精神病理状况产生不利影响,从而不利于孤独症孩子的病症缓解。
异常的母性行为会对子代的整体健康和中枢神经系统发育方面产生影响,研究显示[30]母亲的养育行为和情绪状况异常可能会导致子代的内化问题增多,认知功能不良,语言发育下降,发育迟缓,抑郁、焦虑、多动症和孤独症症状的风险增加。患有抑郁症的母亲,其子代象征着情绪反应性和表现力的迷走神经张力较低,正常母亲的子代在3~6月龄时期迷走神经张力发育增加,但这种增加在抑郁症母亲的子代中却没有出现,并且他们在习惯、定向、运动、自主神经稳定性等方面都表现较差,出现抑郁样行为的概率更大[31]。抑郁症母亲的子代右侧额叶的体积更大并且脑电图不对称,这种症状被视为行为抑制和消极情感的早期标志,此外子代身上观察到的右额叶脑电图激活模式,与婴儿期的情绪失调、学龄前阶段缺乏同理心,甚至成年后的精神病理相关联[32]。被具有异常母性行为母亲养育的子代神经递质水平也与正常母亲养育的孩子有差异,他们的皮质醇和去甲肾上腺素的水平增加,5-HT水平下降。这些由于母性行为异常所导致的子代神经生理学的差异不仅反映了子代的大脑早期发育受损、处理信息异常,而且预测了子代成年后的情绪改变。有进一步行为研究表明[33],抑郁症母亲的孩子在面部表情建模程序中表现较差,大惊小怪和哭闹的时间增多,并表现出更多的应激行为。除了神经发育相关的直接证据,母性行为异常以及养育不当的行为与孩子较低的健康营养状态相关,而这种低水平的健康营养状态又与孩子认知功能的降低相关。因此,行为异常、情绪异常的母亲,她们的孩子的神经发育会受到明显的影响,可能更频繁地表现出行为抑制并表现消极的性格,患情绪和行为问题的风险增加。
4 、展 望
目前临床针对于异常母性行为的治疗与研究并不常见,大多都基于产后抑郁这类关乎产妇自身心理疾病的治疗,并且由于对胎儿潜在的负面影响,许多女性妊娠期乃至哺乳期并不愿意选择药理干预,因此临床上的研究少之又少,并且大部分集中在母亲情绪表现的改善[34],而非母性行为表达效果的关注。一些产后抑郁的研究表明,服用抗抑郁药物的确可以缓解产妇的抑郁表现[35],一定程度上可能缓解抑郁带来的母性行为损害,但有动物研究发现,很多临床上常用的抗精神病药物甚至会破坏一种或几种母性反应[36]。此外精神病药物对于后代的影响目前颇具争议,有临床研究发现[37]妊娠期受到抗抑郁药暴露的儿童患注意力缺陷多动障碍、先天性心脏缺陷和肺动脉高压的风险增加。接受OXT治疗的产后抑郁妇女中,她们与婴儿之间的母婴连接增强了,并且在有陌生人的社交干扰时,她们对婴儿的保护行为也得到了提升[38],但是对于产妇本身情绪状况的改善没有提到。因此,针对于异常的母性行为,迫切需要开发更好的疗法,既要改善产妇的本身的情绪状态,也应该以维持产后的母婴连接为治疗目标。
通过了解调节母性行为的内分泌-神经基础环路,我们可以更好地研究产后抑郁症和焦虑症之类异常母性行为发生的潜在病因。尽管对母性行为的神经内分泌-神经网络模型目前还不能完整描述,但是关于母性行为的研究对调节异常护理行为、预防其子代的各类神经发育疾病(例如抑郁症、孤独症和精神分裂症)有着重要的意义,这对于临床的妇幼保健与优生优育工作的开展至关重要。
参考文献
[1]杨瑜,李鸣,陈红母性应激对母性行为和心理功能的影响[J]心理科学进展, 2020,28(1):128-140.
[2]党永辉,阎春霞,陈腾母爱行为影响子代的表观遗传机制[J]遗传, 2011,33(9):919-924.
[3] Insel TR,Young LJ.The neurobiology of attachment[J.Nat Rev Neurosci,2001,2(2):129-36.
[4] Bridges RS Neuroendocrine regulation of maternal behavior[J] Front Neuroendocrinol,2015,36: 178-96 doi:10. 1016/jyfrne.2014.11.007.
[5] Levy F.Neuroendocrine control of maternal behavior in non-human and human mammals[J].Ann Endocrinol (Paris),2016772)114-25.
[6] Rosenblatt JS .Psychobiology of maternal behavior.contribution to the clinical understanding of maternal behavior among humans[J].Acta Paediatr, 1994,(Suppl 397):3-8. doi:10.111j.1651-2227. 1994. tb13259.x.
[7] Minde KK,Marton P,Manning D,et al. Some determinants of mother-infant interaction in the premature nursery[J].J Am Acad Child Psychiatry, 1980,19(1):1-21.
[8] Grieb ZA, Tierney SM,Lonstein JS. Postpatum inhibitin of ovarian steroid action increases aspects of maternal caregiving and reduces medial preoptic area progesterone receptor expression in female rats[J].Horm Behav,2017,96:31-41 doi:10. 1016/j.yhbeh 2017.08.007.
[9] Kohl J,Babayan BM,Rubinstein ND,et al.Functional circuit architecture underlying parental behaviour[J]. Nature,2018, 56(7701):326-331.
[10]Rothschild G,Cohen L,Mizrahi A,et al. Elevated correlations in neuronal ensembles of mouse auditory cortex following parturition[J]J Neurosci,2013,33(31):12851-61.
[11]Corona R,Meurisse M,Comilleau F,et al.Disruption of adult olfactory neurogenesis induces deficits in maternal behavior in sheep[J] Behav Brain Res,2018,347:124-131. doi:10.1016/j. bbr.2018.02.043.
[12]D' cunha TM,King SJ,Fleming AS,et al. Oxytocin receptors in the nucleus accumbens shell are involved in the consolidation of maternal memory in postpartum rats[J]Horm Behav,2011,59(1):14-21.
[13]Noriuchi M,Kikuchi Y,Mori K,et al. The orbitofrontal cortex modulates parenting stress in the maternal brain[J]. Sci Rep 2019,9(1):1658.
[14]邸天琪,黄昱静,军催产素对产后抑郁症患者母性行为的调节作用[J.心理科学进展, 2020,28(3)-.456-464.
[15]Feldman R. Oxytocin and social afilitini in humans[J]. Horm Behav,2012,61(3):380-91.
[16]Bayerl DS. Bosch OJ .Brain vasopressin signaling modulates aspects of maternal behavior in lactating rats[J] Genes Brain Behav,2019, 18(1):e12517.
[17]Gao J.Chen L,Li M.5-HT(2A) receptors modulate dopamine D(2)-mediated maternal effects[J] Pharmacol Biochem Behav,2019,180:32-43. doi: 10.1016/j pbb. 2019.03.003.
[18]Cservenak M, Bodnar l,Usdin TB,et al.Tuberoinfundibular peptide of 39 residues is activated during lactation and participates in the suckling-induced prolactin release in rat[J]. Endocrinology 2010,151(12):5830-40.
[19]Lahey BB,Michalska KJ,Liu C,et al.Preliminary genetic imaging study of the association between estrogen receptor-a gene polymorphisms and harsh human maternal parenti
ng[J].Neurosci Lett,2012,525(1):17-22.
[20]Julian MM,King AP,Bocknek EL,et al.Associations between oxytocin receptor gene (OXTR) polymorphisms, childhood trauma,and parenting behavior[J].Dev Psychol,2019.55(10):2135-2146.
[21]Babb JA,Carini LM,Spears SL,et al.Transgenerational effects of social stress on social behavior, corticosterone, oxytocin, and prolactin in rats[J.Horm Behav,2014.65(4):386-9
[22]Dudin A,Wonch KE Davis AD,et al.Amygdala and affective responses to infant pictures:Comparing depressed and non-depressed mothers and non-mothers[J]J Neuroendocrinol,2019,31(9):e12790.
[23]Laurent HK, Stevens A,Ablow JC Neural correlates of hypothalamic-pituitary-adrenal regulation of mothers with their infants[J] Biol Psychiatry,2011,70(9):826-32.
[24]Musser ED,Kaiser-Laurent H,Ablow JC.The neural correlates of maternal sensitivity:an fMRI study[J].Dev Cogn Neurosci,2012,2(4).428-36.
[25]Berger S,Ronovsky M,Horvath O,et al.Impact of maternal immune activation on maternal care behavioroffspring emotionality and intergenerational transmission in C3H/He mice[J] .Brain Behav Immu,2018,70:131-140 doi: 10.1016/j bbi.2018.02. 008.
[26]Pepper EJ,Pathmanathan S,Mcilrae S,et al.Associations between risk factors for schizophrenia and concordance in four monozygotic twin samples[J] Am J Med Genet B Neuropsychiatr Genet,2018, 177(5):503-510.
[27]Alderdice F,Mcneill J,Lynn F.A systematic review of systematic reviews of interventions to improve maternal mental health and well-being[J]. Midwifery,.2013.,29(4)-389-99.
[28]Norcross PL,Leerkes EM,Zhou N. Examining pathways linking maternal depressive symptoms in infancy to children' s behavior problems.the role of maternal unresponsiveness and negative behaviors[J].Infant Behav Dev,2017 ,49:238-247. doi: 10.1016/j.infbeh.2017.09 009.
[29]Hayes SA,Watson SL.The impact of parenting stress:a meta-analysis of studies comparing the experience of parenting stress in parents of children with and without autism spectrum disorder[J]J Autism Dev Disord,2013,43(3);:629-42.
[30]Lau BYB,Layo DE ,Emery B,et al.Lateralized expression of cortical perineuronal nets during maternal experience is dependent on MECP2[J]. eNeuro.2020,7(3):ENEURO 0500-19.2020. doi:10.1523/ENEURO .0500-19.2020.
[31]Gentile S. Untreated depression during pregnancy:short- and long-term effects in offspring.A systematic review[J] Neuroscience,2017,342: 154-166 doi:10.1016/j.neuroscience.2015. 09.001.
[32]Riekki TTN,Veijola J,Murray GK, et al. Severe mood disorders and schizophrenia in the adult offspring of antenatally depressed mothers in the Northern Finland 1966 Birth Cohort:relationship to parental severe mental disorder[J].J Affect Disord,2019,249:63-72. doi:10. 1016/j jad.2019.02.011.
[33]Hjorth S, Bromley R,Ystrom E, et al.Use and validity of child neurodevelopment outcome measures in studies on prenatal exposure to psychotropic and analgesic medications-A systematic review[J] PLoS One,2019,14(7):e0219778.
高通量测序技术的飞速发展为研究非编码RNA提供了极大便利,鉴于非编码RNA在生殖系统发育调控中的重要作用,关于其调控机制的阐明也成为目前的研究热点,引起了人们极大的关注。...