摘 要: [目的]规模化养殖螺旋藻 (Spirulina sp.) 联产营养均衡食品、功能保健品和药品已日益发展为一种工农融合的新型产业。培育高产高效优质藻种始终是螺旋藻产业发展的主攻领域。[方法]从规模化螺旋藻养藻池水体分离纯化到一株优异的螺旋藻变异株Sp-SX07。生物量和藻蓝蛋白含量等测定显示, 该藻株生物量大、生长速度快、藻蓝蛋白含量丰富。通过对不同光质、光照强度、pH值、温度等培养条件下该藻株生产特性的测试, 建立了该藻株优化培养的主要参数。[结果]在LED暖白光 (光暗比12h/12h) 、光照强度4 000lx、温度25~30℃、起始pH 8.5~9.5之间生长良好, 连续培养12d平均日生长量为0.87g·L-1, 比出发株Sp-SX02高45%。藻蓝蛋白含量达藻粉干重23.69%, 比出发株高42%左右。[结论]优异螺旋藻藻株Sp-SX07的鉴定及优化培养参数的建立为该优异藻株商业化生产及富含藻蓝蛋白的功能食品研发提供了科学依据。
关键词: 螺旋藻; 藻株分离与鉴定; 藻蓝蛋白; 优化培养;

Abstract: [Objective]As a new type of industrial-agricultural integrated industry, the growing importance of large-scale cultivation of Spirulina sp.has been noticed, which served as a source of balanced dietary food, functional healthy products and medicines.Breeding of algae species with good characteristics such as high yield, high quality, and high efficiency consistently play a crucial role for the development of the spirulina industry.[Methods]In present study, a new spirulina strain, Sp-SX07, was isolated and purified from a large-scale cultivation pool of spirulina.Analysis on biomass and phycocyanin content showed that the new variant strain produced high biomass with a fast growth rate and high content of phycocyanin.The production characteristics of the new strain were determined at different light qualities and intensities, pH value, temperature, and other culture conditions, and the main parameters of the optimized cultivation condition for the algal strain were established.[Results]Maximal growth rate of algal mass during 12 cultivation days was reached up to 0.87 g·L-1 which was 45% higher than the wild-type strain under the conditions with LED warm white light (light and dark ratio 12∶12) at light intensity of 4 000 lx coupled with temperature at 25~30℃ and the initial pH of 8.5~9.5.The phycocyanin content in the new strain was 23.69% (w/w, dry weight) , which was 42% higher than the wild-type strain.[Conclusion]The identification of Sp-SX07, an excellent spirulina strain, and the establishment of optimized culture parameters provide scientific support for the commercial production of the new strain and the development of functional foods riched in phycocyanin.
Keyword: Spirulina sp.; New strain; Phycocyanin; Optimized cultivation condition;
螺旋藻 (Spinulina sp.) 是一种光自养的原核植物[1], 属于蓝藻门、颤藻科、节旋藻属。藻体多为单列细胞组成的不分枝丝状体, 呈疏松或紧密的有规则螺旋状。螺旋藻细胞内含有大量藻蓝素, 藻细胞多为蓝绿色[2]。螺旋藻可分布于各种生态环境, 但多数在阳光充足 (2 500~3 000lx) 、气候温暖 (30~40℃) 、高碱性 (pH 8.0~9.8) 或高盐度水体中才能快速生长获得高生物量。迄今, 已发现38种螺旋藻, 大规模人工养殖的主要为钝顶螺旋藻 (Spirulina platensis) 和极大螺旋藻 (Spirulina maxima) [3]。
螺旋藻蛋白质含量高达50%~70% (干重) , 是所有天然食品中蛋白含量最高的, 其蛋白含量相当于鸡蛋的6倍、牛肉的3.3倍、大米的10倍和大豆的1.68倍[4]。螺旋藻油脂含量1.5%~6%, 多为γ-亚麻酸等不饱和脂肪酸[5]。碳水化合物含量为15%~20%, 主要以多糖类的形式存在。此外, 螺旋藻还含有丰富的维生素、类胡萝卜素、矿物质以及多种生物活性物质。螺旋藻细胞缺少纤维素细胞壁成分, 细胞营养物质易于人体消化吸收[6]。张文等[7]提到螺旋藻被誉为“21世纪最佳的理想食品”和“人体的超级营养包”。螺旋藻因其营养丰富而被广泛应用于食品、医疗保健、饲料等众多领域[8]。
与诸多植物蛋白是不易吸收的醇溶性蛋白不同, 螺旋藻蛋白质全部为水溶性, 利于人体吸收, 藻体消化率高达84%以上[7]。螺旋藻中除含有一般的营养性蛋白外, 还含有约17%的具有特殊生理功能和医疗保健功能的色素蛋白质———藻蓝蛋白 (Phycocyanin, PC) [9]。藻蓝蛋白是自然界中稀有色素蛋白之一, 颜色鲜艳, 是一种营养丰富的蛋白质, 其氨基酸组成齐全, 8种人体必需氨基酸含量高, 是一种极好的天然食用色素和保健食品[10]。藻蓝蛋白具有调节、合成人体代谢所需要的多种重要的酶, 有进人体细胞再生、保养卵巢、促进人体内合成弹力蛋白等重要作用, 同时还具有调节人体免疫系统、增强免疫系统功能、提高人体对疾病的抵抗力和抑制癌细胞生长的功效, 被食品专家形象地誉为“食物钻石”[11]。因此, 藻蓝蛋白含量是螺旋藻育种和营养保健品研发的一项重要指标。因此研究如何加快螺旋藻生长、提高其藻蓝蛋白含量具有重要意义。
规模化人工养殖螺旋藻联产富营养食品、功能保健品以及其他高附加值产品已发展为现代农业及生物经济的新兴产业, 也是我国大健康产业战略实施的重要组成部分[12]。然而, 螺旋藻商业化生产中仍存在如藻种退化、变异和混杂, 生长慢, 加工程度低和产品附加值提升少等问题。筛选和培育生长快、产量高、抗逆性和适应性强、藻蓝蛋白含量高的螺旋藻藻株可为螺旋藻产业提质增效奠定优异种质基础。
本研究从室外多年螺旋藻养殖塘水体中筛选分离到藻蓝蛋白含量高、生物量大、生长快和适应强的钝顶螺旋藻优异藻株Sp-SX07, 并对其培养条件进行优化配置, 建立一套养殖技术参数。这为后续该优异螺旋藻株的规模化养殖和高附加值产品研发提供了科学参考。
1、 材料和方法
1.1、 试验仪器与藻种来源
1.1.1、 试验仪器
高压灭菌锅Panasonic MLS-3781L;超净工作台Boxun BJ-CD;荧光显微镜OLYMPUS CKX53;光照培养箱BIC-400;电子天平LD20002;分析天平BSA系列;真空泵SHZ-D循环水式真空泵;布氏漏斗外径100mm;移液枪Eppendorf;倒置荧光显微镜IX73;卧式智能精密摇床BSD-W×2200;离心机ALLEGRA X-30R;旋涡振荡器XH-C, U-2001紫外可见分光光度计。
1.1.2、 藻样来源
试验所用藻样取自山西农业大学分子农业与生物能源研究所室外螺旋藻 (钝顶螺旋藻) 养殖水体。
1.2、 培养基的配方及培养条件
本试验培养螺旋藻所采用的培养基为Zarrouk培养基 (表1) 。
表1 Zarrouk培养基配方Table 1 Zarrouk medium formula
液体培养:按照上述配方的量配成溶液;
固体培养:称取质量浓度1%的琼脂粉溶解于上述配好的培养基中。121℃, 灭菌20min[13]。
培养条件:起始pH 9.0、温度30℃、LED暖白光4 000lx, 光暗比12h/12h, 藻种接种量10% (V/V) , 测定每日OD=560nm处的吸光度, 确定其生长量和生长速度。
1.3、 钝顶螺旋藻的分离
1.3.1、 水样预处理
将螺旋藻养殖池原藻液分装在250mL的蓝盖瓶中, 敞开瓶口置于自然界条件下放置48h。两天后吸取10% (V/V) 原液置于100mL Zarrouk无菌培养基中, 放在30℃的恒温光照培养箱中, 定时观察。15d后, 挑选生长健壮、污染较少的藻液做为待分离藻液。
1.3.2、 稀释平板涂布分离螺旋藻
本研究中钝顶螺旋藻的分离主要采用稀释平板涂布法。取100μL进行涂板。将涂好的平板放于30℃恒温光照培养箱中培养。待平板上长有肉眼可见的藻落后, 在体式显微镜下观察每个藻落的形态特征。然后选取几株具有代表性的藻落, 挑去藻落一部分, 分别接种于装有适量无菌zarrouk液体培养基的100mL锥形瓶中, 放于光照培养箱中培养。每天抽样显微观察。
1.4、 螺旋藻藻种的筛选、鉴定与培养
在观察过程中, 选择生长形态稳定、藻细胞均一、培养液无污染的螺旋藻藻株。得到候选藻株后, 4倍镜和10倍镜下显微观察候选藻株, 测定其藻体总长、螺距、螺径, 观察藻体末端形态以及培养液颜色, 藻液是否沉降或上浮, 进而确定藻株。取分离的螺旋藻株, 置于500 mL锥形瓶中扩大培养。
1.5、 螺旋藻藻株性状测定
1.5.1、 日生长量测定
每天上午9:00取5mL藻液用分光光度计在560nm处测定吸光度, 绘制生长曲线, 并将测完后的藻液用0.45μm的混合纤维素酯微孔滤膜抽滤获得湿藻体, 烘干至恒重, 测定干藻体重量, 对比不同藻的日生长量[14]。
1.5.2、 藻蓝蛋白的提取和含量分析
待测藻液离心5min (8 000r·min-1) , 倒去上清液。使用等量去离子水清洗2次后, 藻体冷冻干燥。采用直接渗透压法测蛋白含量:取0.06g螺旋藻藻粉, 加入10mL磷酸盐缓冲液 (0.15mol·L-1, pH=7.0) , 混匀后在4℃静置36h。样品离心5min (8 000r·min-1) 后, 得到清透的蓝色上清液。用紫外分光光度计在620nm与652nm处测定液体的光密度, 根据下列公式计算藻蓝蛋白浓度Cc-pc/g·L-1:
根据公式计算藻体中藻蓝蛋白含量Y/%:
其中, V为磷酸缓冲液体积/L, M代表螺旋藻藻粉重量/g。
1.6、 优异螺旋藻藻株培养条件优化
从上述候选藻株中选取日生长量较高、生长速率较快、藻蓝蛋白含量丰富的藻株。采用单因素变量的原则对该株螺旋藻生长及藻蓝蛋白积累所需的光质、光照强度、温度、起始pH进行最优选择。
2、 结果与分析
2.1、 螺旋藻的分离
2.1.1、 螺旋藻样的平板分离单藻落液体培养获得候选螺旋藻藻株
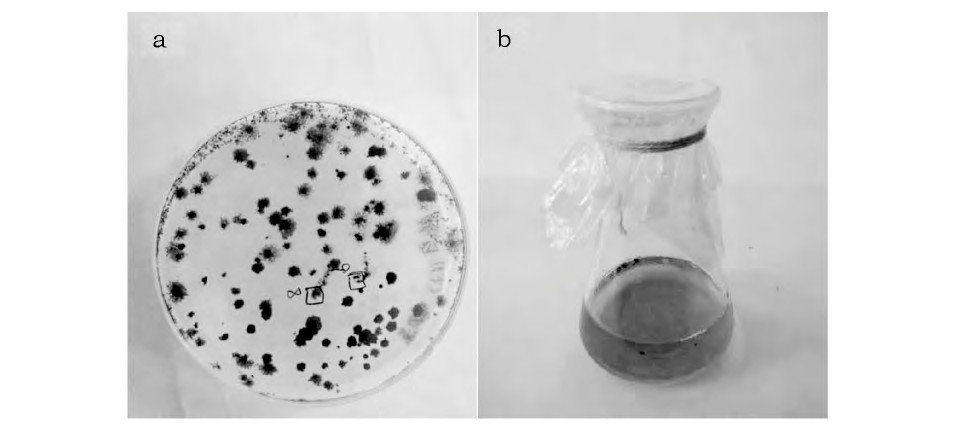
藻样涂板培养15d后, 即可在平板上观察到直径约1mm的藻落 (图1a) 。通过显微镜观察发现螺旋藻藻落形态不一。
图1 螺旋藻水样的分离 (a) 与螺旋藻单藻落液体培养 (b) Fig.1 Separation of Spirulina water sample (a) and liq-uid culture of single Spirulinaclone (b)
2.1.2、 单藻落液体培养获得候选螺旋藻藻株
挑取形态差异明显的藻落进行液体培养, 培养10d后, 可观察到培养液颜色青绿, 藻体均一 (图1b) 。
2.2、 螺旋藻不同藻株的形态比较
试验共分离出8株螺旋藻藻株, 分别编号SpSX01至Sp-SX08。显微观察和测定结果表明 (表2) , 分离所得8株藻, 除Sp-SX04生长期形态不一、藻体培养液污染外, 其余藻株可归为5种类型:第一类为Sp-SX01和Sp-SX03, 培养液蓝绿色, 藻体平均总长约370μm、平均螺距70μm、平均螺径32μm、末端钝圆, 培养时藻体易上浮。第二类为Sp-SX06和Sp-SX08, 培养液呈蓝绿色, 藻体平均总长约为135μm、平均螺距44μm、平均螺径27μm、末端钝圆, 培养时极易上浮。第三类为SpSX02号藻株, 平均螺距达到60μm, 藻体总长较短, 平均达268μm, 但末端形态与其他藻株差异明显, 呈尖、圆状, 培养时整个生长期均沉水。第四类为Sp-SX05, 培养液颜色绿色, 平均总长264μm, 平均螺距14μm, 平均螺径36μm, 末端钝圆, 上浮型。第五类为Sp-SX07, 培养液蓝绿, 平均总长536μm, 平均螺距30μm, 末端钝圆, 上浮型。
表2 8株螺旋藻形态的比较Table 2 Comparison of the morphology of eight strains of spirulina
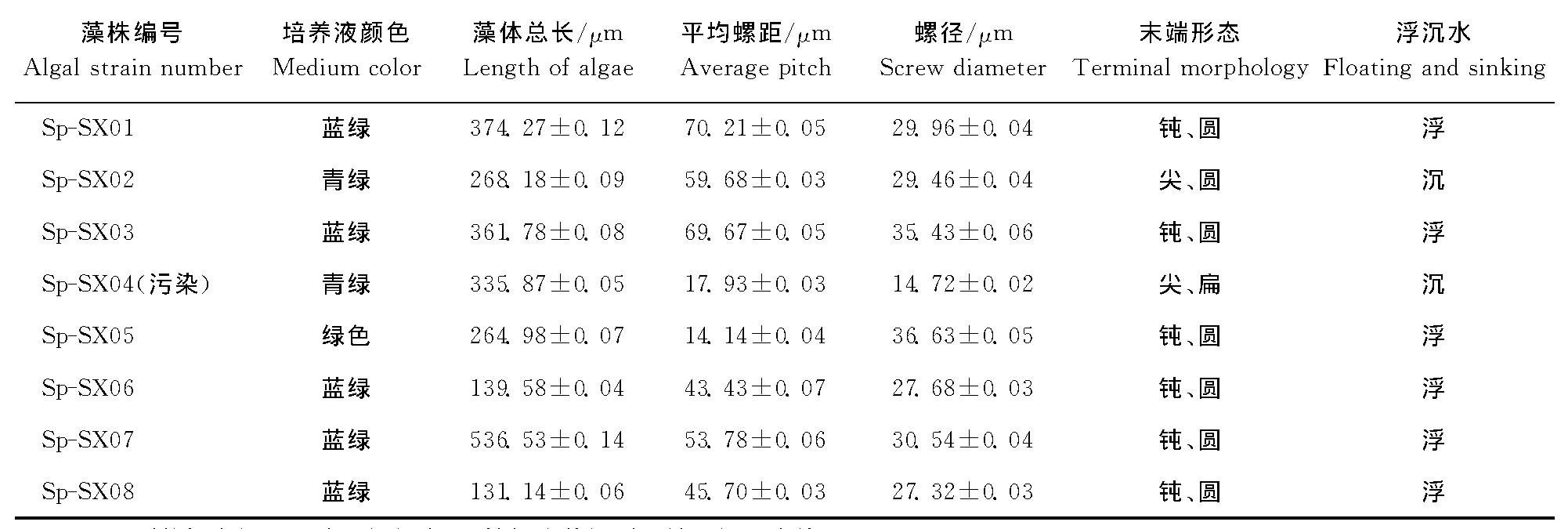
总之, 2号藻末端尖圆, 培养液为绿色, 是唯一的沉水型藻株。Sp-SX01和Sp-SX03号形态相似, 藻株的总长、螺距、螺径均大于形态相似的Sp-SX06和Sp-SX08号藻株。Sp-SX05的特点是螺距短, 螺径粗。Sp-SX07的特点是藻体总长最长。
2.3、 螺旋藻不同藻株的日生长量比较
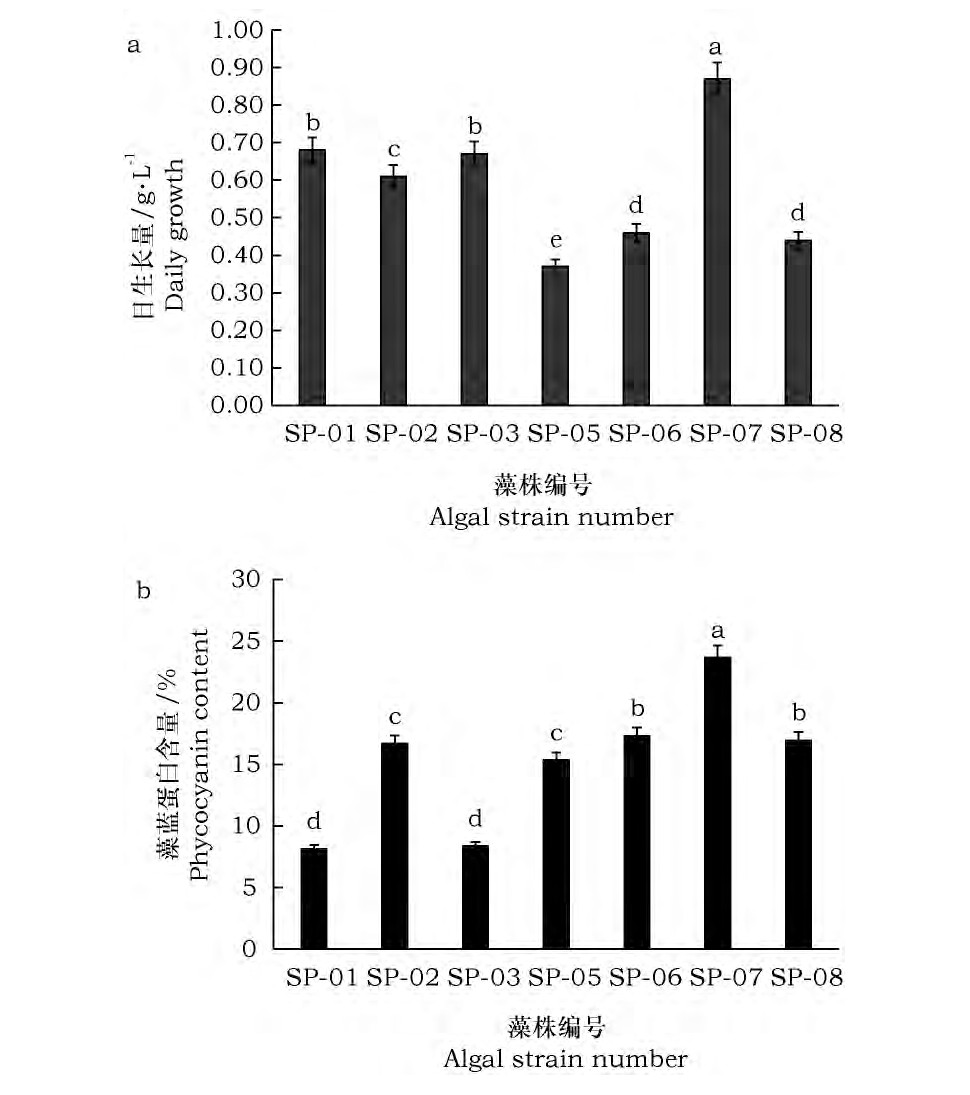
在温度30℃、光照4 000lx下, 连续12d测试不同藻株生长量, 结果表明 (图2a) , Sp-SX01和Sp-SX03号藻株12d平均日生长量分别达到0.68g·L-1和0.67g·L-1。Sp-SX06和Sp-SX08号藻株12d平均日生长量达到0.46g·L-1和0.44g·L-1。Sp-SX02、Sp-SX05和Sp-SX07号株系, 12d平均日生长量分别为达0.61g·L-1, 0.37g·L-1, 和0.87g·L-1。概括而言, Sp-SX07号株螺旋藻平均日生长量明显高于其他株系;而SpSX05号株系的日生长量最低。Sp-SX01和SpSX03号日生长量相近, Sp-SX06和Sp-SX08号螺旋藻株系日生长量也相似, 再次印证1号和3号为同一个株系, 6号和8号为另一个相同株系。
2.4、 螺旋藻不同藻株的藻蓝蛋白含量比较
按照1.5.2中试验方法测定每个螺旋藻藻株的藻蓝蛋白含量。各个藻株取等量冷冻干燥后藻粉提取藻蓝蛋白, 根据公式计算藻蓝蛋白含量, 结果显示 (图2b) , Sp-SX01和Sp-SX03号藻株藻蓝蛋白含量为8.14%和8.36%;Sp-SX06和SpSX08号藻株藻蓝蛋白含量为17.31%和16.95%;Sp-SX02号藻株藻蓝蛋白含量为16.68%;SpSX05号藻株藻蓝蛋白含量为15.35%;Sp-SX07号藻株藻蓝蛋白含量为23.69%。上述分析表明, Sp-SX07号藻株藻蓝蛋白含量明显高于其他藻株, 而Sp-SX01号和Sp-SX03藻株藻蓝蛋白含量最低, 数值相近, Sp-SX06和Sp-SX08号藻株藻蓝蛋白含量次高, 数值接近。显然, 藻蓝蛋白含量再次印证1号和3号为同一个藻株, 而6号和8号为另一个相同藻株。
图2 螺旋藻藻株日生长量 (a) 与螺旋藻藻株藻蓝蛋白含量 (b) Fig.2 Daily growth (a) and phycocyanin content (b) in cells of Spirulinaalgae
2.5、 优异藻种培养条件的优化
由上得出, Sp-SX07藻株日生长量高达0.87g·L-1, 且藻蓝蛋白含量高达23.69%。因此, 选取Sp-SX07作为优异藻株。采用单因素变量原则, 对其光质、光照强度、起始pH、温度进行优化培养。以12天的培养数据进行分析。
2.5.1、 光质对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响
光源设置:LED暖白光、LED白光、LED红光、LED蓝光
光照强度:4 000lx;起始pH:9.0;温度:30℃的培养条件下培养
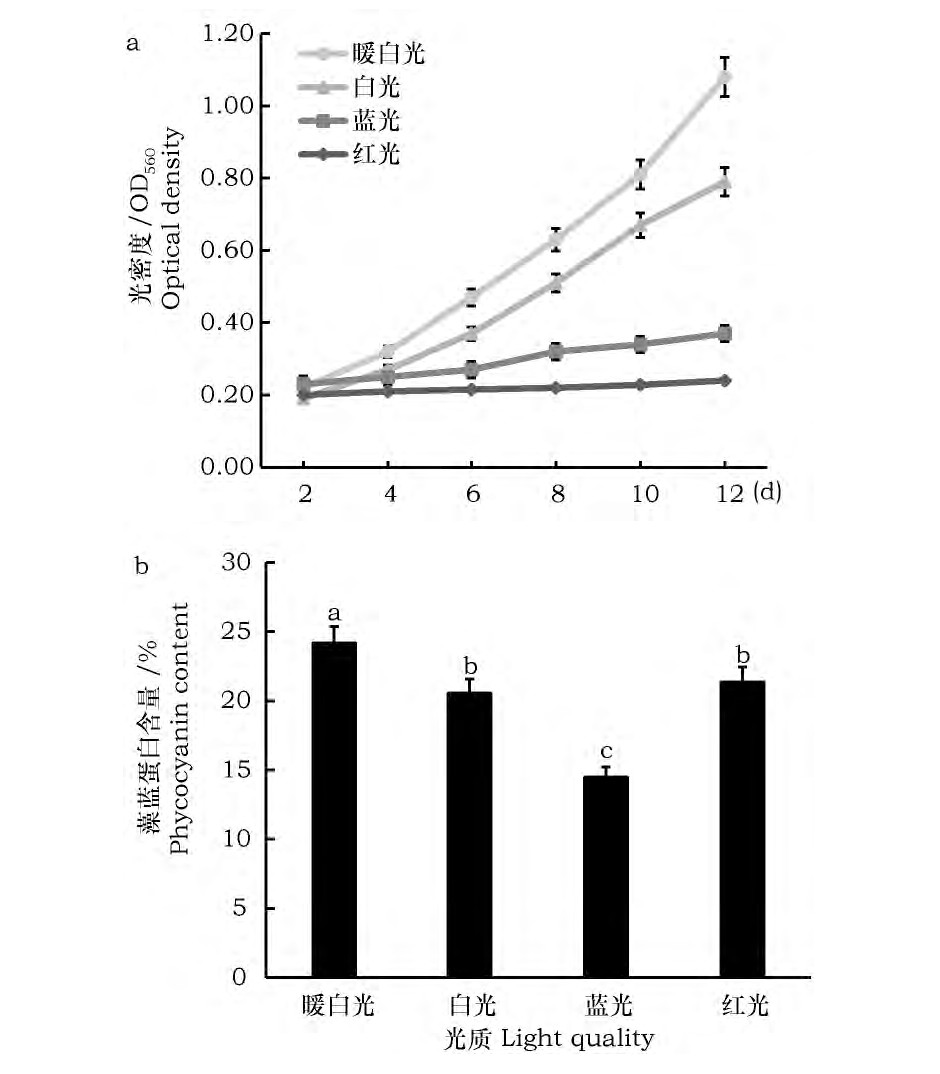
试验结果表明 (图3) : (1) 其它条件一定时, LED暖白光对螺旋藻的培养效果最佳、藻蓝蛋白含量也最高;LED红光培养下的螺旋藻生长最差, 出现变黄现象, 部分藻类死亡, 但其藻蓝蛋白含量却较多。 (2) 单色光源中, 蓝光的培养效果优于红光;红光光源下, 螺旋藻生长最慢;蓝光光源下, 螺旋藻生长缓慢, 藻蓝蛋白积累最少。 (3) 白光光源下, LED暖白光下螺旋藻的生长速度、藻蓝蛋白含量明显优于LED白光, 越到后期差异越大。单色光源由于缺少某种色光, 会减弱螺旋藻的光合作用, 导致生长缓慢;红光有利于藻蓝蛋白形成, 所以红光下藻蓝蛋白积累较多, 尽管生长减慢。两种白色光源均能较好的满足藻蓝蛋白积累对光照的需要, 暖白光由于更接近太阳光, 所以效果更好。
2.5.2、 光照强度对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响
光照强度设置:0lx (即暗培养) 、2 000lx、4 000lx、6 000lx;光源:LED暖白光;起始pH:9.0;温度:30℃的培养条件下培养。
图3 光质对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响Fig.3 Effect of light quality on growth and accumulation of phycocyanin in Spirulina Sp-SX07
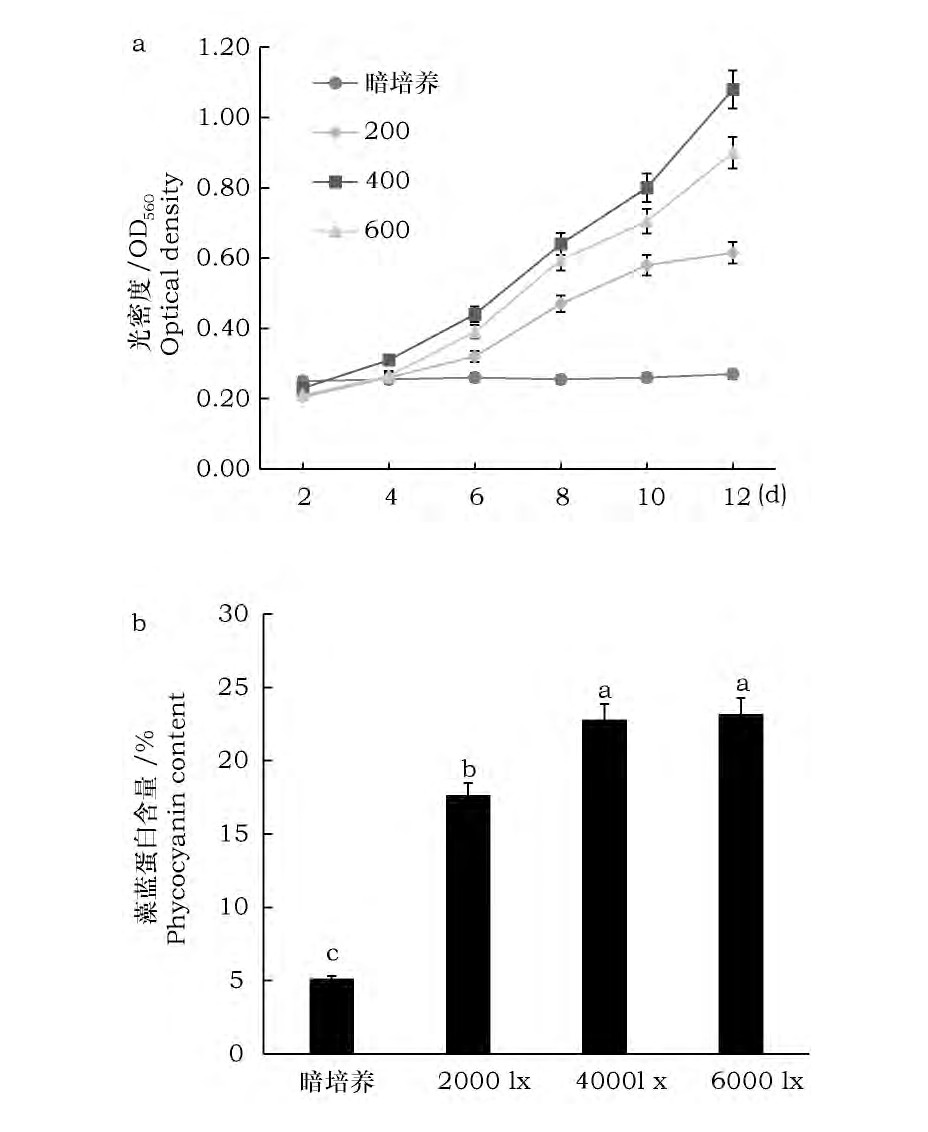
试验结果表明 (图4) : (1) 其它条件一定时, 在4 000lx的光强下, 螺旋藻生长最好、藻蓝蛋白积累较多, 暗培养的情况最差。 (2) 在培养初期, 两种高光强条件下螺旋藻生长差异不大, 到第八天后4 000lx条件下螺旋藻生长速度明显快于6 000lx, 但其藻蓝蛋白含量略低。 (3) 2种低光强下, 2 000lx光强下螺旋藻生长较快、藻蓝蛋白含量较少, 暗培养下螺旋藻生长受抑制, 藻蓝蛋白含量最低。6 000lx光强下后期生长不及4 000lx光强的原因可能是由于后期藻种密度加大, 流动较慢, 部分藻种更易受到强光伤害, 造成生长速率下降。然而, 由于细胞分裂少, 细胞合成的有机物如藻蓝蛋白相对较多。暗培养条件下, 螺旋藻光合作用受阻, 生长受到抑制, 也不利于藻蓝蛋白积累。
2.5.3、 起始pH对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响
起始pH设置:5.0、7.5、8.5、9.5。光源:LED暖白光;光照强度:4 000lx;温度:30℃的培养条件下培养12d。
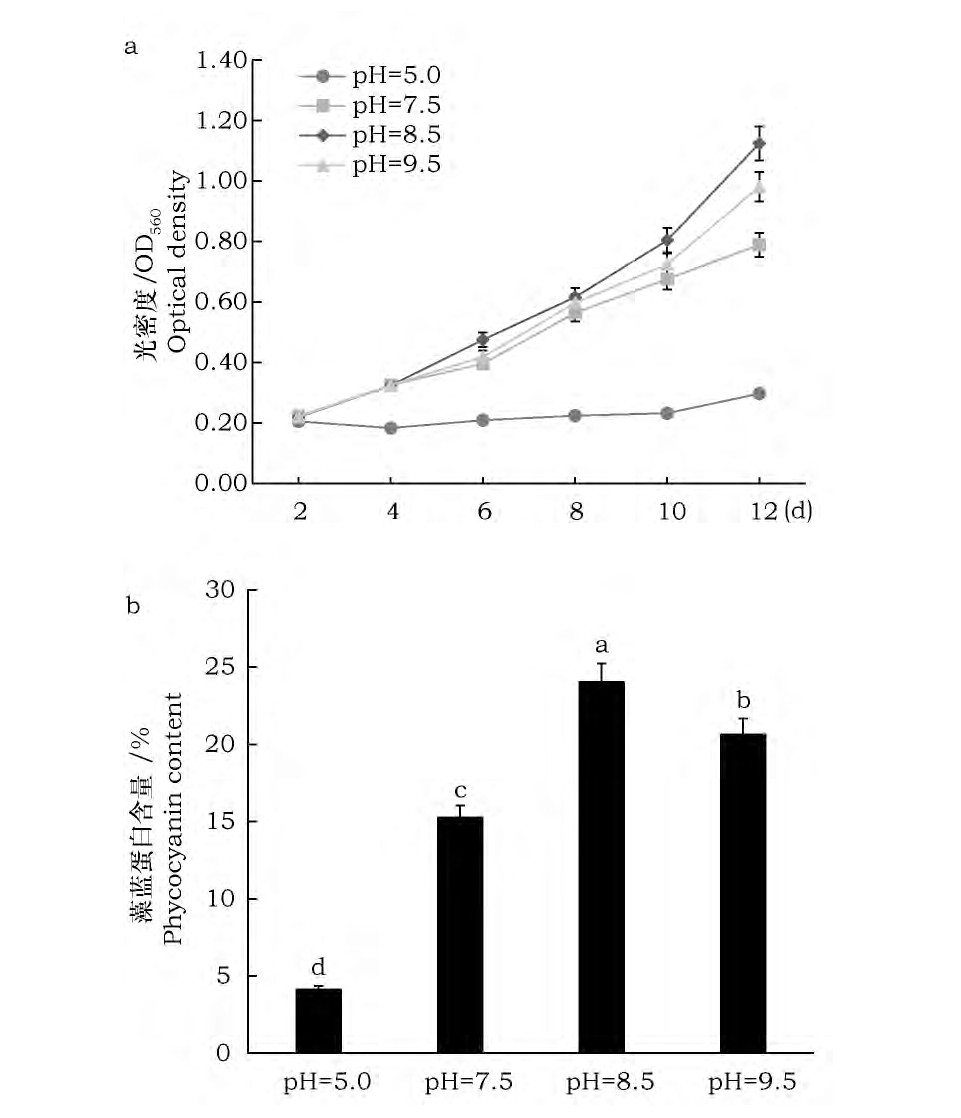
试验结果表明 (图5) : (1) 其它条件一定时, pH设置为8.5的螺旋藻生长最好、藻蓝蛋白含量最多, pH为5.0的螺旋藻生长停滞、藻蓝蛋白含量最少。 (2) 螺旋藻在中性至碱性的环境中生长良好, 藻蓝蛋白积累较多。在生长前期, 起始pH为中性或碱性的螺旋藻生长速度快、且差异不大, 在生长至第六天时开始出现差异, 随后差异越来越明显, 生长速率为pH8.5>pH9.5>pH7.5。本试验所采用螺旋藻生活的环境为碱性, 酸性环境对其生长有抑制作用。碱性过强对于螺旋藻的酶活性有一定的抑制作用, 亦于螺旋藻生长和藻蓝蛋白积累不利。
图4 光照强度对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响Fig.4 Effects of light intensity on growth and accumula-tion of phycocyanin in Spirulina Sp-SX07
2.5.4、 温度对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响
温度设置:20℃、25℃、30℃、35℃。光源:LED暖白光;光照强度:4000lx;起始pH:9.0的培养条件下培养12d。
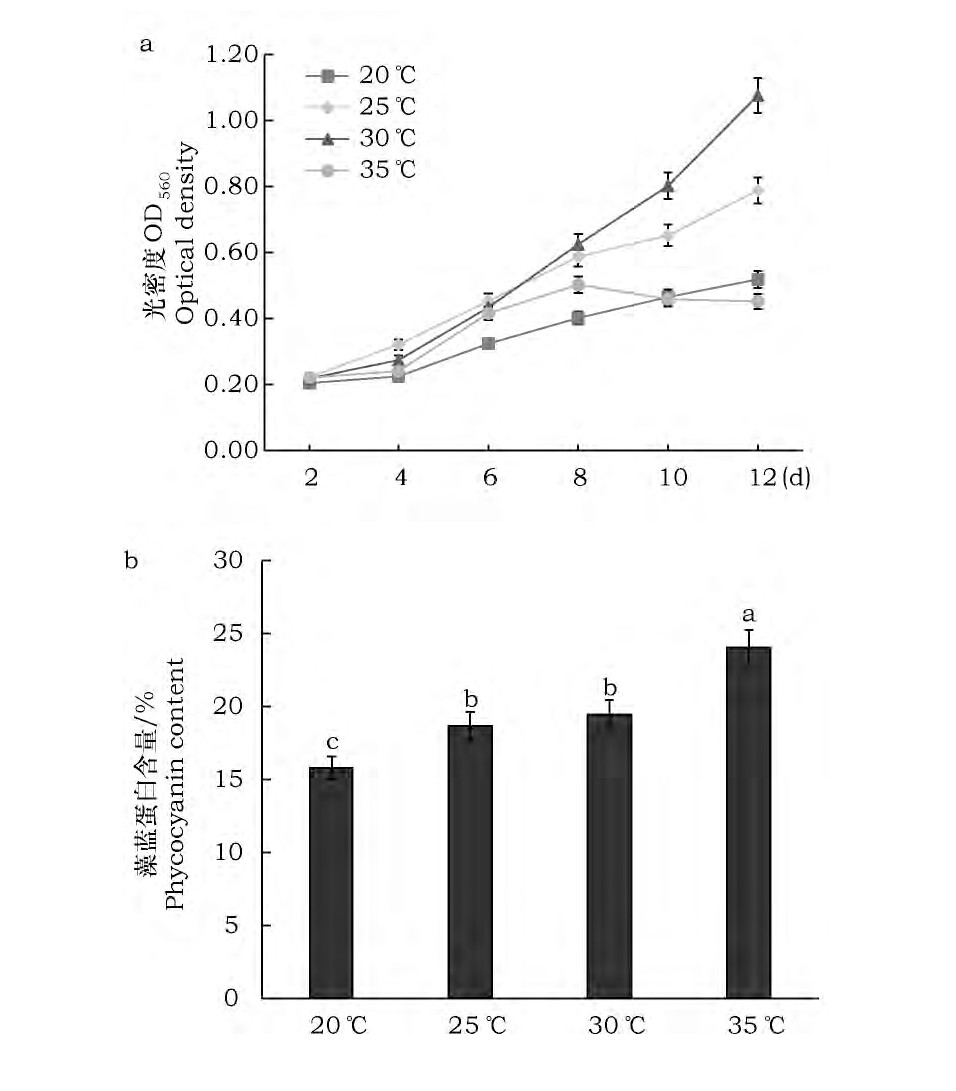
试验结果表明 (图6) : (1) 其它条件一定时, 温度为35℃的螺旋藻生长较慢, 但藻蓝蛋白含量最多。温度为30℃的螺旋藻生长最快、藻蓝蛋白含量较高。温度为20℃的生长最差、藻蓝蛋白含量较低。 (2) 在培养前6天, 除20℃的一组外, 均生长良好且差异不大。6~8d时, 35℃的螺旋藻长势不及25℃和30℃, 第8天后30℃长势明显强于25℃、35℃培养条件下, 细胞开始死亡, 培养瓶中出现黄褐色藻类。高温会使螺旋藻的酶失活且对代谢产生负面影响, 抑制其生长, 但有利于藻蓝蛋白积累。低温抑制螺旋藻的酶活, 使其代谢繁殖速率降低, 生长缓慢、藻蓝蛋白积累也受到抑制。依据螺旋藻Sp-SX07藻株生物量和藻蓝蛋白含量等指标, 评估不同条件的培养效果, 获得优化条件和参数为, 在LED暖白光 (光暗比12h/12h) 、光照强度4 000lx、温度30℃、起始pH 8.5~9.5时培养效果最佳, 藻株日生长量和藻蓝蛋白含量都达到理想水平。
图5 起始pH对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响Fig.5 Effect of initial pH on growth and accumulation of phycocyanin in Spirulina Sp-SX07
3、 讨论与结论
螺旋藻产业是当代农业及生物产业的重要领域, 也是大健康产业的重要组成部分。利用螺旋藻为原料生产高附加值产品的关键环节就是筛选或培育具有优良特性的螺旋藻藻株。例如, 汪志平[15]成功选育一株具有降血糖功能的螺旋藻新品系Sp-B (RD) , 进一步商业化可作为人类征服糖尿病的一种强力食药同源产品。
刘晓娟[16]采用不同剂量的紫外诱变拟微绿球藻 (Nannochloropsis) , 通过多次初筛和复筛, 获得了生理生化指标相对较好的2株诱变株N27和N36。与出发株相比, 它们的比生长速率分别提高了41.9%和26.1%;胞外多糖分别提高了38.57%和19.68%。叶丽[17]得到生长速率、总脂含量和EPA含量均高于三角褐指藻 (Phaeodactylum tricornutum) 出发株 (WP) 的诱变株MP-2。朱万鹏等[18]对大庆湖藻样进行分离鉴定, 筛选出3株高油脂含量的大庆湖藻YL-2、HY-2和HQ-1。孟范平等[19]获得耐受烟道气中极端环境 (高浓度CO2、含有酸性气体) 的小新月菱形藻 (Nitzschia closterium) 和海水小球藻 (Chlorella pacifica) , 5%CO2处理组的生物量分别达到对照组的110%左右。宋玉凤等[20]采用选择性Zarrouk无机培养基从北海螺旋藻养殖场水样中筛选出一株生长较快、藻体粗壮的螺旋藻藻种SP06, 培养8d每升养殖水可收获湿藻46~48g。董乔红[21]从嘉兴市本地养猪沼液池中分离、驯化得到一株高耐污的钝顶螺旋藻驯化株SP24, 在Zarrouk和沼液中的生物量比分离株系SP2提高了17.2%和13.2%。殷春涛等[22]利用超声波处理钝顶螺旋藻出发品系 (Sp) NS-90020, 获得单细胞螺旋藻, 然后用NTG诱变筛选获得突变品系Sp-ALT。突变品系与出发品系相比, 在25℃时生长最快, 较能耐受低温, 蛋白质略有升高, 突变品系可作为一株中温品系在较寒冷地区或寒冷季节生产而得到应用。Kosaric等[23]从废水处理厂的二级废水池中分离一株螺旋藻, 在温度30℃, 光照4 000lx下培养, 与其它规模养殖的螺旋藻相比, 该藻种生长最快 (0.77g·d-1) , 粗蛋白含量最高 (50.5%) 。Li等人[24]筛选到一株高效的废水降解微藻, 它能够在10d内将无机营养物去除98%, 再经过氮饥饿处理, 油脂可从14%增加到31%。
图6 温度对螺旋藻Sp-SX07藻株生长及藻蓝蛋白积累的影响Fig.6 Effect of temperature on growth and accumulation of phycocyanin in Spirulina Sp-SX07
为获得优质藻种, 对室外4年的螺旋藻养殖池藻样进行分离和纯化。惊喜的是, 发现了一株优异螺旋藻变异藻株———Sp-SX07。与出发株相比生物量增长速度和藻蓝蛋白含量均大幅提高。该藻株呈蓝绿色、波浪状, 藻体平均总长536.53μm、平均螺距53.78μm、平均螺径30.54μm、末端钝圆, 培养易浮水, 微藻与培养基接触面积增大, 利于微藻生物量积累。以优异藻株Sp-SX07为材料, 通过对不同光质、光照强度、pH值、温度等培养条件下该藻株生产特性的测试, 建立了该藻株优化培养的主要参数。该藻株在LED暖白光 (光暗比12h/12h) 、光照强度4 000lx、温度25~30℃、起始pH 8.5~9.5之间生长良好, 培养12d平均日生长量0.87g·L-1, 比出发株高45%。藻蓝蛋白含量占藻粉干重23.69%, 比出发株高42%左右。优异螺旋藻藻株Sp-SX07的鉴定及优化培养参数的建立为该优异藻株商业化生产及富含藻蓝蛋白的功能食品研发提供了科学依据。
参考文献:
[1]Singh A, Olsen SI.A critical review of biochemical conversion, sustainability and life-cycle assessment of algal biofuels[J].Applied Energy.2013, 88 (10) :3548-3555.
[2]Seo Y C, Choi W S, Park J H, et al.Stable isolation of phycocyanin from Spirulina platensis associated with high-pressure extraction process[J].International journal of molecular sciences, 2013, 14 (1) :1778-1787.
[3]李志勇, 郭祀远, 李琳, 等.螺旋藻的大规模工业化生产[J].海湖盐与化工, 1998, 27 (1) :38-44.
[4]王文博, 高俊莲, 孙建光, 等.螺旋藻的营养保健价值及其在预防医学中的应用[J].中国食物与营养, 2009 (1) :48-51.
[5]胡鸿钧.螺旋藻生物学及生物技术原理[M].科学出版社, 2003:17-24.
[6]Eriksen NT.Production of phycocyanin-apigment with applications in biology, biotechnology, foods and medicine[J].Applied Microbiology and Biotechnology, 2008, 80 (1) :1-14.
[7]张文, 吴清平, 吴军林.螺旋藻营养保健价值及开发应用进展[J].食品与发酵科技, 2013, 49 (3) :89-92.
[8]Becker EW.Micro-algae as a source of protein[J].Biotechnology Advances.2007, 25 (2) :207-210.
[9]Liu Q, Huang Y, Zhang R, et al.Medical application of Spirulina platensis derived C-phycocyanin[J].Evidence-Based Complementary and Alternative Medicine, 2016 (4) :1-14.
[10]Capelli B, Cysewski G R.Potential health benefits of spirulina microalgae[J].Nutrafoods, 2010, 9 (2) :19-26.
[11]Deng R, Chow T J.Hypolipidemic, antioxidant, and antiinflammatory activities of microalgae Spirulina[J].Cardiovascular Therapeutics, 2010, 28 (4) :33-45.
[12]García J L, Vicente M D, Galán B.Microalgae, old sustainable food and fashion nutraceuticals[J].Microbial Biotechnology, 2017, 10 (5) :1017-1024.
[13]Shi W Q, Li S D, Li G R, et al.Investigation of main factors affecting the growth rate of Spirulina[J].Optik-International Journal for Light and Electron Optics, 2016, 127 (16) :6688-6694.
[14]Brennan L, Owende P.Biofuels from microalgae—a review of technologies for production, processing, and extractions of biofuels and co-products[J].Renewable and sustainable energy reviews, 2010, 14 (2) :557-577.
[15]汪志平.螺旋藻降血糖功能新品系产业化关键技术[J].技术与市场, 2008 (1) :26.
[16]刘晓娟.拟微绿球藻高脂藻株的紫外、激光诱变育种研究[D].福州:福建师范大学, 2012.
[17]叶丽.3种富EPA海洋微藻的诱变育种[D].宁波:宁波大学, 2014.
[18]朱万鹏, 刘玉, 刘宇峰, 等.大庆湖藻的分离、鉴定和高油脂含量筛选[J].生物技术, 2013, 23 (1) :62-66.
[19]宋玉凤, 马光庭, 韩宇.螺旋藻的分离筛选及培养条件的选择[J].基因组学与应用生物学, 2009, 28 (2) :335-338.
[20]孟范平, 谢爽, 于腾, 等.耐酸性和耐高浓度CO2的海洋微藻筛选[J].化工进展, 2009, 28 (S1) :310-317.
[21]董乔红.耐污螺旋藻的驯化复壮、保存及其在沼液中的生长特性研究[D].上海:上海师范大学, 2017.
[22]殷春涛, 胡鸿钧, 李夜光, 等.中温螺旋藻新品系的选育研究[J].武汉植物学研究, 1997, 15 (3) :250-254, 298.
[23]Kosaric N, Nguyen H T, Bergougnou M A.Growth of Spirulina maxima algae in effluents from secondary waste-water treatment plants[J].Biotechnology and Bioengineering, 2010, 16 (7) :881-896
[24]Li X, Hu H Y, Yang J.Lipid accumulation and nutrient removal properties of a newly isolated freshwater microalga, Scenedesmus sp.LX1, growing in secondary effluent[J].New Biotechnology, 2010, 27 (1) :59-63.