摘 要: 为进一步研究成花素 (FLOWERING LOCUS T, FT) 基因对植物营养生长的影响, 通过结合qRT-PCR和生理学实验的方式对FT过表达及突变体植株进行比对分析.研究发现, FT过表达植株与野生型相比, 其根毛短且稀疏, 且具有分叉型、膨大型、波浪型等极性生长缺陷表型;相反, 突变体ft-10的根毛相对长且密集, 略优于野生型, 无极性生长缺陷表型.通过实时定量PCR分析与根毛起始伸长过程相关基因KOAJK、SCN1、RHD2、LRL3、RSL4、RHD6的表达量, FT过表达植株显着低于野生型, 而突变体ft-10略高于野生型.结果表明, FT基因在根毛起始伸长过程中起负调控作用, 影响根毛的极性生长及数量分布.本研究增加了对FT基因在营养生长过程中功能的认识, 同时也为深入研究根系发育的分子机理奠定了基础.
关键词: 拟南芥; FT; 根毛; 基因表达; 营养生长;
Abstract: The FT (FLOWERING LOCUS T) overexpression and mutant plants were analyzed by quantitative PCR and physiological assays to further study the effect of FT gene on the plant vegetative growth. The results showed that the FT overexpression lines had shorter and sparser root hairs with abnormal phenotypes such as branch, ballooned and wavy types when compared with the wild type. On the contrary, ft-10 had longer and denser root hairs with normal phenotypes when compared with wild type. Quantitative analysis of the gene expression including KOAJK、SCN1、RHD2、LRL3、RSL4、RHD6 related to root hair initiation elongation showed that the FT overexpression lines were significantly lower than those of the wild type, while ft-10 were slightly higher than those of the wild type.The results indicate that the FT gene plays a negative role in the initial elongation of root hairs and affects the polar growth and quantitative distribution of root hairs. This study promotes the understanding of the FT function in the vegetative growth process, and also lays the foundation in research of the root development mechanism.
Keyword: Arabidopsis; FT; root hair; gene expression; vegetative growth;
FT (FLOWERING LOCUS T) 属于PEBP家族中FT-like亚家族成员, 在植物中都具有高度的保守性[1].PEBP家族基因具有单一、高度保守的PEBP结构域, 占据了编码区的80%[2].在拟南芥中PEBP家族成员个数为6个, 其中TFL1-like、MFT-like、FT-like亚家族基因的数量比例为3∶1∶2[3].TFL1-like基因在草本和木本植物中广泛存在, 主要功能为:维持植物的营养生长, 延迟植物的开花, 影响花序的形态.而近年来研究表明FT基因可以促进植物从营养生长到生殖生长的转变[4], 是促进开花的信号整合因子.在诱导拟南芥开花的长日条件下, 子叶和叶片的韧皮部伴胞中CO (CONSTANS) 特异激活FT表达, FT蛋白移动到顶端组织并与一个带碱性亮氨酸拉链蛋白结构域的转录因子蛋白FD (FLOWERING LOCUS D) 在茎端分生组织SAM (shoot apical meristem) 相互作用形成复合体, 共同促进下游成花基因AP1 (APETALA1) 的表达, 从而促进开花[5].FT基因不光是光周期途径开花时间决定的关键基因[6], 还部分受春化和自主途径的影响[7,8], 在促进植物开花中起到重要作用, 是植物成花发育研究的热点[9,10,11,12,13].除研究较为深入透彻的控制开花的功能外, 近年来又有新研究报道, FT基因参与调控种子休眠, 并且与控制开花时间模式是相反的[14].拟南芥以这样一种反馈调节控制相同基因来调节植物开花时间和种子休眠以响应季节和温度的变化.FT基因可以通过调节种皮发育和种子激素水平来调节种子休眠.在种子休眠中, FT通过激活FLC (FLOWERING LOCUS C) 的反义RNA-COOLAIR来抑制FLC基因表达和调节染色质状态以达到抑制种子休眠的目的[15].FT基因在种子和根部等其他组织中也有表达[16], 这暗示FT基因不仅仅只是参与开花调控过程, 有可能还参与到其他生物学过程中.
根毛是根系特异表皮细胞外伸形成的管状突出物[17], 含有参与营养吸收的酶类和养分转运体, 是植物吸收水分、养分等营养物质的重要器官[18].根毛的存在使根的表面积显着增加, 有助于根在土壤中的稳定性、根与微生物的互作以及根对土壤营养的获取[19].本研究通过突变体和过表达表型鉴定, 以及实时荧光定量PCR等方法相结合[20,21], 发现FT基因参与拟南芥根毛起始和伸长的调控, 不仅影响到根毛生长的长度和密度, 还影响了根毛的正常形态, 过表达后呈现出分叉、膨大、弯曲[22]等极性生长缺陷表型.本研究揭示了植物调控开花的转录因子FT基因在营养生长过程的功能, 进一步完善了植物根毛生长的分子调控机制, 同时也为深入研究根系发育的分子机理奠定了基础.

1、 材料和方法
1.1、实验材料
拟南芥野生型Col-0 (WT) , 突变体植株ft-10 (GABI_290E08) 购自拟南芥资源中心, 过表达植株35S::FT-GFP-1和35S::FT-GFP-2由实验室通过浸花法转化得到.菌株E.coli TOP 10, 农杆菌Agl0, 载体质粒pCAMBIA2300-GFP由本实验室保存.
1.2 、突变体鉴定
将拟南芥新鲜幼苗叶片置于液氮中研磨, 按照Easy PurePlant Genomic DNA Kit操作步骤提取叶片基因组DNA.以野生型Col-0和突变体ft-10基因组DNA为模板, 以LP/RP和GABIFT/RP为组合引物进行PCR扩增, 体系为:ddH2O 8μL、2×PCR Master Mix 10μL、模板1μL、正反向引物各0.5μL.PCR反应条件为:94℃预变性5 min, 94℃变性30 s, 57℃退火30 s, 72℃延伸1 min 20 s, 共32个循环, 72℃后延伸5 min, 22℃∞.PCR产物在1.0%的琼脂糖凝胶电泳上检测有无目的条带.
1.3 、过表达植株获得及筛选
利用Primer 5.0软件设计特异性引物 (表1) , 以野生型拟南芥cDNA为模板, 进行PCR克隆扩增, 获得目的基因片段, 通过In-Fusion连接方法构建pCAMBIA2300-FT-GFP融合表达载体.测序正确后转入农杆菌Ag10, 将重组质粒通过农杆菌介导法浸花蕾转入拟南芥, 约3~4周收取成熟的种子进行筛选.将种子消毒灭菌后均匀地点在含有浓度为50μg/mL卡那霉素的1/2 MS培养基上, 水平放置在22℃长日照恒温培养箱内, 不含有转基因的幼苗将会变黄死去, 绿色的转基因阳性幼苗T0代则移栽到培养土里.重复筛选最终获得T3代纯合转基因过表达植株.
1.4 、根毛表型分析
将消毒好的种子置于4℃冰箱, 春化3 d后, 均
匀点种在1/2 MS固体培养基上, 垂直放置s在22℃长日照恒温培养箱中4 d后观察根毛表型.用Image J software软件测量根毛长度, 每次根毛长度和密度统计每种株系植株不少于20株, 每次实验保持环境一致且独立重复3次.
表1 引物序列

1.5 、实时荧光定量PCR
采用RNAiso Plus (TakaRa, Japan) 提取植物总RNA, 按照PrimeScript RT regent Kit With gDNA Eraser (TakaRa, Japan) 试剂盒说明逆转录为cDNA.cDNA模板稀释10~20倍, 按照SYBR Premix Ex TaqTM (Perfect Real time) (TakaRa) 试剂盒的说明, 在实时荧光定量PCR仪 (CFX96TOUCH) 上进行PCR实验.反应体系为2×Taq SYBRGreen qPCR Premix 5μL、模板4μL、正反向引物各0.5μL.PCR反应程序为94℃预变性10 min, 94℃变性30 s, 57℃退火30 s, 72℃延伸30 s, 共45个循环.每个实验独立重复3次, 用于定量PCR的引物序列见表1, 以ACTIN作为内参做校正比较内标.
1.6、 蛋白质免疫印迹实验
提取野生型Col-0和FT-GFP-1植物总蛋白进行SDS-PAGE电泳, 将2张硝酸纤维素膜 (NC膜) 、4张滤纸放入转膜缓冲液中浸泡5 min后用110 mA转膜1 h.将膜用5%牛奶液封闭1 h后, 按照1∶5 000比例分别加入一抗GFP和β-actin 4℃孵育过夜.再用TBS/T洗膜3次, 按照1∶10 000比例加入鼠二抗孵育2 h.TBS/T洗膜3次后, 进行显影观察.
1.7、 根毛荧光观察
取在固体培养基中生长4 d的35S::FT-GFP-1植株幼苗进行制片, 在Nikon共聚焦双分子显微镜下用20倍物镜进行观察, 用NIS-Elements Viewer4.20软件进行分析.
1.8、 数据统计
所有实验结果均为3次重复的平均值±标准误差, 采用Microsoft Excel 2007软件对实验数据进行整理和方差分析, 并且采用SPSS V24.0软件进行差异显着性检验.
2 、结果
2.1、 T-DNA插入纯合突变体的鉴定
根据TAIR (http://www.arabidopsis.org/) 以及 (http://www.gabi-kat.de/) 提供的信息, 如图1 (a) 所示, 其中黑色实体方框代表外显子, 黑色实线为内含子.ft-10 (GABI_290E08) 的T-DNA的插入位点是在基因转录起始位点844 bp的内含子内.提取拟南芥野生型WT和ft-10植株的DNA作为模板, 用T-DNA插入位点两侧的正向引物LP和反向引物RP以及T-DNA边界引物GABIFT进行PCR鉴定 (图1 (b) ) .若植株无T-DNA插入即为野生型, 用LP/RP引物可扩出约1 392 bp的特异性条带;若植株为插入纯合体, 插入的T-DNA片段太大, 超出了PCR的扩增范围, 那么用LP/RP引物进行PCR则无扩增条带, 用T-DNA边界引物GABIFT和RP组合, 可扩出约926 bp的特异性条带.由图1 (b) 结果表明, ft-10植株为纯合突变体.与此同时, 还以野生型植株和ft-10植株提RNA做逆转录实验所得的cDNA作为模板, 以拟南芥ACTIN为内参基因 (表1) , 用FT Q2F/R引物进行qRT-PCR实验分析 (图1 (c) ) , 结果显示T-DNA的插入显着减低了FT基因的表达, 野生型植株内FT基因的表达量是突变体ft-10表达量的8.6倍, 表明获得了FT基因的敲低突变体植株.
图1 FT基因的突变体株系鉴定

Fig.1 Identification of mutant lines of FT gene
2.2 、FT-GFP阳性植株的筛选
为进一步验证转基因植株35S::FT-GFP-1 (后文简写FT-GFP-1) 和35S::FT-GFP-2 (后文简写为FT-GFP-2) 的真实性, 分别在DNA水平, RNA水平和蛋白水平上进行验证.提取FT-GFP-1和FT-GFP-2植物的DNA作为模板, 用FT-GFPF正向引物和载体上通用反向引物GFPR对载体进行PCR鉴定 (图2 (a) ) , 成功扩增出约624 bp大小的片段, 说明FT DNA片段成功转入植物基因组中;提取以上植物的RNA进行逆转录得到其c DNA作为模板, 拟南芥ACTIN作为内参基因 (表1) , 用FT Q2F/R引物进行qRT-PCR实验 (图2 (b) ) , 结果显示FT-GFP-1和FT-GFP-2植物FT基因的表达量约为野生型的30倍;提取FT-GFP-1植物的总蛋白进行蛋白质免疫印迹实验 (Western Blot) , 抗体检测到约45kD大小的蛋白条带, 在蛋白水平上说明FT-GFP已经在植株中成功表达 (图2 (c) ) , 综上数据表明已成功获得FT基因的过表达植株.
图2 FT基因的过表达株系鉴定

Fig.2 Identification of overexpressing lines of FT gene
2.3、 突变体、过表达植株根毛表型分析
将拟南芥野生型WT, 突变体ft-10, 过表达植株FT-GFP-1和FT-GFP-2种子进行消毒, 置于4℃冰箱春化3 d后, 点种在1/2 MS固体培养基上, 垂直放置在22℃长日照培养箱中4 d后, 用倒置相差显微镜进行根毛表型观察.同时利用Image J software和SPSS V24.0软件进行根毛密度和根毛长度统计比较分析, 每平方毫米内过表达植株FT-GFP-1根毛平均数量比野生型少15根, 过表达植株FT-GFP-2根毛平均数量比野生型少12根, 而突变体ft-10根毛平均数量比野生型多4根, 统计分析具有显着性差异 (图3 (a) ) ;过表达植株FT-GFP-1根毛平均长度比野生型短95μm, 过表达植株FT-GFP-2根毛平均长度比野生型短104μm, 突变体ft-10根毛平均长度比野生型长64μm, 统计分析同样具有显着性差异 (图3 (b) ) .与野生型相比, 过表达植株FT-GFP-1和FT-GFP-2受到显着抑制, 其根毛短且稀疏;而突变体ft-10的根毛相对略长且密集, 略优于野生型 (图3 (c) ) .这些数据表明, FT基因在拟南芥根毛起始和顶端伸长过程中起负调控作用.除此之外, 根毛表型观察实验中还发现FT过表达植株根毛生长呈现生长缺陷表型, 推测根毛起始过程中极性受到影响, 野生型和突变体植株都是正常的根毛直立向外生长延伸形态 (图3 (d) ) .其中过表达植株FT-GFP-1根毛中, 顶端分叉型占16%, 膨大球状型占9%, 弯曲波浪型占3%;过表达植株FT-GFP-2根毛中, 顶端分叉型占18%, 膨大球状型占11%, 弯曲波浪型占2% (图3 (e) ) .这些实验结果进一步表明, FT基因参与调控拟南芥根毛起始、顶端伸长过程, FT基因过表达引起根毛出现分叉、膨大、弯曲等极性生长缺陷表型.
图3 FT基因的突变体、过表达植株根毛表型对比分析

Fig.3 Comparative analysis of root hair phenotypes of mutant and overexpressed plants of FT gene
2.4、 FT在根毛中的表达分析
将FT-GFP幼苗在Nikon共聚焦双分子显微镜下进行制片观察, 结果表明在根尖部分FT基因在细胞的细胞核和细胞质中有表达 (图4 (a) ) , 进一步发现FT-GFP-1在根毛的早期阶段也有表达 (图4 (b) ) , 这和我们观察到的FT基因可能在根毛早期阶段起作用结果一致.推测FT基因可能参与并调控了根毛的生长发育.
图4 FT过表达株系的荧光观察

Fig.4 Fluorescence microscope observation of overexpressing lines of FT gene
2.5、 根毛起始延伸调控基因表达分析
为进一步从分子水平上探究FT基因在拟南芥根毛起始、顶端伸长过程中的作用, 以及对根毛极性生长和形态的影响.采用实时定量PCR检测拟南芥野生型, 突变体ft-10, 过表达植株FT-GFP-1和FT-GFP-2中根毛起始过程极性生长相关的关键基因ROP2[23,24]以及根毛顶端伸长过程关键基因KOAJK、AKT1、SCN1、RHD2、LRL3、RSL4、RHD6的表达[25,26,27].图5为FT基因的突变体、过表达植株的根毛起始延伸调控基因的转录水平分析, 结果显示KOAJK、AKT1、SCN1、RHD2、RHD6基因在过表达植株FT-GFP-1和FT-GFP-2中表达量显着低于野生型的1/2, LRL3、RSL4基因表达量低于野生型的1/10 (图5 (b) ~ (h) ) , 说明FT基因过表达后会显着影响根毛生长相关基因的表达;而在突变体ft-10中, 除AKT1无明显上升, RSL4等其余根毛伸长相关表达量都略高于野生型 (图5 (b) ~ (h) ) , 这与之前观察的根毛表型也相符合 (图3) .ROP2基因在过表达植株FT-GFP-1和FT-GFP-2的表达量约为野生型表达量的3倍, 有显着性差异, 而在突变体ft-10中的表达量与野生型无太大差异 (图5 (a) ) , 进一步说明FT基因过表达植株中根毛极性发生改变, 从而出现根毛顶端分叉、球状和弯曲波浪的极性生长缺陷表型;而在突变体ft-10未看到极性生长缺陷表型, 这与之前观察的植物根毛形态表型相符合 (图3) .这些实验数据说明FT基因作为一个转录因子, 影响了这些根毛相关基因的表达, 最后影响到根毛的极性生长和根毛生长伸长.
图5 FT基因的突变体、过表达植株的根毛起始延伸调控基因的转录水平分析
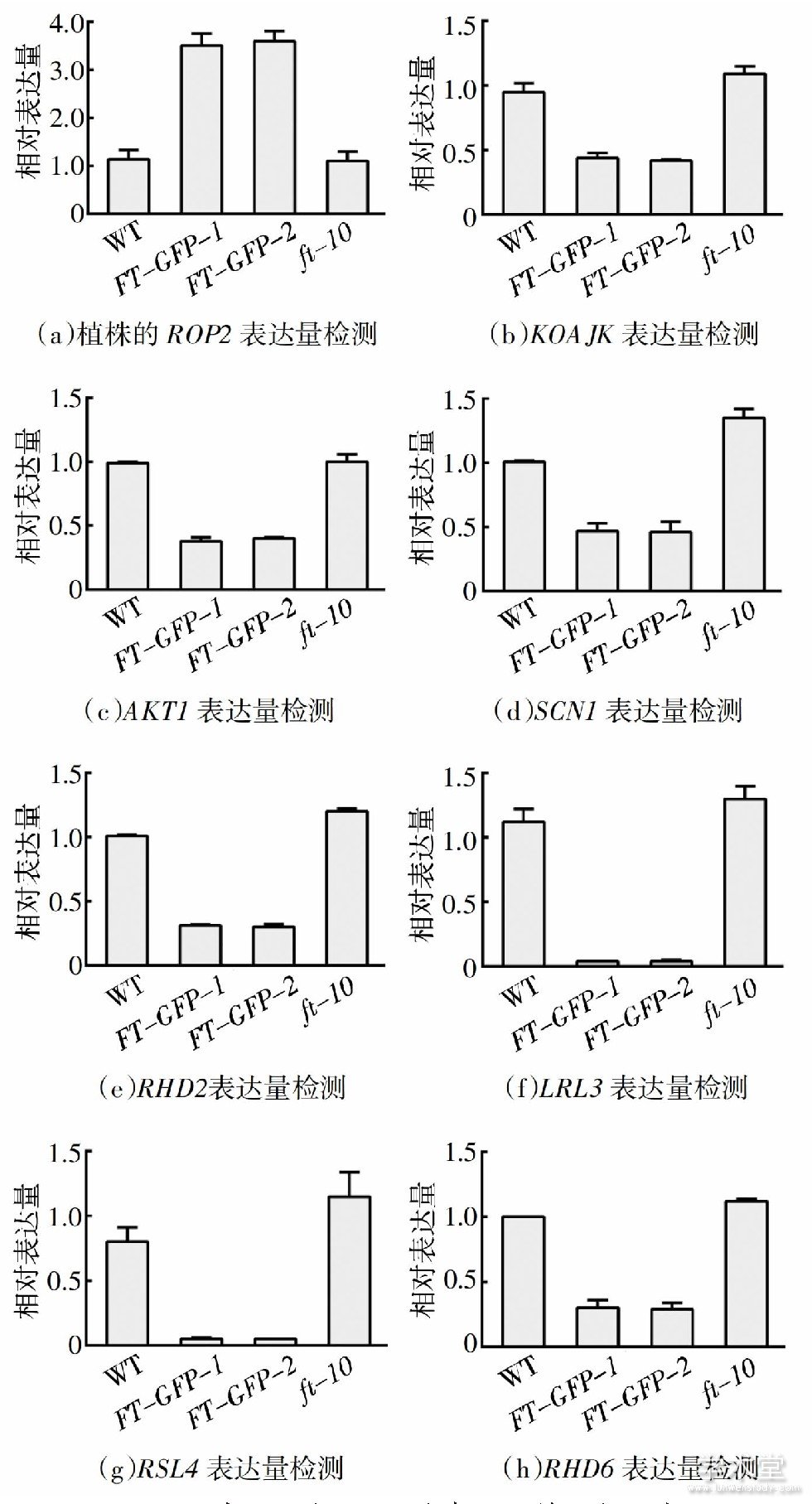
Fig.5 Transcriptional level analysis of the root elongation regulatory genes of mutant and overexpressing lines of FT gene
3、 讨论
根毛是植物吸收水分、养分以及固定植株的重要器官[17], 在植物的生长发育中起着重要作用.根毛的生长发育不仅扩大了根系吸收表面积[18], 还有助于提高植物根在土壤中的稳定性, 加强与土壤中微生物的互作程度[19].根毛可以促进营养和水分的吸收, 直接参与植物的营养生长, 后续影响植物的开花时间, 参与其生殖生长过程.本研究发现FT基因在拟南芥根毛起始和伸长阶段起负调控作用, 不仅影响到根毛生长的长度和密度, 还影响了根毛的正常形态.FT过表达后极性发生改变, 呈现出分叉、膨大、弯曲[22]等极性生长缺陷表型.进一步证明了植物调控开花的转录因子FT基因不仅调控植物的开花转换, 并且也调控植物的根毛生长, 暗示FT基因可能整合了植物通过根毛调控的营养吸收过程及开花转化过程, 从而协调植物生殖生长过程中的转换和维持对高营养物质的需求.
通过定量PCR, 发现FT基因会影响到根毛极性生长相关基因的表达.FT是一个转录因子, 可以直接结合特定基因调控表达, 而关于FT是否直接绑定根毛相关基因的启动子从而调控基因表达, 还需要进一步的研究.本研究初步分析了FT基因在根毛生长过程中的功能, 进一步完善了植物根毛生长的分子调控机制, 为深入研究根系发育的分子机理奠定了初步基础.但是, FT基因具体是如何调控根的生长发育, 直接还是间接参与根系的起始和延伸阶段, 在拟南芥根系的生长发育信号通路中承担怎样的角色还尚不清楚.今后, 我们将通过寻找上下游基因, 验证它们之间的互作关系, 进一步探讨和完善相关分子机制.
参考文献
[1] KSIAZKIEWICZ M, RYCHEL S, NELSON M N, et al.Expansion of the phosphatidylethanolamine binding protein family in legumes:a case study of Lupinus angustifolius L.Flowering Locus Thomologs, LanFTc1 and LanFTc2[J].BMC Genomics, 2016, 17 (1) :820-841.
[2]孙洪波, 贾贞, 韩天富.PEBP家族基因在植物发育调控中的作用[J].植物生理学报, 2009, 45 (8) :739-747.SUN H B, JIA Z, HAN T F.Roles of PEBP family genes in the development of plants[J].Plant Physiology Journal, 2009, 45 (8) :739-747. (In Chinese)
[3] DANILEVSKAYA O N, MENG X, HOU Z, et al.A genomic and expression compendium of the expanded PEBP gene family from maize[J].Plant Physiology, 2007, 146 (1) :250-264.
[4] HEMMING M N, PEACOCK W J, DENNIS E S, et al.Lowtemperature and daylength cues are integrated to regulate Flowering Locus T in barley[J].Plant Physiology, 2008, 147 (1) :355-366.
[5] ABE M, KOBAYASHI Y, YAMAMOTO S, et al.FD, a b ZIP protein mediating signals from the floral pathway integrator FT at the shoot apex[J].Science, 2005, 309 (5737) :1052-1056.
[6] SAMACH A, ONOUCHI H, GOLD S E, et al.Distinct roles of CONSTANS target genes in reproductive development of Arabidopsis[J].Science, 2000, 288 (5471) :1613-1616.
[7] YANOVSKY M J, KAY S A.Molecular basis of seasonal time measurement in Arabidopsis[J].Nature, 2002, 419 (6904) :308-312.
[8] TEPERBAMNOLKER P, SAMACH A.The flowering integrator FTregulates SEPALLATA3 and FRUITFULL accumulation in Arabidopsis leaves[J].Plant Cell, 2005, 17 (10) :2661-2675.
[9]PIN P A, NILSSON O.The multifaceted roles of Flowering Locus Tin plant development[J].Plant Cell&Environment, 2012, 35 (10) :1742-1755.
[10] HO W W, WEIGEL D.Structural features determining flowerpromoting activity of Arabidopsis Flowering Locus T[J].Plant Cell, 2014, 26 (2) :552-564.
[11] NAKAMURA Y, ANDR?S F, KANEHARA K, et al.Arabidopsis florigen FT binds to diurnally oscillating phospholipids that accelerate flowering[J].Nature Communications, 2014, 5 (5) :3553-3559.
[12] KANG M J, JIN H S, NOH Y S, et al.Repression of flowering under a noninductive photoperiod by the HDA9-AGL19-FT module in Arabidopsis[J].New Phytologist, 2015, 206 (1) :281-294.
[13] SOO-CHEUL Y, CHENG C, MARIA R, et al.Phloem longdistance delivery of Flowering Locus T (FT) to the apex[J].Plant Journal, 2013, 75 (3) :456-468.
[14] CHEN M, MACGREGOR D R, DAVE A, et al.Maternal temperature history activates Flowering Locus Tin fruits to control progeny dormancy according totime of year[J].Proceedings of the National Academy of Sciences of the United States of America, 2014, 111 (52) :18787-18792.
[15] CHEN M, PENFIELD S.Feedback regulation of COOLAIRexpression controls seed dormancy and flowering time[J].Science, 2018, 360 (6392) :1014-1017.
[16] 贾贞, 赵菲佚, 吴存祥.FT及其同源基因在植物发育调控中的多功能效应[J].西北植物学报, 2011, 31 (12) :2558-2564.JIA Z, ZHAO F Y, WU C X.Pleiotropic effects of FT and its orthologues on plant development[J].Acta Botanica BorealiOccidentalia Sinica, 2011, 31 (12) :2558-2564. (In Chinese)
[17] GILROY S, JONES D L.Through form to function:root hair development and nutrient uptake[J].Trends in Plant Science, 2000, 5 (2) :56-60.
[18]GAHOONIA T S, NIELSEN N E.Barley genotypes with long root hairs sustain high grain yields in low-P field[J].Plant&Soil, 2004, 262 (1/2) :55-62.
[19] CHO H T, COSGROVE D J.Regulation of root hair initiation and expansin gene expression in Arabidopsis[J].Plant Cell, 2002, 14 (12) :3237-3253.
[20] 刘选明, 孙孟思, 李新梅, 等.F-box基因FOF2在拟南芥盐和冷胁迫响应中的功能分析[J].湖南大学学报 (自然科学版) , 2018, 45 (6) :120-127.LIU X M, SUN M S, LI X M, et al.Function study on F-box gene FOF2 response to salt stress andcold stress in Arabidopsis[J].Journal of Hunan University (Natural Sciences) , 2018, 45 (6) :120-127. (In Chinese)
[21] 刘选明, 王文文, 杨远柱, 等.水稻基因OsDHHC13参与氧化胁迫响应的初步研究[J].湖南大学学报 (自然科学版) , 2016, 43 (12) :110-116.LIU X M, WANG W W, YANG Y Z, et al.Preliminary study on a rice OsDHHC13 gene involving in the response to oxidative stress[J].Journal of Hunan University (Natural Sciences) , 2016, 43 (12) :110-116. (In Chinese)
[22] 丁沃娜, 童艳丽, 吴晶, 等.一个水稻短根毛突变体的鉴定和基因定位[J].中国农业科学, 2011, 44 (21) :4333-4339.DING W N, TONG Y L, WU J, et al.Identificationand gene mapping of a novel short root hair mutant in rice[J].Scientia Agricultura Sinica, 2011, 44 (21) :4333-4339. (In Chinese)
[23] DATTA S, KIM C M, PERNAS M, et al.Root hairs:development, growth and evolution at the plant-soil interface[J].Plant&Soil, 2011, 346 (1/2) :1-14.
[24]FU Y, GU Y, ZHENG Z, et al.Arabidopsis interdigitating cell growth requires two antagonistic pathways with opposing action on cell morphogenesis[J].Cell, 2005, 120 (5) :687-700.
[25] NAKAMURA M, CLAES A R, GREBE T, et al.Auxin and ROPGTPase signaling of polar nuclear migration in root epidermal hair cells[J].Plant Physiology, 2018, 176 (1) :378-391.
[26] SIEBERER B J, KETELAAR T, ESSELING J J, et al.Microtubules guide root hair tip growth[J].New Phytologist, 2005, 167 (3) :711-719.
[27] WEI Z, LI J.Receptor-like protein kinases:key regulators controlling root hair development in Arabidopsis thaliana[J].Journal of Integrative Plant Biology, 2018, 60 (9) :841-850.