很多研究证明植物能够释放甲醇,同时也可进行代谢和利用甲醇。Cossins研究发现植物能够将14C标记的甲醇转化为14C标记的CO2,14C标记出现在糖和氨基酸[主要是丝氨酸(Ser)和甲硫氨酸(Met)]中,据此推测甲醇在高等植物中可以在NAD依赖的甲醛脱氢酶(FALDH)、S-甲酰谷胱甘肽水 解 酶 (FGH)和NAD依 赖 的 甲 酸 脱 氢 酶(FDH)构成的代谢途径中被氧化成甲醛、甲酸和CO2,随后CO2进入卡尔文循环被同化为葡萄糖。13C-NMR研究发现13C-甲醇进入悬铃木细胞后被慢慢地代谢为13C-Ser、13C-Met及13C-卵磷脂。13C-甲醇的同化可能通过亚甲基四氢叶酸(CH2-THF)和腺苷甲硫氨酸进行。另外,13C-甲醇在悬铃木细胞中还被同化为甲基-β-D-吡喃葡萄糖苷(13CH3-β-D-glucopyranoside)。
在应用方面,甲醇能促进植物的生长已在藻类植物、双子叶植物和单子叶植物中得到证实。研究结果说明叶面施用甲醇不仅可以增加作物产量,而且能缓解干旱环境中农作物的干旱胁迫症状并减少灌溉需水量。此外,叶片喷洒甲醇还促进观赏植物开花,缩短植物生育期。但是关于甲醇刺激植物生长的大多数研究只是集中在形态或生理层面,对其机理研究不多。目前关于甲醇影响植物生长的机制主要有以下几种假说或推测:碳源假说、增强光合作用并抑制光呼吸假说、推动钙离子(Ca2+)由成熟组织向新生组织转移和影响激素生成。
因为甲醇在植物体内可依次被氧化生成甲醛、甲酸和CO2,因此碳源假说认为喷施于植物叶面的甲醇通过气孔或直接穿过叶片表皮进入植物细胞,其氧化反应最终提高了叶片细胞内RuBisco附近的CO2浓度,从而能成功地与氧竞争RuBisco的活性位点,增强植物对CO2的同化作用,为植物生长和繁殖提供更多的有机物。
在上述假说中,碳源假说是目前得到试验支持证据最多的假说。但对于碳源假说有部分学者提出质疑,认为喷施甲醇时能真正施用到单株植物上的甲醇很少,若作为碳源起作用,促进植物生长的效果不会如此显着。矮牵牛是一种在植物学领域广泛应用的模式观赏植物,本研究首先考察叶施不同浓度的甲醇对矮牵牛生长的影响,之后为了排除微生物的干扰,在无菌条件下于MS固体培养基中添加不同浓度的甲醇,进一步验证甲醇的应用对矮牵牛生长的影响,最后利用13C-NMR技术分析矮牵牛代谢中13C-标记甲醇的代谢机制,以考察矮牵牛甲醇代谢作用与甲醇刺激其生长的相关性,对碳源假说进行验证。
1材料和方法
1.1材料培养与处理
本研究使用的试验材料是矮牵牛(Petunia hy-brida L.)。矮牵牛的种子经过表面消毒后播种于MS蔗糖培养基上,然后置于组培室持续光照条件下进行无菌培养,3周后进行甲醇处理和相关指标测定。
1.2测定指标及方法
1.2.1形态和生长指标
将无菌培养的矮牵牛幼苗移栽到装有腐殖土和珍珠岩的小花盆中进行盆栽培养,每盆植入大小一致的小苗3株。1周后,用塑料袋套住花盆避免甲醇溶液渗入土壤,然后分别用浓度为5%、10%的甲醇和蒸馏水(对照,CK1)均匀喷洒于叶面上,每盆植物喷洒溶液20mL,每周2次,持续5周后观察其植株形态变化。为了排除微生物的影响,在无菌培养条件下进行甲醇处理。选取大小一致的矮牵牛幼苗,剪取有3个叶片的顶芽,分别插入添加了2和6mmol/L甲醇的MS固体培养基(pH 5.7,含2%蔗糖)上,持续光照下培养,以不添加甲醇的MS固体培养基上生长的顶芽为对照(CK2)。培养2周后,取出幼苗观察生长情况并测量鲜重,计算相对生长率。
相对生长率=(2周后鲜重-初始鲜重)/初始鲜重
1.2.2叶绿素含量
将无菌培养的矮牵牛幼苗分别转接到添加有2和6mmol/L甲醇的MS固体培养基上,按照1.2.1中条件培养3周后收集叶片,在液氮中充分研磨,用95%的乙醇抽提,然后用紫外分光光度法测定叶绿素含量。分别测定665nm和649nm处的光吸收值(A665、A649),根据下述公式计算总叶绿素、叶绿素a和b的浓度:
叶绿素a(mg/L)=13.95×A665-6.88×A649
叶绿素b(mg/L)=24.96×A649-7.32×A665
总叶绿素浓度=叶绿素a+叶绿素b
叶绿素含量(mg/g,鲜重)=(色素浓度×提取液体积×稀释倍数)/(样品鲜重×1 000)
1.2.3丙二醛、过氧化氢及羰基化蛋白质含量
矮牵牛幼苗分别在添加有2和6mmol/L甲醇的MS固体培养基上按照1.2.1中条件处理3d后收集叶片,在液氮中充分研磨,采用硫代巴比妥酸酸法测定丙二醛(MDA)含量,采用二甲酚橙法进行测定过氧化氢(H2O2)含量,采用2,4-二硝基苯肼(DNPH)法[12]测定羰基化蛋白(PC)含量。
1.2.4代谢物相对含量
(1)13CH3OH标记试验矮牵牛幼苗先在含有蔗糖的MS固体培养基上培养6周,在无菌条件下取出置于添加2或6mmol/L13CH3OH的MS固体培养基中,在同样的温度、光照条件下处理3d,然后采集叶片2g,液氮速冻备用。为了观察叶片中13CH3OH的积累,取部分矮牵牛叶片在液氮中充分研磨,12 000r/min,4 ℃离心20min,取上清用于13C-NMR分析。
(2)代谢产物的抽提为了富集含量低的代谢中间产物,植物材料在液氮中研磨,加1.5mL 100mmol/L磷酸钾缓冲液(KPB,pH 7.4)抽提,经沸水浴处理3min,12 000r/min,4℃离心20min。取上清液真空冷冻干燥,然后用0.6 mL 100 mmol/LKPB缓冲液溶解。12 000r/min,4 ℃离心5min,上清用于13C-NMR分析。
(3)13C-NMR分析13C-NMR分析在布鲁克核磁共振仪(DRX 500-MHz)上进行,使用的相关参数如下:宽带质子去耦,5ms(90°)脉冲,谱宽37 594Hz,采样时间0.5s,延滞时间1.2s,样品温度保持在25 ℃,每 个 样 品 采 集32 000个 数 据 点,扫 描1 200次,处理数据时线宽为4Hz。标记样品中的化学位移参照甲酰胺共振峰(Ref,166.85ppm)。13C-NMR谱中共振峰的归属参考已知化合物的13C-NMR谱。在计算不同样品中各代谢物的相对含量时,目标共振峰以甲酰胺(Ref)为内参进行积分。
1.3数据分析
各项生理指标的检测均进行3次生物学重复,采用统计学分析软件SPSS 16.0进行单因素方差分析(P<0.05)。图中数据间标有不同字母表示差异达显着水平。
2结果与分析
2.1施用甲醇对矮牵牛生长表型和生物量积累的影响
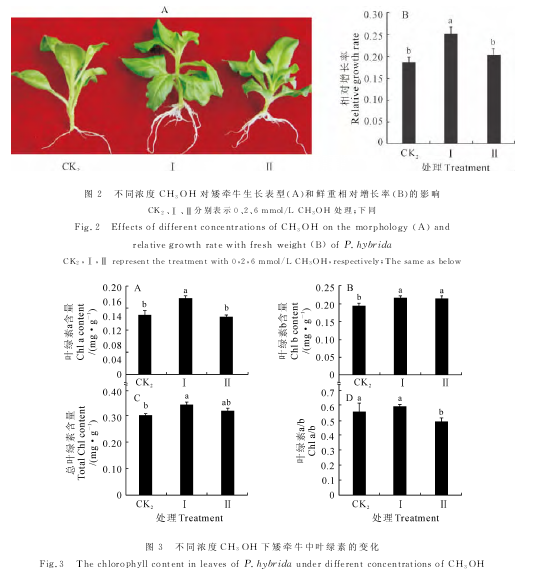
分别用5%和10%甲醇溶液喷施盆栽矮牵牛叶面,5周后,与对照(CK1)相比,喷施5%甲醇的植株个体较大,叶片厚而挺拔,叶柄较长且粗,而喷施10%甲醇的植株个体较CK1要小,且叶片发黄(图1)。说明叶片喷施5%甲醇能显着促进矮牵牛的生长,而喷施10%甲醇表现出生长抑制效应。
由于盆栽植物叶片表面存在大量细菌,可能会影响喷施甲醇的效果。为了排除微生物的干扰,在MS培养基中分别加入2mmol/L(Ⅰ)和6mmol/L(Ⅱ)CH3OH(下同),然后把组培苗移栽到培养基上,以不添加甲醇的培养基上的植株为对照(CK2),培养3周后观察添加不同浓度的CH3OH对矮牵牛生长状况以及生物量积累的影响。结果表明,在含有CH3OH的MS培养基上生长的矮牵牛再生根比CK2更粗壮更长,两种浓度的CH3OH均未对矮牵牛幼苗造成明显可见的损伤(图2,A)。鲜重测量结果表明,在添加2mmol/L甲醇培养基上生长的植株鲜重 相 对 增 长 率 显 着 高 于CK2,添 加6 mmol/LCH3OH处理仅略高于CK2(图2,B)。以上结果说明,在无菌培养条件下,根部施用2mmol/L CH3OH能够显着促进矮牵牛幼苗的生长,当外源性CH3OH浓度达到6mmol/L时促进效果降低。
2.2施用甲醇对矮牵牛幼苗生理生化特性的影响
2.2.1叶绿素含量 叶绿素含量与植物的光合速率密切相关,是植物生长状况的一个反映。在MS培养基上添加2mmol/L CH3OH使矮牵牛中叶绿素a、叶绿素b和总叶绿素含量均比对照(CK2)显着增加,叶绿素a/b比值也有所增加,但未达到显着差异水平;而添加6mmol/L CH3OH使矮牵牛叶片中 叶绿素a含量比对照有所降低,但叶绿素b和总叶绿素含量有一定程度升高,叶绿素a/b比对照显着降低 (图3,A~D)。
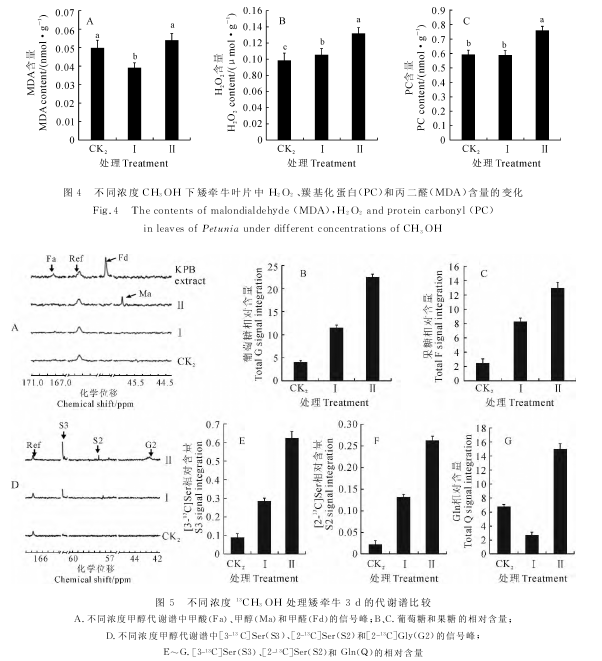
2.2.2 H2O2、羰基化蛋白(PC)和MDA含量 与CK2相比,添加2mmol/L CH3OH使矮牵牛叶片中MDA含 量 显 着 降 低12%,而 添 加6 mmol/LCH3OH使MDA含量升高8%,但未达到显着水平(图4,A);培养基中添加2和6mmol/L CH3OH分别使矮牵牛叶片中H2O2含量分别显着升高8%和17%(图4,B);培养基中添加2mmol/L CH3OH对矮牵牛叶片中PC含量无显着影响,而添加6mmol/LCH3OH使矮牵牛叶片PC含量显着升高20%(图4,C)。这些结果说明在MS培养基上添加低浓度(2mmol/L)CH3OH对矮牵牛没有产生氧化胁迫,而添加高浓度(6mmol/L)CH3OH则产生较为强烈的氧化胁迫,对矮牵牛叶片膜脂和蛋白质产生一定程度的氧化损伤,这可能是高浓度CH3OH对矮牵牛生长促进作用降低的原因之一。
2.3 MS培养基上不同浓度甲醇在矮牵牛中的代谢作用
为了考察矮牵牛代谢甲醇的机制,在固体MS培养基上分别添加2和6mmol/L13CH3OH,把长根的矮牵牛移栽到上述培养基上处理72h,然后抽提 其细胞汁液,用13C-NMR分析其代谢谱。结果在13CH3OH处理植株叶片的细胞汁液中可以观察到有游离的13CH3OH信号峰(图5,A)出现(游离甲醇信号峰均随使用甲醇浓度的升高而增加),但是没有观察到甲醛(H13CHO)和甲酸(H13COOH)的信号峰,可能是由于样品没有浓缩,而使这两种产物的含量较低不足以检测到。同时,为了确认在矮牵牛中13CH3OH的代谢是否会产生H13CHO和H13COOH,对6mmol/L13CH3OH处理24h的矮牵牛代谢中间产物用KPB抽提浓缩,结果13C-NMR谱中没有出现游离的13CH3OH信号峰,但可以观察到较弱的H13CHO和H13COOH信号峰(图5,A),证实在矮牵牛中13CH3OH的代谢产生了H13CHO和H13COOH。矮牵牛中游离葡萄糖[U-13C]Gluc和果糖[U-13C]Fruc信号峰的强度在2mmol/L13CH3OH代谢谱中分别达到CK2的2.9和3.4倍,而在6mmol/L13CH3OH的代谢谱中则进一步升高至CK2的5.7和5.4倍(图5,B、C)。这些结果说明在矮牵牛中13CH3OH可被同化为[U-13C]Gluc和[U-13C]Fruc。
同时,在CK2中有较弱的[3-13C]Ser信号峰,且在13CH3OH代 谢 过 程 中 [3-13C]Ser的 信 号 峰 随13CH3OH浓度的升高而显着增强(图5,D),在2和6mmol/L13CH3OH代谢谱中分别达到CK2的3.5和7.8倍(图5,E)。在CK2中并无[2-13C]Ser和[2-13C]Gly的信号峰,在2mmol/L13CH3OH代谢谱中出 现 [2-13C]Ser的 信 号 峰,而 在6 mmol/L13CH3OH代谢谱中出现[2-13C]Gly的信号峰,同时[2-13C]Ser的信号峰显着增强(图5,D),其信号强度达到CK2的13倍(图5,F)。这些结果说明在矮牵牛中13CH3OH的代 谢 产 生 大 量 的 [3-13C]Ser、[2-13C]Ser和少量的[2-13C]Gly。在CK2中含量最丰 富 的N-转 运 氨 基 酸 是Gln,在2 mmol/L13CH3OH标记72h后,[U-13C]Gln的信号峰强度有所 降 低,在6 mmol/L13CH3OH标 记72h后[U-13C]Gln的信号峰显着增强,其相对含量达到CK2样品中的2.2倍(图5,G),表明有13C代谢流进入Gln碳骨架的合成。
3讨论
有些研究发现同样浓度的CH3OH在叶片喷施能促进植物生长,当采用根部灌溉时却显着抑制植物的生长,因此有很多学者对CH3OH刺激植物生长作用的重复性提出质疑。Hemming总结很多研究的结果提出,植物对外源性CH3OH的应答是一个十分复杂的过程,CH3OH的处理时间、植物对CH3OH的吸收量、不同组织对CH3OH的敏感度差异甚至某些甲基营养菌的存在可能都是影响外源性CH3OH施用实验的重复性。在本研究也观察到类似的结果,用5%甲醇处理的矮牵牛生长状况明显比对照植物好,而10%的甲醇喷施处理叶片发黄生长缓慢,说明高浓度甲醇对矮牵牛产生了一定的胁迫。根部施用2和6mmol/L CH3OH处理结果表明,两种浓度CH3OH对矮牵牛幼苗生长均有促进作用,其中2mmol/L CH3OH的促进效果更显着;同时,2mmol/L的CH3OH处理幼苗的MDA含量没有升高,而6mmol/L CH3OH处理引起矮牵牛中氧化胁迫相关指标(包括H2O2、MDA和PC)的升高,说明6mmol/L CH3OH处理可能引起矮牵牛中膜脂以及蛋白质过氧化水平的升高,这可能是高浓度甲醇对矮牵牛生长刺激作用减弱的生理基础之一。
目前对于甲醇影响植物生长的机制有多种不同的假说或推测,其中碳源假说的理论依据是:
CH3OH在植物体内主要通过HCHO、HCOOH和CO2的途径进行代谢,产生的CO2能够提高Rubisco周围的CO2/O2比率,从而提高Rubisco光合碳同化的能力和效率。本实验中2mmol/L13CH3OH处理矮牵牛中的主要代谢产物是[U-13C]Fruc和[U-13C]Gluc,这说明由2mmol/L13CH3OH代谢产生的HCOOH确实进入卡尔文循环用于糖类物质的合成。而在6mmol/L13CH3OH处 理 矮 牵 牛 中 [U-13C]Fruc和[U-13C]Gluc的生成量显着大于2mmol/L13CH3OH处理,说明有更多来自13CH3OH的13C标记被整合进入卡尔文循环并流向糖类物质的合成。然而在本实验固体MS培养条件下,2mmol/L甲醇对矮牵牛生长的刺激作用效果最好。如果CH3OH刺激植物生长的效果是依靠其代谢产生的碳源供给,那么高浓度(6mmol/L)CH3OH应该具有更强的刺激效果,但在MS培养基中添加6mmol/L CH3OH对矮牵牛生长的促进作用效果不如2mmol/L CH3OH。
这些结果说明来自甲醇代谢的碳源虽然被卡尔文循环同化为糖类物质或有机酸的碳骨架,但这部分碳源对促进植株生长的贡献不大,即本实验证据不支持碳源假说。甲醇代谢在植物体内的作用应该是使甲醇氧化产生的有毒物质HCHO、HCOOH通过卡尔文循环的同化作用进行脱毒。本研究结果证实外源性13CH3OH被矮牵牛吸收后在矮牵牛体内有游离13CH3OH的积累。因此我们推测应该是游离甲醇可能以某种调控信号分子的形式发挥作用而刺激植物的生长。
参考文献:
[1]ROBERT C,MACDONALD,RAY F.Detction of substantial emissions of methanol from plants to the atmosphere[J].Atmospheric Envi-ronment,1993,27(11):1 709-1 713.
[2]COSSINS E A.The utilization of carbon-1compounds by plants:I.The metabolism of methanol-C14and its role in amino acid biosynthesis[J].Canadian Journal of Biochemistry,1964,42(12):1 793-1 802.
[3]GOUT E,AUBERT S,BLIGNY R,et al.Metabolism of methanol in plant cells.Carbon-13nuclear magnetic resonance studies[J].PlantPhysiol.,2000,123(1):287-296.
[4]NONOMURA A M,BENSON A A.The path of carbon in photosynthesis:improved crop yields with methanol[J].Proceedings of theNational Academy of Science of the United States of America,1992,89(20):9 794-9 798.
[5]NADALI I,PAKNEJAD F,MORADI F,et al.Effects of methanol on sugar beet(Beta vulgaris)[J].Australian Journal of Crop Sci-ence,2010,4(6):398-401.
[6]LI Y C,GUPTA G,et al.Effect of methanol on soybean photosynthesis and chlorophyll[J].Journal of Plant Nutrition,1995,18(9):1 875-1 880.
[7]LI Z R,YI X F.Effect of mmethnol with different concentration on photosynthesis and yield of leaf-used lettuce[J].Journal of InnerMongolia Normal University(Nat.Sci.Edi.)(内蒙古师范大学学报· 自然科学汉文版),2004,33(1):71-73(in Chinese).
[8]ZBIEC I,KARCZMARCZYK S.Effect of methanol on some plants[J].Journal of Romanian Agricultural Research,1997:7-8.
[9]MIRAKHORI M,PAKNEJAD F,MORADI F,et al.Effect of drought stress and methanol on yield and yield components of soybean Max(L 17)[J].American Journal of Biochemistry Biotechnology,2009,5(4):162-169.
[10]MU L L(慕莉莉).Influence of methanol on plant growth[J].Modern Agricultural Sciences and Technology(现代农业科技),2010,(11):13-14(in Chinese).
[11]THEODORIDOU A,DORNEMANN D,KOTZABSIS K.Light-dependentinduction of strongly increased microalgal growth by methanol[J].Biochimica et Biophysica Acta(BBA)-General Subjects,2002,1 573(2):189-198.
[12]GUREL A,COSKUN O,ARMUTCU F,et al.Vitamin E against oxidative damage caused by formaldehyde in frontal cortex and hippo-campus:Biochemical and histological studies[J].Journal of Chemical Neuroanatomy,2005,29(3):173-178.
[13]GAY C,GEBICKI J.Measurement of protein and lipid hydroperoxides in biological systems by the ferric-xylenol orange method[J].Ana-lytical Biochemistry,2003,315(1):29-35.
[14]HEMMING D,CRIDDLE R,HANSEN L.Effects of methanol on plant respiration[J].Journal of Plant Physiology,1995,146(3):193-198.
[15]ROWE R,FARR D,RICHARDS B.Effects of foliar and root applications of methanol or ethanol on the growth of tomato plants(Lycop-ersicon esculentum Mill)[J].New Zeal Journal of Crop and Horticultural Science,1994,22(3):335-337.
[16]FRANCS-SMALL C,AMBARD-BRETTEVILLE F,et al.Identification of a major soluble protein in mitochondria from nonphotosyn-thetic tissues as NAD-dependent formate dehydrogenase[J].Plant Physiol.,1993,102(4):1 171-1 177.