
沉香是瑞香科(Thymelaeaceae)沉香属植物在受到伤害后产生的含有树脂的木材, 是一种传统的名贵药材和天然香料, 用于治疗胸腹胀闷疼痛、 胃寒呕吐呃逆、 肾虚气逆喘急等。 健康的沉香属植物并不产生沉香, 只有通过自然因素(雷劈、 火烧、虫蛀等)或人为因素(砍伤、 打洞、 接菌等)的作用,沉香才会在植物中逐渐形成。 对于沉香的结香机制目前虽有一些假说, 但还缺乏科学依据。 白木香[Aquilaria sinensis(Lour.)Gilg]是中国生产沉香的唯一植物资源, 该植物是一种热带、 亚热带常绿乔木, 现已被列为国家二级濒危保护植物, 在中国海南、 广东、 广西、 福建、 台湾等省(区)均有分布。
研究结果表明, 倍半萜是沉香的主要特征性成分, 对倍半萜生物合成和表达调控的研究将有助于对沉香形成机制的理解。 倍半萜的生物合成是由两分子的异戊烯基焦磷酸(isopentenyl diphosphate,IPP)和一分子的二甲基丙烯基焦磷酸(dimethylallyldiphosphate, DMAPP)反应生成法呢基焦磷酸(farnesyl-pyrophosphate synthase, FPP), 然后 FPP 在倍半萜合酶的作用下合成相对应的倍半萜。 愈创木烯合酶(Sesquiterpene guaiene synthases, SGS)催化 FPP合成愈创木烯倍半萜类化合物。 Kumeta 等克隆了 Aquilaria crassna 中的 SGS 基因, 进行相关的表达研究; Xu等克隆了白木香愈创木烯合酶基因(Aquilaria sinensis Sesquiterpene guaiene synthases,AsSGS), 分析了白木香树受伤前后 AsSGS 的表达变化, 但 AsSGS 的表达调控机制的研究鲜见报道。
本研究利用染色体步移的方法克隆了 AsSGS 启动子并利用瞬时表达系统对其功能进行初步鉴定, 这为进一步研究 AsSGS 表达调控机制, 阐明沉香的结香机制及倍半萜的生物合成途径奠定了基础。
1、材料与方法
1.1材料
白木香树干组织采集于中国热带农业科学院热带生物技术研究所区内 5 年生白木香树。 本生烟草(Nicotiana benthamiana) 种子 、 大肠杆菌 (E. coli)DH5α、 根 癌 农 杆 菌 (Agrobacterium tumefaciens)GV3101 菌 株 、 pCAMBIA1381Z 和 pCAMBIA1301植物表达载体由本实验室保存。 用于构建染色体步移文库的试剂盒 LA PCRTMin vitro Cloning Kit、pMD19-T 载体、 限制性内切酶 、 DNA 聚合酶 、 T4连接酶、 IPTG 和 X-gal 等均购于 TaKaRa 公司;DNA 凝胶回收试剂盒购于 QIAGEN 公司 ; 普通质粒小提试剂盒购于 Real-Times 公司。
1.2方法
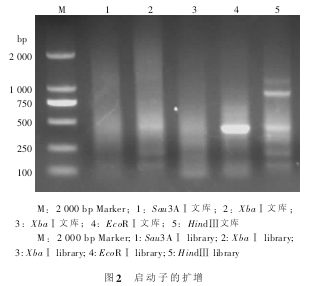
1.2.1染色体步移文库的构建 白木香 DNA 的提取参照赵翱等的方法。 染色体步移文库的构建按照 TaKaRa 公司 LA PCRTMin vitro Cloning Kit 使用说明书进行。 使用 5 种产生粘性末端的限制性内切酶(Sau3AⅠ、 HindⅢ、 EcoRⅠ、 MflⅠ、 XbaⅠ)分别对白木香树基因组 DNA 进行酶切消化, 并对酶切消化后的 DNA 进行纯化。 然后把纯化的 DNA与试剂盒提供的接头连接, 构建成 5 种染色体步移文库(Sau3AⅠ库、 HindⅢ库、 EcoRⅠ库、 MflⅠ库、 XbaⅠ库)。
1.2.2引物的设计 根据 AsSGS 的序列(GenBank登录号: KC149961)设计 2 条反向巢式 PCR 特异引物 S1(5′-CAGCAGAAGTTCCACAATCTGAGCCACC-3′)和S2(5′-CAAGAAGTTGGAAGA ATGA GTGAGGA-3′); 试剂盒提供引物 C1(5′-GTACATATTGTGGTTAGAACGCGTAA TACGACTCA-3′)和C2(5′-GTTAGAACGCGTAATACGACTCACTATAGG GAGA-3′)作为正向引物进行巢式 PCR。
1.2.3 AsSGS启动子的分离 第 1 轮 PCR 反应:在 5 个 0.25 mL PCR 管中分别加入 5 种 DNA 文库0.5 μL, 然后依次加入 10×LA PCR 缓冲液Ⅱ 2 μL、2.5 mmol/L 的 dNTPs 2 μL, 引物 C1 1 μL, 引物S1 1 μL、 LA Taq 0.5 μL, 补水至 20 μL。 混匀后首先在 94 ℃预变性 3 min, 然后在 94 ℃ 30 s, 55 ℃2 min, 72 ℃ 1 min 进行 35 个循环 , 最后 72 ℃延伸 5 min。 第 2 轮 PCR 反应: 分别取第 1 轮 PCR产物 1 μL 稀释 500 倍作为第 2 轮 PCR 反应的模板, 然后依次加入 10×LA PCR 缓冲液Ⅱ 2 μL、2.5 mmol/L 的 dNTPs 2 μlL, 引物 C2 1 μL, 引物S2 1 μL、 LA Taq 0.5 μL, 总反应体系为 20 μL。
混匀后进行如下 PCR 反应: 94 ℃预变性 3 min, 在94 ℃ 30 s, 58 ℃ 2 min, 72 ℃ 1 min 20 s 进行 35个循环; 最后 72 ℃延伸 5 min。 PCR 产物回收、 纯化后克隆到 pMD19-T 载体上并送北京诺赛生物技术有限公司测序。
1.2.4序列生物信息学分析 利用 Neural NetworkPromoter Prediction 在线对 AsSGS 基因的启动子区的基本结构进行分析对分离的基因启动子的调控元件进行在线分析。
1.2.5 AsSGS启动子的5′缺失体植物表达载体的构建 根据已获得的基因启动子的序列设计引物,并将双酶切位点引入不同长度 5′缺失的启动子。设计引物如下:

PCR 分别扩增含酶切位点不同大小的 5′ 缺失启动子片段, 并将它们分别克隆到 PMD19-T 载体上, 测序验证。选择 pCAMBIA1381Z 作为瞬时表达载体, 分别对表达载体和插入了缺失启动子片段的 PMD19-T 载体进行双酶切, 琼脂糖凝胶电泳检测双酶切效果。 T4连接酶将表达载体和缺失片段连接起来,用载体引物 PCR 对构建好的表达载体进行验证。构建好的植物载体如图 1。

1.2.6植物表达载体转化烟草 分别将验证好的5个重组质粒、 pCAMBIA1381Z和pCAMBIA1301质粒用电融合法导入农杆菌GV3101感受态细胞中。 30 ℃恒温培养箱培养48 h, 挑取单菌落, pCAMBIA1381Z载体引物PCR验证阳性克隆。 将验证正确的单菌落扩大培养, 培养至OD600=0.6~0.8, 加悬浮液(MES+MgCl2+AS)静置2 h, 采用农杆菌介导的真空渗透法转化本生烟草, 28 ℃光照培养箱培养48 h。
1.2.7 GUS染色和GUS活性检测GUS 染色: 取3 片转化了表达载体的本生烟草 , 加入 GUS 蛋白染色液, 24 h 后用 75%酒精进行脱色。GUS 定量测定: 取 0.1 g 烟草样品用液氮磨成粉末, 将粉末转移至 1.5 mL 离心管, 加入 400 μL蛋白抽提缓冲液(50 mmoL/L 磷酸缓冲液 pH7.0、 0.1%Triton X-100、 0.1%SDS; 10 mmoL/L β-巯基乙醇、10 mmoL/L Na2-EDTA), 混匀 , 冰上静置 10 min,12 000 r/min 离心 10 min 后吸取上清, 此上清即为总蛋白提取液。 采用 Bradford法测定总蛋白浓度,将总蛋白提取液与考马斯亮蓝溶液反应, 用酶标仪测定其总蛋白浓度。 采用 Jeferson法测定 GUS 蛋白活性, 结果以所生成的 4-MU 的量与总蛋白含量和时间的比值 pmol/mg·min 表示。 所有试验至少重复 3 次。
2、结果与分析
2.1 AsSGS启动子的克隆
通过 2 轮 PCR 扩增后, 在 HindⅢ和 EcoRⅠ 2个文库中扩增出清晰的条带(图 2), 将 HindⅢ库中扩增获得的较大片段克隆到载体后测序。 测序结果分析片段长为 902 bp, 其中 111 bp 序列与 NCBI数据库中 AsSGS 的翻译起始位点下游的序列完全一致, 表明克隆了 791 bp 的 AsSGS 启动子序列。 序列分析表明获得的序列中 A/T 含量高达 64.6%, 符合真核生物启动子序列的特征。
2.2 AsSGS启动子功能元件预测分析
对获得的 AsSGS 启动子序列进行功能元件预测分析表明, 核心启动子区域位于-109~-60 bp,其可能的转录起始位点位于翻译起始位点上游 69 bp处。 采用 Plant CARE 数据库和植物顺式元件查询数据库 PLACE(图 3), 对 AsSGS 启动子的顺式作用元件分析, 结果显示, 该序列具有启动子核心序列 TATA-box 和增强子元件 CAAT-box 等多个典型的真核生物启动子基本元件。 同时存在如赤霉素反应元件 GARE-motif, ABA 的应答元件 G-Box 和ABRE, 生长素响应元件 TGA-element 等参与激素调控的应答元件。 同时还存在光应答元件 BoxⅠ、GA-motif、 TCT-motif, 热胁迫反应的 HSE; 厌氧诱导元件 ARE 和增强诱发厌氧反应的 GC-motif 等顺式作用元件(表 1)。

2.3植物表达载体的构建
根据对 AsSGS 启动子序列中顺式作用元件分析结果设计引物, 通过 PCR 扩增获得不同长度的 AsSGS启动子片段(791、 633、 511、 298 bp 和 154 bp)。
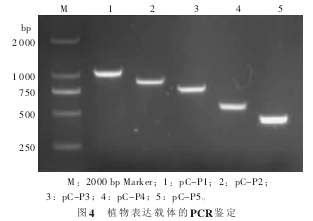
将这些片段克隆到 pMD19-T 载体上, 经 BamHⅠ和 HindⅢ双酶切, 与同样经过双酶切的植物表达载体 pCAMBIA1381Z 连接, 重组 质粒经 PCR 鉴定, 得到 5 个与预期大小一致的片段(图 4), 并且对重组质粒进行测序, 结果表明插入片段序列正确, 植物表达载体构建完成, 分别命名为pC-P1、pC-P2、 pC-P3、 pC-P4 和 pC-P5。
2.4 AsSGS启动子功能初步鉴定
利用农杆菌介导的真空渗透法将构建好的植物表达载体侵染本生烟草叶片, 经 GUS 蛋白染色发现, 含有 pC-P1、 pC-P2、 pC-P3、 pC-P4 和 pC-P5植物载体的农杆菌侵染的烟草叶片都显蓝色, 阳性对照pCAMBIA1301也显蓝色 , 阴性对照pCAMBIA1381Z 不显蓝色, 结果表明, 所有片段都能驱动 GUS 的表达(图 5), -154 bp 的 P5 片段可以驱动 GUS 的表达, 说明预测的核心启动子区域(-109~-60 bp)是正确的。
此外对含有 pC-P1、 pC-P2、 pC-P3、 pC-P4和 pC-P5 植物载体的农杆菌侵染的烟草叶片进行GUS 蛋白活性定量分析 , 结果表明 , 所有缺失片段均具有活性。 在缺失的启动子中, 随着启动子片段的大小的改变, GUS 活性发生改变, GUS 活性与启动子片段的长度成正相关(图 6)。 序列分析发现启动子上在-722~-718 bp、 -606~-601 bp、 -402~-398 bp、 -376~-371 bp、 -208~-204 bp 等处有增强子元件 CAAT-box, 这可能是导致片段越长 GUS活性越高的原因。 但 P4 片段明显高于 P5 片段,可能 在-298~-155 bp区域有其他增强子元件 ,然而P3片段的活性又弱于 P4 片段 ,可能是在-511~-298 bp 间存在抑制元件。
3、讨论与结论
沉香作为名贵药材和天然香料具有重要的经济价值, 在自然条件下白木香结香时间很长, 且含量低, 提高沉香的产量对发展沉香产业具有重要意义。 目前对白木香和沉香研究主要集中在相关化学成分分析及药理的研究, 而缺乏对沉香的生物合成及调控机制的研究。
Kumeta 等证明了越南沉香(Aquilaria crassna)中的 SGS 基因表达受茉莉酸甲酯的诱导; Xu等发现伤害处理可以诱导 AsSGS 表达, 但二者均未对 SGS 的表达调控机制进行研究。 启动子是基因的一个重要组成部分, 控制基因表达的起始时间和表达的程度, 对研究基因表达调控具有重要的作用。 本研究克隆了 791 bp 的 AsSGS 的启动子并进行功能的初步分析, 发现 AsSGS 启动子含有多种激素诱导应答元件(如赤霉素反应元件 GARE-motif,ABA 的应答元件 ABRE, 生长素响应元件 TGA-element), 表明 AsSGS 的表达受多种激素调控, 这是首次对白木香在沉香形成关键基因 AsSGS 表达调控的相关报道。

通过改变植物次生代谢产物合成途径中的关键酶基因的表达来提高次生代谢物的产量已有报道,如在青蒿中过量表达法尼基焦磷酸合酶基因, 青蒿素的含量与对照相比提高了 4 倍; Daudonnet等将来源酵母的法尼基焦磷酸合酶基因在烟草中超表达, 固醇和胡萝卜素的水平得到提高。 如果在白木香树中提高倍半萜合酶基因的表达量, 就有可能提高白木香树的倍半萜的量, 从而提高沉香的产量。
目前白木香树的转基因体系还不成熟, 通过转基因在白木香树中过量表达倍半萜合酶基因还很困难。
但通过对 AsSGS 的调控机制的深入研究, 明确AsSGS 的表达调控机制, 有可能通过激素或化学调控等方式调控 AsSGS 的表达。 启动子活性、 基因表达和基因产物三者之间有紧密关系。 通过提高启动子的活性来增强倍半萜合酶基因的表达, 产生更多的倍半萜合酶, 最终增加倍半萜的产量, 这为提高沉香的产量提供了可能。
参考文献:
[1] 张 争, 杨 云, 魏建和. 白木香结香机制研究进展及其防御反应诱导结香假说[J]. 中草药, 2010, 1(41): 156-159.
[2] 中华人民共和国药典委员会. 中华人民共和国药典 (一部)[M].北京: 化学工业出版社, 2010: 172.
[3] 梅文莉, 杨德兰, 左文健, 等. 奇楠沉香中2-(2-苯乙基) 色酮的GC-MS 分析鉴定[J]. 热带作物学报, 2013, 34(9): 1 819-1 824.
[4] 杨峻山. 沉香化学成分的研究概况[J]. 天然产物研究与开发 ,1998, 10(1): 99-103.
[5] 梅文莉 , 曾艳波 , 刘 俊 , 等. 五批国产沉香挥发性成分的GC-MS 分析[J]. 中药材, 2007, 30(5): 551-555.