植物病理学论文第六篇:辣椒疫霉菌防治中病毒诱导基因沉默技术的应用
摘要:由辣椒疫霉菌(Phytophthora capsici)引起的辣椒疫病是生产中最严重的病害之一。本研究利用病毒诱导的基因沉默(virus induced gene silencing, VIGS)技术,通过瞬时表达疫霉菌基因沉默信号,在本氏烟草(Nicotiana benthamiana)-疫霉菌互作系统中建立寄主诱导的基因沉默(host-induced gene silencing,HIGS)体系,为防治辣椒疫病提供新思路。首先,在TRV2-GFP和对照TRV2-GUS的本氏烟叶片上接种表达GFP的致病疫霉菌菌株14-3-GFP,结果显示TRV2-GFP植株中致病疫霉菌的GFP表达显着降低,表明利用VIGS技术构建的HIGS体系在本氏烟草—疫霉菌体系中可行。此外,选取辣椒疫霉菌致病相关基因 PcAvh1、 Pchmp1和 PcGK4,构建到TRV2载体上,通过在本氏烟草中表达结合接种辣椒疫霉菌,结果显示,与对照相比植物生长表型无明显变化,表达TRV2- PcGK4的植株对辣椒疫霉菌表现抗病,表达TRV2- PcAvh1和TRV2- Pchmp1的植株对辣椒疫霉菌的抗感性没有显着影响,表明 PcGK4可能是辣椒疫霉菌致病必须的基因之一。以上结果表明,利用HIGS技术沉默辣椒疫霉菌 PcGK4基因可有效降低辣椒疫霉菌对寄主的侵染,HIGS技术可用于辣椒疫霉菌致病关键基因的筛选和鉴定。
关键词:VIGS; HIGS; 辣椒疫霉菌; 抗病;
Host-induced Gene Silencing is Effective against Phytophthora capsici in Nicotiana benthamiana
GUO Yalu LIU Zheng YAN Ting DU Yu SHAN Weixing
College of Horticulture, Northwest A&F University College of Agronomy, Northwest A&F University
Abstract:Phytophthora capsici is one of the most notorious diseases in pepper production. This study, we used VIGS technique to transient express gene silencing signals of Phytophthora to establish the Nicotiana benthamiana-Phytophthora host induced gene silencing(HIGS) system to provide new ideas for controlling. First of all, we inoculated GFP labeled Phytophthora infestans isolate 14-3-GFP on TRV-GFP and TRV-GUS expressed N. benthamiana leaves, and observed a clear reduction of GFP fluorescent in mycelium of 14-3-GFPon TRV-GFP plants than control, which indicate the HIGS is applicable in Nicotiana benthamiana-Phytophthora system. Furthermore, we cloned the P.capsici virulence related genes PcAvh1, Pchmp1 and PcGK4, and constructed them into TRV2 vector. After expressing them in N.benthamiana, we inoculated P.capsici and screened for plant resistance. Results showed that, TRV- PcAvh1, TRV- Pchmp1 and TRV- PcGK4 plants showed no difference in plant growth and morphology. TRV- PcGK4 plants are resistant to P.capsici compering to control, showed by reduced lesion area. The lesion areas and P.capsici biomass of TRV- Pchmp1 and TRV- PcAvh1 plants were comparable to control. PcGK4 may be one of the necessary genes for P.capsici pathogenicity. Taken together, our results indicate PcGK4 is a good target for HIGS and HIGS technique can be used to screen and identify key pathogenic genes of P.capsici.
寄主诱导的基因沉默技术(host-induced gene silencing,HIGS),指将连有病原菌目的基因片段的反义发卡结构转入寄主植物中,引发寄主植物产生与病原菌中目的基因同源的特异双链 RNA(dsRNA),植物识别 dsRNA 后通过核酸内切酶将其切割成21~35个碱基的SiRNA,当病原菌侵染寄主植物时,这些 siRNA被病原菌吸收,使病原菌中的特定序列产生双链 RNA(dsRNA),导致病原菌中的目的基因下调[1,2]。HIGS技术的优点是靶向性高、通用性强和操作简便快速,既可以鉴定病菌基因的功能,又可以控制病菌扩展,提高植物抗病性。
HIGS技术已经应用在寄生植物、真菌、线虫、以及卵菌等病原系统中[3,4,5,6,7,8,9,10,11,12]。在卵菌的应用中,利用HIGS技术将致病疫霉菌(Phytophthora infestans)效应基因 PiAvr3a沉默,马铃薯植株表现出一定程度的抗病现象[13]。Jahan等[14]选取在致病疫霉菌侵染过程中起重要作用的 PiGPB1、 PiCESA2和 PiPEC以及参与基础细胞维持的 PiGAPDH基因作为 HIGS靶标,发现对比野生型的非转基因马铃薯植株,沉默 PiGPB1降低了致病疫霉菌的生物定殖量,植物表现抗病表型, PiGPB1在转录水平表达量下降,转基因植物检测出特异的siRNA,说明 HIGS技术是否成功高度依赖目标基因的选择。同样,研究证明采用 HIGS技术提高了莴苣对霜霉病菌卵菌盘梗霉(Bremia lactucae)的抗性[12]。以上研究表明,HIGS技术在植物-卵菌互作中可以有效利用。以上卵菌HIGS 研究均采用 RNAi 载体稳定转化植物,试验周期较长,工作量较大。病毒诱导的基因沉默(virus induced gene silencing,VIGS)技术可快速地在植物中实现瞬时沉默,已用于真菌 HIGS研究[15],有潜力用于提高HIGS 研究效率。
本研究通过采用 VIGS技术在寄主植物中表达疫霉菌基因片段,研究其用于提高HIGS 效率鉴定疫霉菌致病关键基因的潜力。致病疫霉菌 Pihmp1编码吸器细胞膜特异蛋白,其沉默显着减弱致病疫霉菌的致病性[16];G蛋白偶联受体蛋白基因 GK4与致病疫霉菌的孢子萌发、菌丝生长发育以及毒性功能相关[17]; PcAvh1是辣椒疫霉菌的一个 RXLR效应蛋白基因,具有重要的毒性功能[18]; SGT1 参与植物防卫信号和抗病途径[19],其沉默导致植物表现更感病,植株生长矮小,叶片皱缩卷曲;PDS(八氢番茄红素脱氢酶)参与植物类胡萝卜素的合成,其沉默导致叶片出现白化现象[20]。本试验以GUS、GFP、PDS和 SGT1作为报告基因,研究基于 VIGS基因瞬时沉默技术的 HIGS技术用于本氏烟草-疫霉菌互作的潜力。
1 材料与方法
1.1 材 料
培养基 LB、CA、RSA、抗生素卡那霉素、四环素、农杆菌感受态 C58C1、大肠杆菌感受态 DH5α、辣椒疫霉菌(Phytophthora capsici )菌株1112、致病疫霉菌(Phytophthora infestans)菌株14-3-GFP、病毒载体 TRV1和 TRV2均为笔者所在实验室配制与保存。所用试剂主要有高保真 DNA聚合酶、限制性内切酶、T4 DNA连接酶、rTaq DNA聚合酶、胶回收试剂盒、质粒提取试剂盒等。所用仪器主要有 Eppendorf 4308电击仪、PCR仪(Bio Rad)、荧光显微镜(Olympus)、旋转摇床及生化培养箱等。
1.2 方 法
1.2.1 载体构建
试验所用引物见表1,克隆基因 PcGK4(PITG_05519)、 PcAvh1(EU282489.1)和 Pchmp1(PITG_00375),酶切目的基因与 TRV2载体片段,用 T4连接酶进行连接,产物通过电击转化大肠杆菌感受态细胞,培养在选择培养基上,采用菌落 PCR方法检测阳性克隆,测序确认载体构建成功。
1.2.2 质粒转化及农杆菌注射
载体构建成功后,电击转化农杆菌 C58C1感受态。挑取阳性单菌落培养在带有抗性的液体 LB培养基中至OD600为0.8~1.0,收集菌体,配制加有乙酰丁香酮(1×10-4 mol/L)的 MES重悬液,重悬菌体 OD600为0.6,将 TRV1和 TRV2按体积比1∶1混合后室温静置1~3 h,用注射器注射3周左右本氏烟草的第1片和第2片真叶,选择 TRV2-GUS,TRV2- SGT1作为对照,TRV2-PDS作为报告基因,每个试验组选取8棵植物,注射18 d后进行后续试验。
表1 引物序列

1.2.3 离体叶片接种致病疫霉菌及荧光观察
致病疫霉菌中加入5 mL预冷的无菌蒸馏水,至菌丝完全浸润,置于4 ℃,用2 h观察游动孢子的释放,并于显微镜下计数。
取 TRV2-GUS和 TRV2-GFP叶片涮洗干净,吸干多余水分用湿水脱脂棉包裹叶柄处,放于底部铺有湿水滤纸的塑料托盘中,在叶子左右两边对称位置各接种1 000个致病疫霉菌的游动孢子(15~20 μL),保鲜膜封闭后放置于16 ℃黑暗培养箱,3 d后观察发病情况。
用刀片划取小块平整致病疫霉菌侵染的病斑区域置于载玻片上,用水浸润后用盖玻片压片,用奥林巴斯荧光显微镜(BX-51TRF,滤光器 BP450-480)进行初步观察并进行图像采集。
1.2.4 离体叶片接种辣椒疫霉菌及病斑统计
参考 Fan等[21]的方法培养辣椒疫霉菌及诱孢,取 TRV2-GUS、 TRV2- Pchmp1、TRV2- PcGK4和 TRV2- PcAvh1叶片,在叶片左右两边对称位置各接种辣椒疫霉菌的游动孢子1 000个(10~12 μL),放于25 ℃黑暗保湿培养,2 d后观察发病情况,并测量病斑直径计算病斑面积和显着性分析(*代表 P≤0.05,**代表 P≤0.01)。
1.2.5
半定量测定辣椒疫霉菌的定殖量接种辣椒疫霉菌2d后,用打孔器收取接种点周围病斑组织,参考 Fan等[21]用CTAB 法提取组织 DNA,本氏烟草、辣椒疫霉菌内参基因NbActin、PcActin(表1)引物序列参照 Fan等[21]和Zhang等[22]的研究。半定量 RT-PCR方法程序设置为:95 ℃预变性5 min,94 ℃变性30 s,50 ℃退火,延伸80 s,28个循环,PCR产物电泳跑胶后用化学发光成像系统(BIO-RAD)拍照。
2 结果与分析
2.1 基于 VIGS的本氏烟草-疫霉菌 HIGS体系的建立
为确定 VIGS载体是否可以成功应用于疫霉菌 HIGS 研究,在 TRV2-GUS和TRV2-GFP的叶片上接种带有 GFP标记的致病疫霉菌株,观察致病疫霉菌菌丝中的GFP 荧光。图1显示,对比对照 TRV2-GUS和TRV2-GFP病斑区域的绿色荧光明显减弱,说明 TRV2-GFP成功沉默了致病疫霉菌菌丝中的GFP。表明本研究利用 VIGS技术在本氏烟草中可实现疫霉菌基因的沉默,为筛选和鉴定可以抑制辣椒疫霉菌侵染的靶标基因提供依据。

图1 TRV2-GFP成功沉默了GFP标记的致病疫霉菌株中的GFP
在TRV2-GUS和TRV2-GFP叶片上接种致病疫霉菌14-3-GFP的游动孢子GFPlabeled P.infestans isolate 14-3-GFP zoospores were inoculated with TRV2-GUSand TRV2-GFP;3d后,使用奥林巴斯荧光显微镜(BX-51TRF,过滤器BP450-480)在白平衡处理4倍镜下进行观察并拍照
After 3days,Olympus fluorescence microscope(BX-51TRF,filter BP450-480)was used and pictures were taken under 4times ocular with white balance
2.2 基于 VIGS的候选基因同源 siRNA 的表达对植株生长表型的影响
本研究将对照基因GUS、GFP、 SGT1和辣椒疫霉菌基因 Pchmp1、 PcGK4和 PcAvh1构建到 TRV2 载体,通过农杆菌介导的瞬时转化在本氏烟草上进行表达,农杆菌转化18 d后观察植物表型,结果显示报告基因 TRV2-PDS出现白化现象,TRV2- SGT1表现植株矮小,叶面卷曲,TRV2-Pchmp1、TRV2-PcGK4和 TRV2-PcAvh1对比对照 TRV2-GUS在植株大小、叶片颜色及形态方面没有明显变化(图2)。

图2 沉默候选基因18 d后本氏烟草的生长表型
2.3 表达TRV2- PcGK4的植物接种辣椒疫霉菌后的表现
对 TRV2- Pchmp1、TRV2- PcGK4和 TRV2- PcAvh1的离体叶片接种辣椒疫霉菌的游动孢子,2 d后观察病斑,结果显示,与对照 TRV2-GUS相比, TRV2- PcGK4叶片上的病斑面积显着减小(图3-A,3-B),植物表现抗病表型,表明 PcGK4在辣椒疫霉菌侵染的过程中起关键作用。TRV2- Pchmp1和TRV2- PcAvh1的病斑面积与对照 TRV2-GUS无显着差异,植物无明显抗病表型(图3)。
2.4 辣椒疫霉菌的定殖量在 TRV2- PcGK4中的表现
对辣椒疫霉菌侵染的 TRV2-GUS、TRV2- PcGK4、TRV2- Pchmp1和 TRV2- PcAvh1的叶片病斑进行打孔收样,用 CTAB法提取基因组 DNA,以本氏烟草和辣椒疫霉菌的内参基因作为引物,通过半定量 RT-PCR测定辣椒疫霉菌生物量。结果显示,本氏烟草内参基因条带在对照TRV-GUS以及TRV2- PcGK4、TRV2- Pchmp1、TRV2- PcAvh1植物样品中亮度一致,而辣椒疫霉菌内参基因条带在TRV2- PcGK4样品中比对照 TRV2-GUS亮度明显减弱(图4-A),表明定殖在 TRV2- PcGK4中的辣椒疫霉菌生物量显着降低。TRV2- Pchmp1和 TRV2- PcAvh1检测出的辣椒疫霉菌内参基因条带与对照亮度无明显差异,表明定殖在上述样品中的辣椒疫霉菌生物量没有变化(图4-B,4-C)。
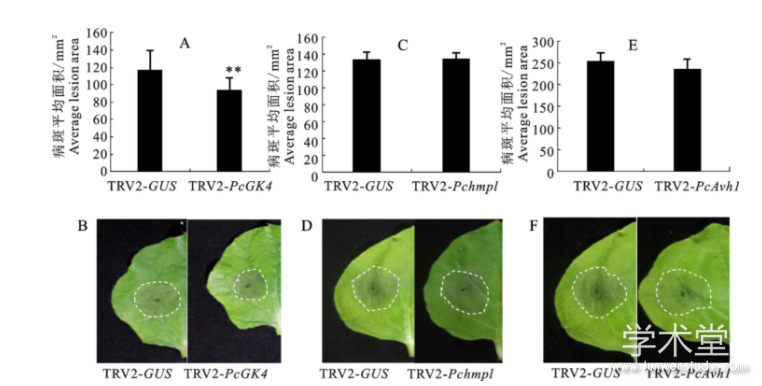
图3 TRV-PcGK4植物表现出对辣椒疫霉菌的抗性
A、C、E为病斑面积统计情况A,C and E represent statistical analysis of lesion area;B、D、F为接种辣椒疫霉菌2d后的叶片B,Dand F represent leaves inoculated with P.capsici after 2days。本氏烟草重复3次结果一致,每个柱形图中用于分析的病斑面积来自于8片叶片,采用t检验进行统计学分析,“**”表示P<0.01 The experiments were repeated three times with similar results(n≥8;onesided Student’s t test,“**”indicating P<0.01
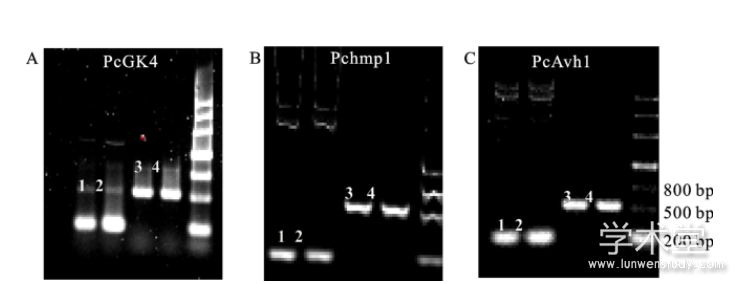
图4 病斑部位辣椒疫霉菌生物量检测
行辣椒疫霉菌的生物量检测RNAs from leaves at 2days after P.capsici1112inoculation was used for P.capsici biomass quantification;1和2使用辣椒疫霉菌内参引物1and 2using the P.capsici internal primer for amplification;3和4使用本氏烟草内参引物3and 4using N.benthamianainternal primer for amplification;2和4以TRV2-GUScDNA为模板2and 4Using TRV2-GUSas template;1和3以TRV-PcGK4,TRV-Pchmp1,TRV-PcAvh1 cDNA为模板1and 3using TRV-PcGK4 or TRV-Pchmp1 or TRV-PcAvh1as template;本氏烟草内参基因条带大小为600bp,辣椒疫霉菌内参基因条带大小为179bp The size of the band from N.benthamianainternal gene is 600bp,and fromP.capsici internal gene is 179bp;该试验结果在3次生物学重复中表现一致The experiment was repeated three times with similar result
3 讨 论
VIGS 是利用植物对RNA 病毒防御机制发展起来的一项技术,目前应用于卵菌HIGS的研究还未见报道。本研究将VIGS 技术应用于疫霉菌HIGS 研究,通过在TRV2-GFP和对照TRV2-GUS的叶片上接种带有GFP标签的致病疫霉菌,发现TRV2-GFP 病斑区域的致病疫霉菌菌丝中的GFP显着降低,证明VIGS 技术在卵菌HIGS 体系中可行。随后成功筛选到在辣椒疫霉菌侵染过程中起关键作用的候选基因 PcGK4。
在植物病原菌传播和感染寄主的过程中,病菌孢子形成和发病机制由包括 g蛋白和磷脂信号的细胞信号网络调控。卵菌 GPCR-PIPKs(GKs)蛋白家族由7个跨膜结构域(7-TM)和磷脂酰肌醇磷酸酯激酶(PIPK)结构域组成,在此基础上GKs有可能连接g蛋白和磷脂信号通路。致病疫霉菌 GK4是G蛋白偶联受体,属于GKS(GPCR-PIPKS)蛋白家族, GK4基因的沉默和过表达不仅参与孢子萌发和菌丝延伸,而且参与孢子囊的裂解和早期侵染,在致病疫霉菌的侵染过程中起重要作用[20]。本研究同样发现沉默辣椒疫霉菌 PcGK4后可以显着降低辣椒疫霉菌的致病力,说明 PcGK4在辣椒疫霉菌侵染过程中起关键作用。
并不是所有的目标基因沉默后都可以抑制病原菌侵染[13],目标基因的选择直接决定沉默效率的高低。本试验筛选到的 PcGK4能显着抑制辣椒疫霉菌的侵染, Pchmp1和 PcAvh1处理的植物对比对照没有明显的抗病表型。分析原因,可能是在辣椒疫霉菌中存在 Pchmp1功能冗余基因或者该基因没有成功被沉默。 PcAvh1已被报道是辣椒疫霉菌中的一个重要的 RXLR毒性效应分子,在辣椒上能够引起严重的黄化褪绿现象[20],但在本试验中没有表型,可能是由于该基因在侵染初期高量表达,没有被HIGS 有效沉默。
HIGS技术目前已应用于多个病原菌系统中,但在卵菌系统中存在争议,在Zhang等[22]的报道中,利用 HIGS技术以寄生疫霉菌的 PnPMA1基因(内源质膜氢离子通道蛋白)和报告基因 GFP为研究对象进行试验,结果显示转化dsGFP的拟南芥未干扰寄生疫霉菌中的 GFP荧光信号,寄生疫霉菌的靶标基因 PnPMA1转录水平未受到影响,同样从病原组织分离的疫霉菌中未检测到同源靶基因 siRNA分子的存在。在之后 Sanju等[13]的报道中,以马铃薯为寄主植物,对致病疫霉菌 Avr3a基因运用 HIGS技术进行沉默,对比非转基因植株,转基因植株 Avr3a基因的表达量下降,致病疫霉菌的生物定殖量降低,转基因植物特异地表达 siRNA,证明 HIGS技术在马铃薯-致病疫霉菌系统中可以有效应用。Jahan等[14]发现转化dsGFP的马铃薯成功沉默了致病疫霉菌菌丝中的GFP基因。与 Jahan等[14]研究结果类似,本研究利用 TRV载体在本氏烟草中也沉默了致病疫霉菌菌丝中的GFP信号。对比Zhang等[22]在拟南芥中的研究,笔者认为可能是寄主植物的差异导致HIGS 技术在卵菌中的应用上产生了差异。
HIGS技术应用在辣椒疫霉菌研究中的报道比较少见,Vega-Arreguín等[23]利用HIGS技术对一个被烟草(N.tabacum)识别的效应蛋白 PcAvr3a1进行沉默,结果促进了辣椒疫霉菌在非寄主烟草(N. tabacum)上的定殖,表明 HIGS技术在辣椒疫霉菌体系中应用可行,但并没有涉及抑制辣椒疫霉侵染的相关基因,本试验首次利用 HIGS技术筛选到抑制辣椒疫霉菌侵染的基因 PcGK4,对辣椒疫病的防控有指导意义。
现阶段,HIGS技术非常关键的科学问题是如何证明植物产生的 siRNA成功进入病原菌细胞并且诱导了靶标基因的沉默,siRNA是通过何种途径向疫霉菌进行转运和累积的,在这些方面未有成熟的机制阐述。本试验中虽然筛选到沉默 PcGK4在植物中具有抗病表型,但没有检测候选基因是否成功进行沉默,之后可以通过定量PCR,Northern blot和RNA测序的方法检测疫霉菌中目标基因的沉默,并且可以在辣椒疫霉菌真正的寄主植物辣椒上验证之前的结果,解析 PcGK4参与辣椒疫霉菌侵染的机理。
参考文献
[1] ESQUELA-KERSCHER A,SLACK F J.Oncomirs-microRNAs with a role in cancer[J].Nature Reviews Cancer,2006,6(4):259-269.
[2] NUNES C C,DEAN R A.Host-induced gene silencing:a tool for understanding fungal host interaction and for developing novel disease control strategies[J].Molecular Plant Pathology,2012,13(5):519-529.
[3] WESTWOOD J H,RONEY J K,KHATIBI P A,et al.RNA translocation between parasitic plants and their hosts[J].Pest Management Science,2009,65(5):7.
[4] LILLEY C J,BAKHETIA M,CHARLTON W L,et al.Recent progress in the development of RNA interference for plant parasitic nematodes[J].Molecular Plant Pathology,2007,8(5):701-711.
[5] ZHANG T,JIN Y,ZHAO J H,et al.Host-induced gene silencing of the target gene in fungal cells confers effective resistance to the cotton wilt disease pathogen Verticillium dahliae[J].Molecular Plant,2016,9(6):939-942.
[6] CHENG W,SONG X SH,LI H P,et al.Host-induced gene silencing of an essential chitin synthase gene confers durable resistance to Fusarium head blight and seedling blight in wheat[J].Plant Biotechnology Journal,2016,13(9):1335-1345.
[7] KOCH A,KUMAR N,WEBER L,et al.Host-induced gene silencing of cytochrome P450 lanosterol C14-demethylase-encoding genes confers strong resistance to Fusarium species[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(48):19324-19329.
[8] NOWARA D,GAY A,LACOMME C,et al.HIGS:host-induced gene silencing in the obligate biotrophic fungal pathogen Blumeria graminis[J].The Plant Cell,2010,22(9):3130-3141.
[9] PLIEGO C,NOWARA D,BONCIANI G,et al.Host-induced gene silencing in barley powdery mildew reveals a class of ribonuclease-like effectors[J].Molecular Plant-Microbe Interactions,2013,26(6):633-642.
[10] DALL'ASTTA R C,DIAS B?RBARA BA,Maria T,et al.In vivo trans-specific gene silencing in fungal cells by in planta expression of a double-stranded RNA[J].BMC Biology,2010,8(1):27.
[11] ANDRADE C M,TINOCO M L P,RIETH A F,et al.Host-induced gene silencing in the necrotrophic fungal pathogen Sclerotiniasclerotiorum[J].Plant Pathology2016,65(4):626-632.
[12] GOVINDARAJULU M,EPSTEIN L,WROBLEWSKI T,et al.Host-induced gene silencing inhibits the biotrophic pathogen causing downy mildew of lettuce[J].Plant Biotechnology Journal,2015,13(7):875-883.
[13] SANJU S,SIDDAPPA S,THAKUR A,et al.Host-mediated gene silencing of a single effector gene from the potato pathogen Phytophthora infestans imparts partial resistance to late blight disease[J].Functional & Integrative Genomics,2015,15(6):697-706.
[14] JAHAN S N,ASMAN A K M,CORCORAN P,et al.Plant-mediated gene silencing restricts growth of the potato late blight pathogen Phytophthora infestans[J].Journal of Experimental Botany,2015,66(9):2785-2794.
[15] 赵玉兰,苏晓峰,程红梅.利用寄主诱导的基因沉默技术验证大丽轮枝菌糖代谢相关基因的致病力[J].中国农业科学,2015,48(7):1321-1329.ZHAO Y L,SU X F,CHENG H M.Verification of verticillium dahliae pathogenicity of glycometabolism related genes by using host-induced gene silencing method[J].Scientia Agricultura Sinica,2015,48(7):1321-1329.
[16] AVROVA A,BOEVINK P,YOUNG V,et al.A novel Phytophthora infestans haustorium-specific membrane protein is required for infection of potato[J].Cellular Microbiology,2010,10(11):2271-2284.
[17] HUA C,MEIJER H J G,KEIJZER J D,et al.GK4,a G-protein-coupled receptor with a phosphatidylinositol phosphate kinase domain in Phytophthora infestans,is involved in sporangia development and virulence[J].Molecular Microbiology,2013,88(2):352-370.
[18] 李艳朋.辣椒疫霉效应蛋白 PcAvh1与植物互作因子的鉴定和功能分析[D].江苏扬州:扬州大学,2016.LI Y P.Identification and functional analysis of the plant interacting factors of Phytophthora capsici effector PcAvhl[D].Yangzhou Jiangsu:Yangzhou University,2016.
[19] AUSTIN M J,MUSKETT P,KAHN K,et al.Regulatory role of SGT1 in early R gene-mediated plant defenses[J].Science,2002,295(5562):2077-2080.
[20] RUIZ M T,VOINNET O,BAULCOMBE D C.Initiation and maintenance of virus-induced gene silencing[J].The Plant Cell,1998,10:937-946.
[21] FAN G J,YANG Y,LI T T,et al.A Phytophthora capsici RXLR effector targets and inhibits a plant PPIase to suppress endoplasmic reticulum-mediated immunity[J].Molecular Plant,2018,11(8):1067-1083.
[22] ZHANG M X,WANG Q H,XU K,et al.Production of dsRNA sequences in the host plant is not sufficient to initiate gene silencing in the colonizing oomycete pathogen Phytophthora parasitica[J].Plos One,2011,6(11):e28114.
[23] VEGA-ARREGUN J C,JALLOH A,BOS J I,et al.Recognition of an avr3a homologue plays a major role in mediating nonhost resistance to Phytophthora capsici in Nicotiana species[J].Molecular Plant-Microbe Interactions,2014,27(8):770-780.