雌激素的缺乏和糖皮质激素的使用是导致骨质疏松症的常见原因。去卵巢致骨质疏松症大鼠模型相对成熟,而对于糖皮质激素注射后大鼠骨量的变化并没有形成共识。本研究应用先进的 QDR4500A型扇形束双能 X 线测定骨密度仪( DXA) 测量糖皮质激素注射后大鼠的全身、离体腰椎、离体股骨和胫骨及其兴趣区的骨密度( BMD) 、骨矿含量( BMC) 、骨骼面积( Area) ,以去卵巢大鼠组作为阳性对照,以假手术 + 未注射糖皮质激素大鼠组作为阴性对照,探讨其在模型中的价值和骨丢失的情况。
1 实验对象和方法
1. 1 大鼠分组和模型的建立
42 周龄雌性 SD 大鼠 21 只( 购自中南大学动物学部 SCXK 2006-0002) ,平均体重 367 g。饲养在22 ℃ ~ 25 ℃ ,每日 12 h 光照,12 h 黑暗的环境中,任意进食中南大学动物学部自产大鼠全价颗粒饲料( 含 1. 53%钙、0. 9% 磷) 和自来水。适应性饲养 2周后,随机分成 3 组: 假手术 + 未注射糖皮质激素组( SHAM) 、去卵巢组( OVX) 、注射甲基强的松龙组( PRED) 。OVX 组: 3% 戊巴比妥钠按 0. 1ml/100g体重腹腔注射麻醉大鼠满意后,取背部正中切口,切开皮肤皮下并向两侧游离皮下组织,在左侧肋下旁开中线 1 横指处剪开肌肉和腹膜,在腹腔脂肪中找到并切除左侧卵巢组织,右侧操作同左侧,逐层缝合并撒青霉素粉剂; SHAM 组手术操作步骤相同但仅切除与卵巢组织大小相似的腹腔脂肪组织; PRED组每日皮下注射甲基强的松龙 2. 5 mg/kg( PfizerManufacturing Belgium,NV) 。
1. 2 DXA 扫描
1. 2. 1 全身 DXA 扫描: 分别于术前( 0 周) 、术后 4周、术后 8 周、处死前( 12 周) 应用 QDR4500A 型扇形束 DXA( Hologic,US) 扫描大鼠并用附带小动物软件进行分析。扫描前用人体腰椎体模和小动物阶梯模型校正。将大鼠麻醉后,取俯卧位行全身扫描,该仪器测定大鼠全身 BMD 的批内 CV 为0. 71%。
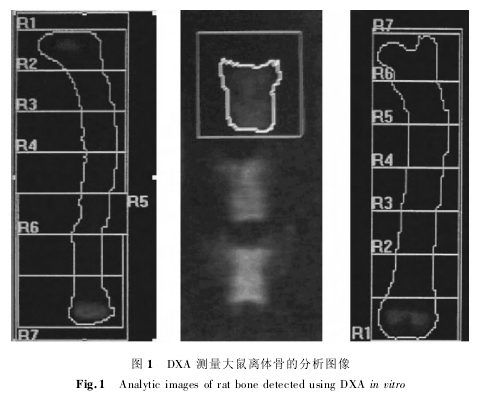
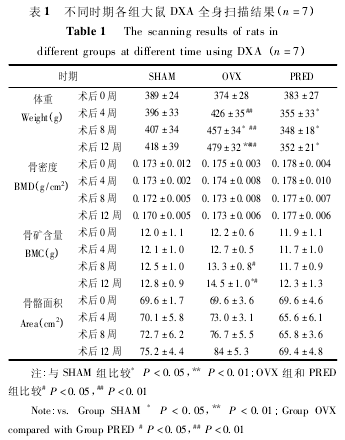
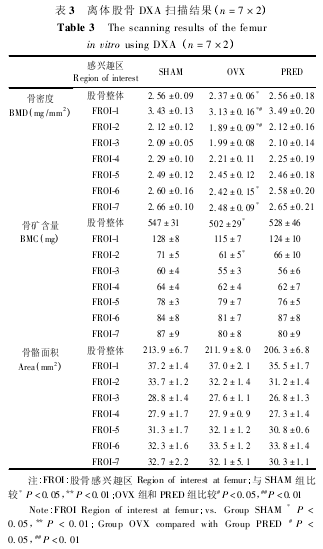
1. 2. 2 离体骨 DXA 扫描: 术后 12 周,行全身 DXA扫描后,处死所有大鼠。取出子宫后,用电子天平( 湖南湘仪厂) 称重。取出双侧股骨、双侧胫骨、腰椎( L4-L6) ,仔细剥离附着的肌肉和结缔组织并分离腰椎,对其行高清晰度扫描。按股骨和胫骨测量图像的长度,将其等分成 7 个区( R1 ~ R7) ,各区被称为感兴趣区( ROI) ,分别测量各区的 BMD、BMC、Area,此分析方法是将各骨骼富含松质骨或皮质骨的成分相对划区,并基于松质骨和皮质骨两者在骨代谢上的差异,从而发现骨丢失的敏感区域。胫骨由近端向远端依次划分,股骨由远端向近端依次划分( 图 1) 。
1. 3 压缩试验
压缩试验是骨生物力学试验中较为重要的一种。完成离体骨 DXA 扫描后,用慢速锯( Buehler 公司,美国) 除去第二腰附件和椎间盘,将圆柱形的腰椎椎体置于力学试验机( CSS44100,长春机械科学研究院有限公司) 的压缩工作台中心位置上,驱动机器以 2 mm/min 的实验速度对试样施加压应力,直至腰椎椎体破坏。连续记录载荷应变曲线( Load-deformation Curves) 并计算出最大载荷 ( maximumloading,ML) 和弹性模量( elastic modulus,EM) 。
1. 4 统计学处理
用 SPSS16. 0 统计软件进行统计分析,各指标以均数 ± 标准差( x珋 ± s) 表示,组间均数先进行 χ2正态分布和方差齐性检验,若符合正态分布和方差齐性,则采用单因素方差分析( one-way ANOVA) ,多重比较再采用 LSD-t 检验。若不符合正态分布和方差不齐性,则采用多重秩和检验,多重比较用 Mann-Whiteney 法,P < 0. 05 表示差异有显着性。
2 结果
2. 1 术后 12 周子宫重量
术后 12 周 SHAM 组子宫重量( 654 ± 51) mg,OVX 组子宫重量 ( 132 ± 9 ) mg,约是 SHAM 组的0. 20 倍,PRED 组子宫重量为 ( 613 ± 60 ) mg。与SHAM 组比较,OVX 组子宫重量非常显着降低( P <0. 01) ,PRED 组与 SHAM 组之间无差异显着性。
2. 2 大鼠全身 DXA 扫描结果
表 1 显示了 3 组大鼠在术前( 0 周) 、术后 4 周、术后 8 周、处死前( 12 周) 不同时期的体重、BMD、BMC、Area 的变化情况。SHAM 组大鼠体重增长缓慢,在术后 4 周、8 周、12 周时较 0 周分别增长了1. 80% 、4. 63% 、7. 46% 。大鼠在去除卵巢后体重迅速增加,在 4 周、8 周、12 周时较 0 周分别增长了13. 90% 、22. 19% 、28. 07% ,从第 8 周开始体重显着重于同时期的 SHAM 组大鼠( 8 周时 P <0. 05,12 周时 P <0. 01) 。大鼠在皮下注射甲基强的松龙后体重迅速减轻,在 4 周、8 周、12 周时较 0 周分别减轻了 7. 31%、9. 14%、8. 09%,从第 4 周开始体重显着轻于同时期的 SHAM 组大鼠( P < 0. 05) ,非常显着轻于同时期 OVX 组大鼠( P <0. 01) 。虽然 OVX 组大鼠骨骼面积有逐渐增加的趋势,但是同时期各组大鼠 BMD、Area 之间无差异显着性,OVX 组大鼠BMC 在第 12 周时显着高于同时期 SHAM 组大鼠( P< 0. 05) ,在第 8、12 周时显着高于 PRED 组大鼠( P< 0. 05) 。
2. 3 离体骨 DXA 扫描结果
2. 3. 1 离体腰椎 DXA 扫描结果( 表 2) : 与 SHAM组比较,OVX 组第 5、6 腰椎 BMD 显着降低( P <0. 05) ,降低幅度分别为 10. 28% 、11. 49% ,第 6 腰椎 BMC 亦显着降低( P <0. 05) 。PRED 组与 SHAM组比较,BMD、BMC、AREA 均无明显差异。OVX 组第 5、6 腰椎 BMD、第 6 腰椎 BMC、Area 亦显着低于PRED 组。
2. 3. 2 离体股骨和胫骨 DXA 扫描结果 ( 表 3、表4) : 与 SHAM 组比较,大鼠去卵巢 12 周后整体股骨及其远端( FROI-1、2) 和近端( FROI-6、7) 各两个区域、胫骨近端一个区域( TROI-1) BMD 显着丢失,其中以松质骨组成占优势的 TROI-1( -11. 40%) 和FROI-2( -10. 85% ) 骨丢失率最大,股骨中段( FROI-3 ~ 5) 和整体胫骨及其中段( TROI-2 ~ 4) 部分区域BMD 无显着性变化,以皮质骨组成占优势的胫骨中远段 TROI-5( 7. 85%) 和 TROI-6( 8. 65%) BMD 显着增加。去卵巢后整体股骨及其远端( FROI-2) 、胫骨近端一个区域( TROI-1) BMC 显着减少,而骨面积无显着变化。
与 SHAM 组比较,甲基强的松龙注射大鼠12 周后整体股骨和股骨各个感兴趣区的 BMD、BMC、AREA 无显着性差异,整体胫骨和胫骨各个感兴趣区 BMD 无显着性差异,胫骨中远段( TROI-5、6)BMC、AREA 显着性增加。
2. 4 骨生物力学指标变化
第二腰椎压缩试验参数见表 5。OVX 组最大载荷与弹性模量显着低于 SHAM 组( P <0. 01) ,PRED组最大载荷显着低于 SHAM 组( P <0. 05) ,OVX 组与 PRED 组间无统计学差异。
3 讨论
目前,骨质疏松症日益增多,雌激素的缺乏和糖皮质激素的使用分别是原发性骨质疏松症和继发性骨质疏松症的最常见病因。部分患者由于某些疾病比如哮喘、红斑狼疮、肾病综合症等需要长期使用糖皮质激素,成人口服强的松 6 个月将导致腰椎骨量下降 5% ~ 15% 并使骨折风险增加。大鼠是研究骨质疏松症的常用模型动物之一,但是现有研究对于大鼠接受糖皮质激素后骨量的变化并没有一致结论。有研究表明,甲基强的松龙能增加 5 周龄大鼠胫骨干骺端 BMD,降低 8 周龄大鼠胫骨干和32 周龄大鼠腰椎的 BMD。Hulley PA 等给 3. 5月龄大鼠皮下注射甲基强的松龙 3. 5 mg/( kg·d) ,9周后发现股骨 BMD 显着下降。Ferretti JL 等应用肢端定量 CT( pQCT) 分别分析皮质骨和松质骨BMD,发现大剂量糖皮质激素能降低 30 日龄股骨骨皮质 BMD,而 McHugh NA 等却在 7 日龄大鼠胫骨骨皮质中得出了不一致的结论。
上述研究表明糖皮质激素导致的 BMD 改变与大鼠的年龄和测定部位显着相关。因此,在我们的实验中,笔者选用 44 周龄( 大于 10 月龄) 成年雌性大鼠,减少了增龄的影响,而且全面测定各个部位BMD,排除部位特异性,并且以获得广泛共识的模拟绝经后骨质疏松症的去卵巢雌性大鼠模型作为阳性对照。
我们的研究发现 SHAM 组大鼠体重增加缓慢,在 56 周龄时仅较 44 周龄时增加了 7. 46%,BMD、BMC 等指标相对恒定,表明大鼠成年后增龄对其骨量无显着影响。大鼠接受甲基强的松龙后,与SHAM 组比较其全身骨骼、腰椎、股骨及股骨各区、胫骨及胫骨各区( 除 TROI-5、6 外) 的 BMD、BMC、Area 指标没有显着改变。PRED 组大鼠体重显着下降,这是由于其导致了肌肉组织萎缩和脂肪重新分布,但是 BMD、BMC 亦没有对体重减轻产生适应性改变,可能是体重下降的程度还不足以启动骨重建机制,在术后 12 周时较术前仅下降了8. 09% 。我们在观察大鼠活体整体骨量和离体骨整体骨量变化的同时,对股骨和胫骨的 DXA 图像进行连续性分割,将其等分为 7 个区并分别测量各区的BMD、BMC、Area,而不是采用目前常用的单个选取兴趣区的方法进行观察。此分析方法是将各骨骼富含松质骨或皮质骨的成分相对划区,可以为pQCT、显微 CT 等试验筛选骨丢失敏感区域。在PRED 组中,无论是在以松质骨结构为主的股骨和胫骨的干骺端以及腰椎,还是在以皮质骨为主的全身骨骼及股骨干和胫骨干,都没有发现明显的骨丢失区域。在阳性对照 OVX 组,在以松质骨结构为主的第 5、6 腰椎,股骨远端和近端的干骺端以及胫骨近端干骺端 BMD、BMC 显着下降,这与以往研究相一致,而且我们进一步发现以皮质骨结构占优的全身骨骼 BMC 逐渐增加,在 12 周时与 SHAM 组比较出现显着性差异,但整体骨骼面积亦有增加的趋势,从而导致 BMD 无明显变化,这提示当组间体重增减不平衡时,BMC 或者 BMD 单独评价骨量的改变是不全面的。
本实验中,与 SHAM 组比较,OVX 组和 PRED组大鼠离体胫骨干及其中远端部分区域骨量显着增加,其具体机制还需要进一步研究。大鼠接受甲基强的松龙注射后,生物力学试验中最大载荷显着下降,弹性模量也有下降趋势,但是骨量并不能解释生物力学性能的改变,这提示糖皮质激素更多的是引起骨质量的改变而导致了力学性能的下降及骨折的发生,具体机制需要进一步研究。
综上所述,成熟期大鼠接受甲基强的松龙后,皮质骨和松质骨骨量没有显着变化,DXA 检查难以发现甲基强的松龙注射成熟期雌性大鼠的骨丢失情况,其力学性能下降,提示糖皮质激素更多的是引起骨质量的改变而导致了力学性能的下降及骨折的发生。
【 参 考 文 献 】
[1] Wu XP,Liao EY,LU ZY,et al. Evaluation of rat bone massmeasurement by dual-energy X-ray absorptiometry anddetermination of sensitive regions of bone loss in ovariectomizedrat. Chin J Endocrinol Metab,2000,16( 4) : 212-215.
[2] De Nijs RN. Glucocorticoid-induced osteoporosis: a review onpathophysiology and treatment options. Minerva Med,2008,99( 1) : 23-43.
[3] T van Brussel MS,Bultink IE,Lems WF. Prevention ofglucocorticoid-induced osteoporosis. Expert Opin Pharmacother,2009,10( 6) : 997-1005.
[4] Wang Y, Ohtsuka-Isoya M, Shao P, et al. Effects ofmethylprednisolone on bone formation and resorption in rats. Jpn JPharmacol,2002,90( 3) : 236-246.
[5] Lindgren JU,Merchant CR,De Luca HF. Effect of 1,25-dihydroxyvitamin D3 on osteopenia induced by prednisolone inadult rats. Calcify Tissue Int. ,1982,34( 3) : 253-257.
[6] Wimalawansa SJ, Simmons DJ. Prevention of corticosteroidinduced bone loss with alendronate. Proc Soc Exp Biol Med,1998,217( 2) : 162-167.
[7] Hulley P A,Conradie M M,Langeveldt C R,et al. Glucocorticoid-induced osteoporosis in the rat is prevented by the tyrosinephosphatase inhibitor, sodium orthovanadate. Bone,2002,31( 1) : 220-229.
[8] Ferretti JL,Gaffuri O,Capozza R,et al. Dexamethasone effectson mechanical, geometric and densitometric properties of ratfemur diaphyses as described by peripheral quantitativecomputerized tomography and bending tests. Bone,1995,16( 1) :119-124.
[9] McHugh NA,Vercesi HM,Egan RW,et al. In vivo rat assay:bone remodeling and steroid effects on juvenile bone by pQCTquantification in 7 days. Am J Physiol Endocrinol Metab,2003,284: E70-E5.
[10] Schakman O,Gilson H,Kalista S,et al. Mechanisms of muscleatrophy induced by glucocorticoids. Horm Res,2009,72 ( Suppl1) : 36-41.
[11] Peckett AJ, Wright DC, Riddell MC. The effects ofglucocorticoidson adipose tissue lipid metabolism. Metabolism,2011,60 ( 11) : 1500-1510.
[12] Martin R B. The importance of mechanical loading in bonebiology and medicine. J Musculoskelet Neuronal Interact,2007,7( 1) : 48-53.
[13] Ke HZ,Simmons HA,Pirie CM,et al. Droloxifene,a newestrogen antagonist / agonist,prevents bone loss in ovariectomizedrats. Endocrinology,1995,136( 4) : 2435-2441.
[14] Omi N,Ezawa I. The effect of ovariectomy on bone metabolismin rats. Bone,1995,17: 163-168.