纳米氧化镍(nickel oxide,Ni O) 是一种重要的功能材料,由于尺寸与形貌的独特性,其在涂饰、催化、电容电极、光吸收、气敏传感等工业领域广泛应用。同时,纳米Ni O也大量存在于工业生产过程和焊接烟雾中,经呼吸道吸入是其进入人体的主要方式,其吸入毒性已成为近期研究热点之一[1].研究发现,纳米Ni O的细胞毒性与伴随的氧化应激和硝化应激(nitrative stress) 有关[2].体外和体内实验研究显示,纳米Ni O可导致机体肺组织炎症反应[3],且与微米颗粒相比纳米颗粒毒性反应更强[4].目前纳米Ni O的肺毒性效应及机制尚不明确。本文旨在观察纳米Ni O对大鼠的亚慢性肺损伤并从硝化应激的角度初步探讨其可能机制。
1 材料与方法
1. 1材料
1. 1. 1实验动物 健康成年雄性Wistar大鼠40只,体重200 ~ 240 g,购自兰州大学实验动物中心,动物许可证号SCXK( 甘)2013-0002.
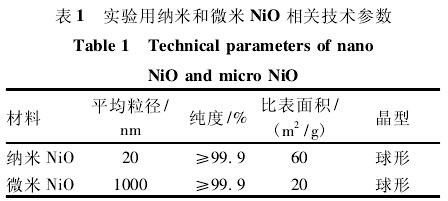
1. 1. 2仪器和试剂CP750超声波破碎仪( 美国Cole-Parmer仪器公司) ,BX53F双目生物显微镜( 日本Olympus公司) ,Eon全功能多波段酶标仪( 美国伯腾仪器有限公司)。总蛋白定量测定试剂盒(BCA法) 和一氧化氮(nitric oxide,NO)、总一氧化氮合酶(total nitric oxide synthase,TNOS)、诱 导 型 一 氧 化 氮 合 酶 (inducible nitric oxidesynthase,i NOS) 试剂盒 ( 南京建成生物工程研究所)。大鼠白细胞介素-2(interleukin-2,IL-2)、转化生 长 因 子-β(transforming growth factor-beta,TGF-β)、干扰素-γ(interferon-gamma,IFN-γ) 和8-羟基 脱 氧 鸟 苷 (8-hydroxy-2'-deoxyguanosine,8-OHd G)ELISA试剂盒( 上海晶天生物科技有限公司)。纳米、微米Ni O购自上海水田材料科技有限公司,相关表征参数见表1.
1. 2方法
1. 2. 1染毒样品的制备 纳米、微米Ni O颗粒和生理盐水溶液于120℃、30 min条件下灭菌后,分别配制成纳米Ni O 0. 015、0. 06、0. 24 mg /m L和微米Ni O 0. 24 mg /m L的混悬液,气管滴注前冰水浴中超声处理15 min,旋涡混合器机械振荡5 min.
1. 2. 2动物分组与染毒40只雄性Wistar大鼠染毒前适应环境5 d,随机分为5组: 生理盐水对照组,纳米Ni O 0. 015、0. 06、0. 24 mg /kg组和微米Ni O 0. 24 mg /kg组,每组8只。大鼠乙醚麻醉后行非暴露式气管滴注,按1 m L/kg染毒,每周2次,连续6周。大鼠染毒结束后乙醚麻醉,心脏采血后处死,收集肺组织,- 80℃低温冻存备用。
1. 2. 3肺组织病理学检测 大鼠处死后,解剖摘取右肺后叶,4%多聚甲醛固定,常规制备病理切片,HE染色后光镜下观察大鼠肺组织病理学变化。
1. 2. 4肺组织匀浆制备与硝化应激指标检测取低温冻存的大鼠左肺,称重,按照1∶ 9(m/V) 的比例加入冰冷的生理盐水,用玻璃匀浆器在冰水浴(0 ~ 4℃) 中制成10%肺组织匀浆,4℃、3000 r/min离心10 min,取上清液备用。严格按照试剂盒操作说明,于酶标仪562 nm波长处测定肺组织匀浆中蛋白含量,550 nm波长处检测NO含量,530 nm波长处测定TNOS和i NOS的活性。
1. 2. 5血样采集与指标检测 大鼠乙醚麻醉后心脏采血,血样置冰箱冷藏15 min后于4℃、1000r / min离心10 min,取血清备用。严格按照ELISA试剂盒操作说明,于酶标仪450 nm波长处测定大鼠血清中IL-2、TGF-β、IFN-γ及8-OHd G的含量。
1. 3统计学分析
数据用x珋± s表示,采用SPSS 20. 0统计软件对其进行单因素方差分析,并行组间比较。检验水准为0. 05,P < 0. 05为差异具有统计学意义。
2 结果
2. 1肺组织HE染色观察结果
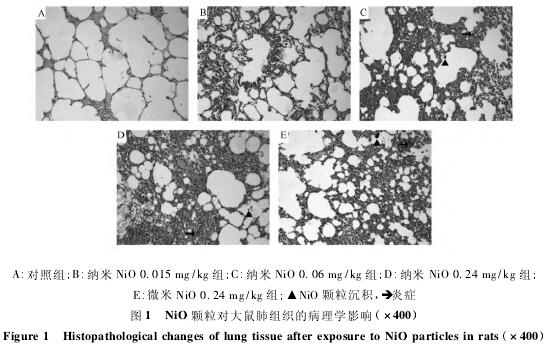
如图1所示,对照组肺泡扩张良好,肺泡腔及肺泡间隔内未见沉积物,未发现明显病理改变。大鼠气管滴注纳米Ni O后,可见肺组织出现不同程度的炎性细胞浸润、肺泡间隔增宽和颗粒物沉积现象,主要以0. 06和0. 24 mg /kg纳米Ni O组为主,且相同剂量的纳米Ni O组上述变化较微米Ni O组严重。
2. 2纳米Ni O染毒后肺组织硝化应激指标的变化
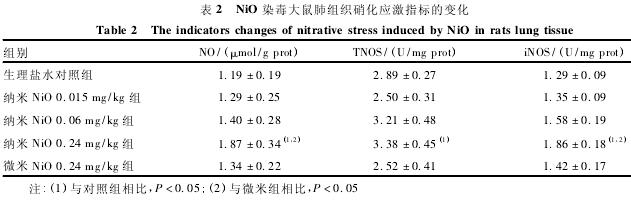
如表2所示,纳米Ni O 0. 24 mg /kg组NO含量、TNOS和i NOS活性均升高,与对照组比较差异均具有统计学意义(P < 0. 05)。与微米组相比,纳米Ni O 0. 24 mg /kg组NO含量和i NOS活性也升高,差异亦具有统计学意义(P < 0. 05)。
2. 3纳米Ni O对大鼠血清部分细胞因子和8-OHd G含量的影响
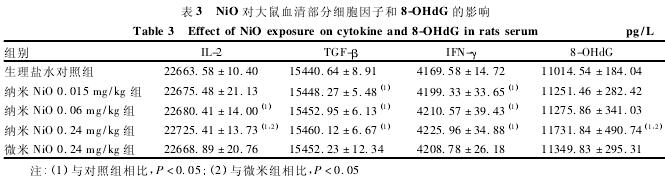
如表3所示,与对照组相比,纳米Ni O 0. 06和0. 24 mg /kg组血清IL-2含量升高,纳米Ni O各剂量组血清TGF-β和IFN-γ含量均升高,纳米Ni O 0. 24 mg / kg组血清8-OHd G含量升高,差异均具有统计学意义(P < 0. 05)。与微米组比较,纳米Ni O 0. 24 mg /kg组血清IL-2和8-OHd G含量升高,差异具有统计学意义(P < 0. 05)。
3 讨论
纳米材料职业人群主要以男性职工为主,因此本研究选择雄性Wistar大鼠为研究对象。参考MIZUGUCHI课题组的纳米Ni O染毒剂量[4],本研究通过气管滴注方式构建纳米Ni O肺损伤模型。纳米物质的毒性大小与其理化特性密切相关。CHO等[5]分别给大鼠气管滴注等比表面积剂量的不同纳米颗粒,结果发现其中4种( 纳米Ce O2、纳米Ni O、纳米Zn O、纳米Cu O) 可明显引起大鼠肺部炎症且不同纳米材料所致炎症在时长、炎性细胞和介质种类及细胞毒性等方面均有不同的表现。本研究组织病理学结果显示,相比对照组,纳米Ni O各剂量组均出现不同程度的病理改变,剂量越高,损伤越严重,尤其以纳米Ni O 0. 24mg / kg组为重。同时发现相同染毒剂量下,纳米Ni O比微米Ni O引起的组织损伤更严重,这也与OGAMI等[6]的研究结果一致,说明组织损伤的程度与颗粒粒径有关。
氧化应激与硝化应激常伴随发生,参与多种疾病的发生发展过程[7].硝化应激与一氧化氮合酶(nitric oxide synthase,NOS) 的异常表达有密切联系。i NOS在生理状态下表达很少,主要在炎症刺激下诱导合成,为钙离子非依赖型NOS[8].在肺组织中i NOS可在多种细胞中诱导表达,包括活化的巨噬细胞和肺泡上皮细胞等[9].体内过量NO生成可致组织损伤,一方面其本身具有细胞毒性和促炎作用,另一方面NO与O2-迅速反应生成的ONOO-可进一步造成病理损伤[10].本文结果发现纳米Ni O 0. 24 mg /kg组肺组织匀浆中TNOS和i NOS的活力均高于对照组,其中i NOS活力与微米组相比也升高,提示纳米Ni O经气道到达肺部后,引起肺部炎症,激活肺泡巨噬细胞,诱导其合成i NOS,继而产生大量NO,引起硝化应激反应,从而导致肺组织损伤。研究表明,NO还参与肺纤维化的形成过程,抑制NO的生成可以减轻肺纤维化的程度[11].TGF-β作为致纤维化的关键因子,在肺纤维化过程中有重要作用[12].本文结果发现纳米Ni O染毒大鼠血清TGF-β水平升高,提示纳米Ni O可能引起大鼠肺组织一定程度的纤维化,这可能与NO生成增多有关,但尚需进一步研究证实。
纳米颗粒因其尺寸极小,可能躲避巨噬细胞的吞噬作用而与血清蛋白结合成为半抗原,引起一系列免疫级联反应,并可能导致组织损伤[13].CHANG等[14]对纳米二氧化钛(titanium dioxide,Ti O2) 的肺毒性研究表明,肺脏对纳米Ti O2的刺激先表现为非特异性免疫反应,随后转变为持久的特异性免疫反应。IL-2是体内重要的免疫调控因子,主要由CD4+和CD8+T细胞在抗原刺激下以旁分泌或自分泌的形式释放,能促进Th1细胞分泌IFN-γ[15].本文结果显示,纳米Ni O 0. 06和0. 24 mg / kg组大鼠血清中IL-2含量高于对照组,可能是机体对外来纳米Ni O颗粒做出的免疫应答反应,从而活化免疫细胞而间接引起肺组织损伤。纳米Ni O染毒大鼠血清IFN-γ含量增多,这可能与IL-2合成增多有关。IFN-γ作为i NOS的诱导剂,能诱导巨噬细胞合成i NOS,故IFN-γ水平升高进一步促进NO的产生而加重硝化应激反应。
氧化应 激时机体 产生 大 量 活 性 氧 自 由 基(reactive oxygen species,ROS) ,攻击DNA分子中的鸟嘌呤碱基生成8-OHd G,故8-OHd G是DNA氧化损伤的重要标志物[16].本研究结果显示,纳米Ni O染毒大鼠血清8-OHd G含量与对照组和微米组相比均明显升高,说明纳米Ni O可能通过诱导机体ROS的产生从而造成DNA氧化损伤。
综上所述,气管滴注一定浓度的纳米Ni O可引起大鼠肺损伤,可能与其诱导肺组织i NOS和NO水平升高有关,其机制还有待于进一步探索。
参考文献
[1]PIETRUSKA J R,LIU X,SMITH A,et al.Bioavailability,intracellular mobilization of nickel,and HIF-1alpha activation in human lung epithelialcells exposed to metallic nickel and nickel oxidenanoparticles[J]. Toxicol Sci,2011,124(1) :138-148.
[2]HORIE M,FUKUI H,ENDOH S,et al. Comparisonof acute oxidative stress on rat lung induced by nanoand fine-scale,soluble and insoluble metal oxideparticles:Ni O and Ti O2[J]. Inhal Toxicol,2012,24(7) :391-400.
[3]MIZUGUCHI Y,MYOJO T,OYABU T,et al.Comparison of dose-response relations between 4-week inhalation and intratracheal instillation of Ni Onanoparticles using polimorphonuclear neutrophils inbronchoalveolar lavage fluid as a biomarker ofpulmonary inflammation[J]. Inhal Toxicol,2013,25(1) :29-36.
[4]HORIE M,NISHIO K,FUJITA K,et al. UltrafineNi O particles induce cytotoxicity in vitro by cellularuptake and subsequent Ni(II)release[J]. ChemRes Toxicol,2009,22(8) :1415-1426.
[5]CHO W S,DUFFIN R,POLAND C A,et al. Metaloxide nanoparticles induce unique inflammatoryfootprints in the lung:important implications fornanoparticle testing[J]. Environ Health Perspect,2010,118(12) :1699-1706.
[6]OGAMI A,MORIMOTO Y,MYOJO T,et al.Pathological features of different sizes of nickel oxidefollowing intratracheal instillation in rats[J]. InhalToxicol,2009,21(10) :812-818.
[7] 黄继云,韩峰。硝化应激参与介导缺血性脑损伤的研究进展[J].神经药理学报,2011(5) :56-64.
[8]BOGDAN C. Nitric oxide synthase in innate andadaptive immunity:an update[J]. Trends Immunol,2015,36(3) :161-178.
[9]ROBINSON M A,BAUMGARDNER J E,OTTO CM. Oxygen-dependent regulation of nitric oxideproduction by inducible nitric oxide synthase[J].Free Radic Biol Med,2011,51(11) :1952-1965.
[10] 董文倩,张铭湘。内源性代谢分子---精氨酸/一氧化氮调节机体生理功能[J].生理科学进展,2012(5) :334-337.
[11]GUZEL A,KAYHAN S,TUTUNCU S,et al.Attenuation of bleomycin induced lung fibrosis byerdosteine and inhibition of the inducible nitric oxidesynthase[J]. Bratislava Med J,2015,116(3) :196-202.
[12]FERNANDEZ I E,EICKELBERG O. The impact ofTGF-beta on lung fibrosis:from targeting tobiomarkers[J]. Proc Am Thorac Soc,2012,9(3) :111-116.
[13]DWIVEDI P D,TRIPATHI A,ANSARI K M,et al.Impact of nanoparticles on the immune system[J]. JBiomed Nanotechnol,2011,7(1) :193-194.
[14]CHANG X,FU Y,ZHANG Y,et al. Effects of Th1and Th2 cells balance in pulmonary injury induced bynano titanium dioxide[J]. Environ ToxicolPharmacol,2014,37(1) :275-283.
[15]BOYMAN O,SPRENT J. The role of interleukin-2during homeostasis and activation of the immunesystem[J]. Nat Rev Immunol,2012,12(3) :180-190.
[16]SHAH D,MAHAJAN N,SAH S,et al. Oxidativestress and its biomarkers in systemic lupuserythematosus[J]. J Biomed Sci,2014,21(23) :doi:10. 1186 /1423-0127-1121-1123.