
胚胎干细胞( embryonic stem cells,ES 细胞) 具有无限增殖和多向分化的特性,在体外可分化为 3个胚层的所有细胞[1],定向诱导人 ES 细胞分化为造血干/祖细胞,可以为造血干细胞移植提供新的细胞来源.目前诱导人 ES 细胞向造血细胞分化多采用 ES 细胞与基质细胞共培养以及拟胚体的方法[2,3],但是这两种方法分化效率均比较低,而且存在动物源性污染,离临床应用距离甚远.本研究采用人 ES 细胞在胞外基质上直接贴壁培养向造血细胞诱导,既没有拟胚体复杂的三维立体结构,又不受基质细胞的影响,从而排除异源性污染,旨在建立人ES 细胞分化为造血祖细胞的简单高效的诱导体系,并探讨不同的胞外基质对其分化的影响.
材料和方法
主要材料和试剂
人胚胎干细胞系 PKU1. 1 由北京大学第三医院生殖中心陈贵安教授馈赠,为 PKU1 连续传代 30 代后建立的单细胞克隆亚系,染色体核型为 46,XX[4].KnockOutTMDMEM 培养液、KnockOutTM血清替代品( SR) 和 IMDM 培养液以及胞外基质 Fibronectin和 Collagen IV 均为美国 Gibco /Invitrogen 公司产品; Matrigel 为美国 Becton Dickson 公司产品; 细胞因子均为美国 PeproTech 公司产品; HIT( 人血清白蛋白 + 重组人胰岛素 + 人转铁蛋白) 和甲基纤维素培养液 MethoCult 4435+为加拿大 Stem Cell Tech-nology 公 司 产 品; 流 式 抗 体 均 为 美 国 BectonDickson Pharmingen 公司产品; Mini RNA 提取试剂盒为德国 Qiagen 公司产品; SYBR Green Super Mix为美国 Bio-Rad 公司产品; 引物合成由北京奥科公司完成.
胞外基质预处理培养板
设立 3 组: 分别将 Matrigel、Fibronectin 和 CollagenIV 置于 4℃ 融化,以预冷的 IMDM 按 1 ∶ 20 比例稀释.各取 2 ml 均匀铺于 6 孔培养板,37℃孵育 2 h,吸出后以 IMDM 清洗 1 遍,待用.
人 ES 细胞直接贴壁培养分步向造血干/祖细胞诱导第 1 步将生长 5 -6 d 后的人 ES 细胞经 Dispase 酶消化后,以基础分化培养液( IMDM + HIT + MTG +谷氨酰胺 + 非必需氨基酸) 重悬,按 2 ×104细胞数/cm2的密度接种至胞外基质预先包被过的 6 孔培养板中贴壁培养,培养液中同时添加细胞因子骨形态发生蛋白( BMP4,25 ng /ml) 、血管内皮生长因子( VEGF,20 ng /ml) 和碱性成纤维生长因子( bFGF,10 ng / ml) 诱导 7 d; 第 2 步更换细胞因子为干细胞因子( SCF,50 ng /ml) 、芙莱基 3 配体( Flt 3L,50ng / ml) 、白介素 3 ( IL-3,10 ng / ml) 和白介素 6 ( IL-6,10 ng / ml) 继续诱导分化 7 d,共诱导 14 d.每 3 d更换新鲜的培养基和细胞因子.在倒置相差显微镜下观察分化细胞的形态.将人 ES 细胞在未经胞外基质包被的培养板上培养且不添加细胞因子设为对照组.
造血集落形成试验( CFU)
收集培养液中诱导 14 d 的细胞,用 PBS 清洗 2 遍,用40 μm 无菌细胞筛过滤除去大的细胞团块 ,将分化细胞按 1 × 105细胞数/ml 接种于半固体甲基纤维素培养基 MethoCult 4435+中培养,14 d 后在显微镜下观察形成的细胞集落数目( CFC) .
流式细胞术分析( FCM)
收集培养液中诱导 14 d 的细胞,40 μm 无菌细胞筛过滤除去大的细胞团块 ,将细胞密度调整为 5 ×105细胞数/毫升,用 PBS 清洗 3 遍,分别加入小鼠抗人CD34-APC、小鼠抗人 CD31-PE 和小鼠抗人 CD45-PE,同型对照为小鼠 IgG1-APC 和 IgG1-PE,4℃ 避光孵育 30 min.碘化丙啶( PI) 除去死细胞.上机分析分化细胞中各表面标志物阳性细胞的比例.
实时定量 PCR 检测
分别提取人 ES 细胞以及诱导 3、7 和 14 d 分化细胞的总 RNA,反转录后采用 SYBR Green 法进行实时定量 PCR 检测造血特异性基因的表达.反应总体系为 10 μl,反应条件为 95℃ 预变性 5 min; 然后95℃ 变性 10 s,退火 30 s,共 40 个循环.各基因引物序列及退火温度( Tm) 见表1.采用2- ΔΔCt法进行数据处理.
统计学分析实验数据以均数 ± 标准差(珔X ± SD) 表示,应用 SPSS17. 0 统计软件分析,两组之间进行 t 检验,3 组以上进行单因素方差分析( ANOVA) .P < 0. 05 为差异有统计学意义.
结 果
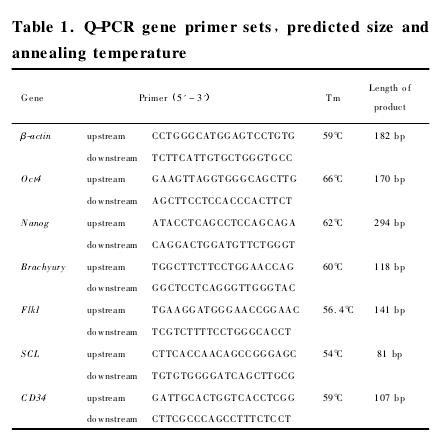
人 ES 细胞和分化细胞形态学观察人 ES 细胞在无饲养层细胞的培养体系里呈巢状集落样生长,扁平状,细胞之间界限清楚,细胞胞核大,胞质 少,核 质 比 高 ( 图 1A ) .当 人 ES 细 胞 在matrigel、纤维粘连蛋白和 IV 型胶原蛋白这 3 种胞外基质分别包被过的培养板里培养,添加造血生长因子开始诱导分化,3 组分化细胞镜下形态相似.
随着诱导天数增加,人 ES 细胞边界逐渐消失,分化出的细胞向四周扩散( 图 1B) ,分化至 10 d 细胞表面开始出现许多囊腔结构( 图 1C) ,里面充满着圆形细胞( 图 1D) ,随着诱导时间的延长,这些圆形细胞有的会从囊腔结构中跑出来,漂浮在液体里,直至诱导 14 d 时分化细胞的表面布满了圆形细胞( 图1E,F) .在整个分化过程中,在对照组未出现囊腔结构以及圆形的细胞.
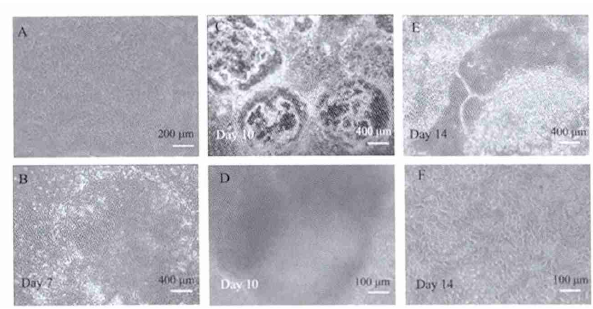
分化细胞的鉴定造血细胞集落形成 培养 2 周后各实验组显微镜下均可观察到红细胞系、粒细胞系和混合细胞集落等各系细胞集落( CFC) 的形成( 图 2B) ,3 组细胞数分别为( 10 ± 1. 5) × 105、( 16 ± 3. 5) × 105及( 51 ±6. 1) × 105,Collagen IV 包被组形成 CFC 数目明显多于 Matrigal 和 Fibronectin 组,具有统计学差异( P< 0. 01 ) ,其中形成 CFU-E 和 CFU-G 数目高于Matrigel 以及 Fibronectin 组( P < 0. 05) ,形成 CFU-GEMM 数 3 组间未见显著差异 ( P > 0. 05 ) ( 图2A) .对照组未见有造血集落的形成.
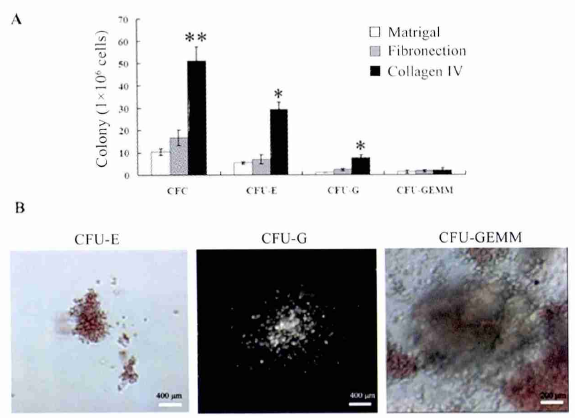
特异性标志物的表达 流式细胞术分析诱导 14 d的分化细胞,结果显示,Matrigel、Fibronectin 以及Collagen IV 组 CD34 阳性细胞数分别达到( 7. 18 ±0. 32) % 、( 9. 59 ± 0. 4 ) % 、( 14. 42 ± 0. 69 ) % ,Collagen IV 组高于前 2 组 ( P < 0. 05 ) ; 3 个组中CD45 阳性细胞数分别达到 ( 0. 04 ± 0. 005 ) % 、( 0. 05 ± 0. 01) %、( 1. 49 ± 0. 08) %,Collagen IV 组高于前 2 组( P <0. 05) ; 3 个组中 CD34 和 CD45 双阳性的细胞比例分别为( 0. 08 ±0. 006) %、( 1. 16 ±0. 12) % 、( 7. 8 ± 0. 32) % ,Collagen IV 组显著高于前 2 组( P <0. 05) ; 而 3 组中 CD31 阳性以及 CD34和 CD31 双阳的细胞数占有的比例无显著的差异( 图 3) .在对照组细胞未检测到 CD34、CD31 和CD45 的阳性表达.
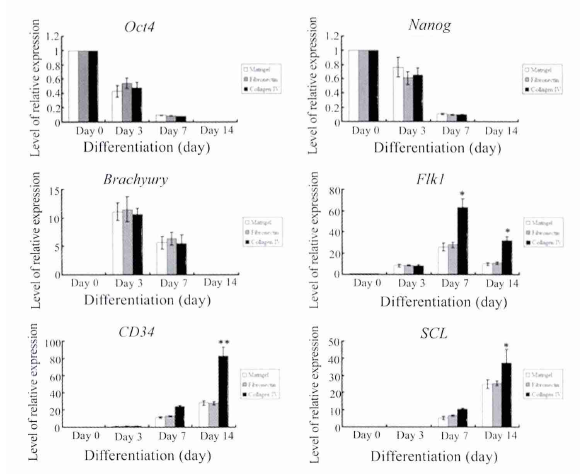
实时定量 PCR 分析造血细胞特异性基因的表达从图 4 可以看出,随着诱导分化启动,ES 细胞多能性标志物 Oct4 和 Nanog 在各组细胞中的表达迅速下降 至 消 失 ( 图 4A,4B ) ,而 中 胚 层 标 志 物Brachyury、血液成血管细胞标志物 Flk1 以及造血系统特异性基因 CD34 和转录因子 SCL 在人 ES 细胞中( 即分化第 0 d) 几乎不表达,分化第 3 d 时Brachyury 的表达量达到最高值,后逐渐下降直至消失,3 组之间未见显著差异( 图 4C) ; 3 组 Flk1 的表达在分化第 7 d 达高峰,3 组 Flk1 相对表达量分别为 25. 74 ± 3. 65,27. 83 ± 2. 41 和 63. 03 ± 7. 99,且Matrigel 和 Fibronectin 组显著低于 Collagen IV 组( P <0. 05) ,此后 Flk1 的表达开始下调( 图 4D) ; 随着诱导天数的增加,CD34 和 SCL 表达均呈上调趋势,分化第 14 d 时 Collagen IV 组的相对表达量分别为 82. 63 ± 10. 01 和 37. 5 ± 7. 57,明 显 高 于Matrigel 和 Fibronectin 组,差异具有显著的统计学意义( P <0. 01 和 P <0. 05) ( 图 4E,4F) .在对照组细胞未检测到特定基因的表达.
讨 论
定向诱导分化是人 ES 细胞研究的重要内容,将人ES 细胞诱导为造血细胞常采用传统的基质细胞共培养和拟胚体诱导法,但是这些方法繁琐,重复性查,获得的细胞数量有限,而且分化体系中添加了成分不确定的胎牛血清,致使难以研究分化机制,也限制了其临床应用.本实验采用人 ES 细胞直接贴壁分化的诱导策略既没有拟胚体复杂的三维结构,也不存在基质细胞或胎牛血清的动物源性污染,缩短与临床应用的距离,同样可以有效地产生造血祖细胞,这一方法成功的关键是胞外基质的选择.研究表明,细胞微环境对维持人 ES 细胞自我更新以及细胞命运的决定极其重要,其中胞外基质是重要组成部分[5].胞外基质不但为细胞提供生长分化的支架,也提供维持细胞存活、迁移和命运决定的调控因子.胞外基质通常是大分子糖蛋白,包括基质胶( matrigel) 、纤维黏连蛋白( fibrobectin) 、胶原蛋白( collagen) 、层黏连蛋白( laminnin) 和蛋白多糖等.
本实验采用人 ES 细胞接种至基质胶、纤维粘连蛋白和 IV 型胶原蛋白这 3 种胞外基质包被过的培养板上直接贴壁分化的诱导方法,产生的 CD34+造血祖细胞最高达到15. 06%,表达 CD45 的造血祖细胞可达 7. 8%,与传统的基质细胞共培养和拟胚体法的分化效率相似,但是这一诱导方法简单易操作,而且无血清、无基质细胞的培养体系更接近于未来的临床应用.
造血过程中多种生长因子发挥着重要作用,外源性添加生长因子在一定程度上能模拟体内的造血微环境,促进造血发生.国外文献报道,人 ES 细胞向造血细胞分化过程中需全程添加细胞因子,包括BMP4、bFGF、VEGF、SCF、Flt3L、IL-3 和 IL-6等[6,7].既往研究表明,人 ES 细胞向造血细胞分化过程中,只有 BMP4 能诱导产生对中胚层造血细胞发育必需的原条样细胞群,启动造血中胚层基因表达和少量造血祖细胞的产生; BMP4、VEGF、SCF 和bFGF 共同作用则诱导出高效的造血细胞[8].近年有研究证实,在人 ES 细胞向造血系分化过程中序贯加入不同的细胞因子更能有效地产生造血祖细胞[9].本研究整个分化过程中细胞因子分两步添加,第 1 步加入 BMP4、VEGF 和 bFGF,第 2 步加入SCF、Flt3L、IL-3 和 IL-6,诱导 14 d 后对分化细胞进行鉴定,造血集落形成、流式细胞分析术以及实时定量 PCR 结果均证实人 ES 细胞有效地分化为造血祖细胞.本研究中外源性造血生长因子的添加诱导人ES 细胞开始分化,实时定量 PCR 结果显示所有实验组分化细胞中干细胞多能性标志物 Oct4 和Nanog 表达呈急剧下降的趋势,尽管分化早期诱导效率很低,但是中胚层标志物 Brachyury、血液成血管细胞标志物 Flk1 以及造血系统特异性转录因子SCL 和基因 CD34 的相对表达量对于内参基因 β-actin 仍呈成倍增长,这是 ES 细胞一旦启动分化,未分化状态和多能性特性迅速丧失的结果[10].
本研究还比较了基质胶、纤维黏连蛋白和 IV 型胶原蛋白对产生造血细胞的不同作用.基质胶多用于人 ES 细胞无饲养层培养的培养皿处理[11],也可用于人 ES 细胞的贴壁诱导向造血细胞的分化[12].
纤维黏连蛋白和 IV 型胶原蛋白支持小鼠 ES 细胞来源的表达 Flk1 的祖细胞向造血细胞分化[13].纤维黏连蛋白能促进中胚层分化,诱导人 ES 细胞来源的内皮祖细胞向内皮细胞分化[14].IV 型胶原蛋白也能促进中胚层发育,诱导人 ES 细胞向内皮、心血管和造血系的分化[15],但具体的分化效率并未报道.本研究中造血集落形成实验显示这 3 种胞外基质上培养诱导的细胞均具有造血干/组细胞的造血集落形成能力,而且 IV 型胶原蛋白上形成的造血CFC 数目明显高于其它两组.流式细胞术分析显示 IV 型胶原蛋白组 CD34+和 CD34+CD45+细胞数量显著大于基质胶组和纤维黏连蛋白组; 实时定量PCR 结果显示 IV 型胶原蛋白组造血特异性基因CD34 和 SCL 的相对表达量最高.由此证实,采用人 ES 细胞直接贴壁的诱导方法选择 IV 型胶原蛋白更利于向造血细胞分化.
本研究建立了一种人胚胎干细胞在胞外基质上直接贴壁培养、有效地分化为造血祖细胞的新诱导方法,为造血祖细胞的大量产生以及进一步分化产生其它功能性血细胞提供足够的细胞来源,同时发现 IV 型胶原蛋白利于人胚胎干细胞向造血细胞诱导,为胚胎干细胞的定向诱导分化提供技术平台.
参 考 文 献:
1 Thomson JA,Itskovitz-Eldor J,Shapiro SS,et al. Embryonicstem cell lines derived from human blastocysts. Science,1998; 282( 5391) : 1145 -1147.
2 Kaufman DS,Hanson ET,Lewis RL,et al. Hematopoietic colony-forming cells derived from human embryonic stem cells. Proc NatlAcad Sci USA,2001; 98( 19) : 10716 - 10721.
3 Chadwick K,Wang L,Li L,et al. Cytokines and BMP-4 promotehematopoietic differentiation of human embryonic stem cells.Blood,2003; 102( 3) : 906 - 915.
4 Peng H,Chen G. Serum-free medium cultivation to improveefficacy in establishment of human embryonic stem cell lines. HumReprod,2006; 21( 1) : 217 - 222.
5 Tanentzapf G,Devenport D,Godt D,et al. Integrin-dependentanchoring of a stem-cell niche. Nat Cell Biol,2007; 9 ( 12) : 1413- 1418.
6 Cerdan C,Rouleau A,Bhatia M . VEGF-A165 augments erythro-poietic development from human embryonic stem cells. Blood,2004; 103( 7) : 2504 - 2512.
7 Zhan X,Dravid G,Ye Z,et al. Functional antigen-presentingleucocytes derived from human embryonic stem cells in vitro.Lancet,2004; 364( 9429) : 163 - 171.
8 Pick M ,Azzola L,Mossman A,et al. Differentiation of humanembryonic stem cells in serum-free medium reveals distinct roles forbone morphogenetic protein 4,vascular endothelial growth factor,stem cell factor,and fibroblast growth factor 2 in hematopoiesis.Stem Cells,2007; 25( 9) : 2206 - 2214.
9 Wang C,Tang X,Sun X,et al. TGFβ inhibition enhances thegeneration of hematopoietic progenitors from human ES cell-derivedhemogenic endothelial cells using a stepwise strategy. Cell Res,2012; 22( 1) : 194 - 207.
10 Kim J,Chu J,Shen X,et al. An extended transcriptional network forpluripotency of embryonic stem cells. Cell,2008; 132 ( 6) : 1049 -1061.
11 Chaturvedi G, Simone PD, Ain R, et al. Noggin maintainspluripotency of human embryonic stem cells grown on Matrigel.
Cell Prolif,2009; 42( 4) : 425 - 433.
12 Niwa A,Heike T,Umeda K,et al. A novel serum-free monolayerculture for orderly hematopoietic differentiation of human pluri-potent cells via mesodermal progenitors. PloS ONE,2011; 6 ( 7) :
e22261.
13 Hirashima M ,Kataoka H,Nishikawa S, et al. Maturation ofembryonic stem cells into endothelial cells in an in vitro model ofvasculogenesis. Blood,1999; 93( 4) : 1253 - 1263.
14 George EL,Georges-Labouesse EN,Patel-King RS,et al. Defectsin mesoderm, neural tube and vascular development in mouseembryos lacking fibronectin. Development,1993; 119( 4) : 1079 -1091.
15 Gerecht-Nir S,Ziskind A,Cohen S,et al. Human embryonic stemcells as an in vitro model for human vascular development and theinduction of vascular differentiation. Lab Invest,2003; 83 ( 12 ) :1811 - 1820.
真核细胞的基因表达是高度复杂的过程,是遗传调控和表观遗传调控协同作用的结果.遗传调控以基因决定论为核心内容,表观遗传学则主要研究DNA序列以外的调控机制.已有研究结果证实,基因行为可通过表观遗传的行为进行调控(Reik,2007),并可遗传给...