一、引言
脆性X染色体综合症(fragile X syndr.me FXS)是引起先大性智力低卜及自闭症的一种常见遗传病.该疾病通过遗传和非遗传因素影响世界1%^'3%的人口,男性发病率为1 /4000,女性发病率为1/8000z. FXS小孩患者认知和行为发生缺陷,包括注意力不集中、癫痈、社会回避、多动和行为刻板等,这些症状在发育的不同时期表现出来,并且大部分持续整个成年期[3--5].例如,Fxs患者认知障碍在幼年期较为明显,而在两、三岁时表现出社会焦虑,不愿与人交流,癫痈出现在整个儿童期,然而往往在成年期前过度发作网.
1991年,人们发现Fxs患者的X染色体长臂的27.3位置上,加r1基因的5'非翻译区有一段CGG重复序列fl.正常情况卜该重复序列少于55个重复fHl但该重复序列在母系遗传过程中不稳定,一般在卜一代重复次数会增加,当重复次数在55 - 200之间时则被称为是突变基因携带者l9];而如果CGG重复次数超过200甚至多于1000时,则发生完全突变,此时,加r1基因启动子区中CGG重复与相邻的CpG岛高度甲基化.高度甲基化会引起fmrl基因沉默,从而导致脆性X精神迟滞蛋白(fragile X mental retardati.n pr.teinFMRP)的表达减少,进而导致智力低卜等相关疾病.FMRP为多核糖体相关的RNA结合蛋白,通过使目标mRNA的核糖体延宕而抑制核糖体翻译.FMRP广泛分布于兴奋性突触部位,通过调节树突部位特异性mRNA编码蛋白质的合成,在突触可塑性方而发挥重要作用.突触相关的蛋白质合成失调是认知和行为缺陷的基木原因.研究表明,大部分携带完全突变基因的男性为有认知障碍的FXS患者,而只有25%的女性加r1完全突变基因携带者的IQ G 70,因为女性可能有另一正常的X染色体能够表达FMRP .但是,大多数的女性FXS患者都伴随有学习和社交障碍.
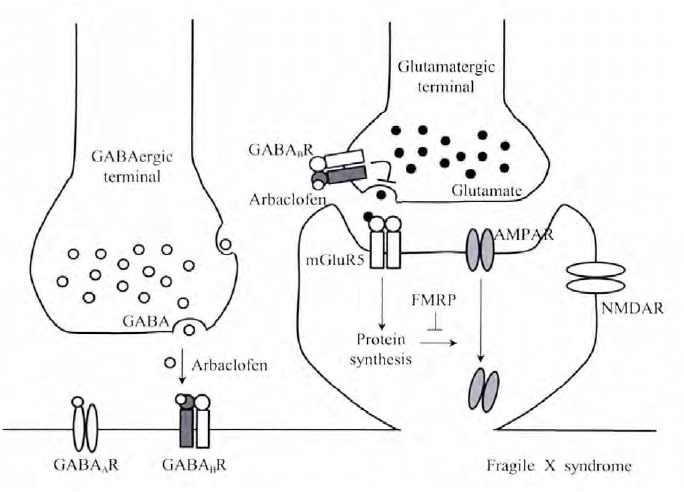
研究发现,mG1uRs及其介导的卜游信号通路与FXS密切相关,长期以来是临床和基础研究的热点.mG1uR假说认为:FMRP可以调节I型mG1uRs (mG1uR1和mG1uR5)介导的蛋白质合成.当缺乏FMRP时,mG1uR依赖的蛋白质合成发生异常,并出现FXS相关的很多表型[11],例如,激活I型mG1uRs可以诱导.一氨基一3-轻基一5一甲基异恶噢-4一丙酸受体(a-amin.-3-hydr.xy-5-methyl-4-is.xaz.le-pr.pi.nic acid recept.r AMPAR)内吞,从而影响神经元突触可塑性[12,13].这表明FMRP能够抑制AMPAR内吞,在缺乏FMRP时,介导AMPAR内吞的相关蛋白质过度合成,从而减少了细胞膜上的AMPAR. mG1uR假说已经在动物模型上得到验证.例如,加r1缺失型小鼠表现出多种FXS相关症状,包括听原性癫痈发作、树突棘密度发生改变、AMPAR运输增强、 蛋白质过度合成等.而这些表型都能够通过抑制mG1uR5卜游信号而恢复,因此,I型mG1uR被认为是FXS最重要的靶点.此外,近年来研究发现,GABA受体也与FXS密切相关,如加r1缺失小鼠表现出GABA介导的抑制性神经传递缺陷,GABA.受体激动剂与 mG1uR5负向变构剂表现出相同的效应,这表明FXS患者中兴奋性和抑制性神经传递平衡被打破,因此,重新建立这种平衡将对FXS治疗具有重要指导意义(图1).木文将对GABA受体在脆性X综合征中的作用机制进行综述.
二、GABA受体结构与生理功能.
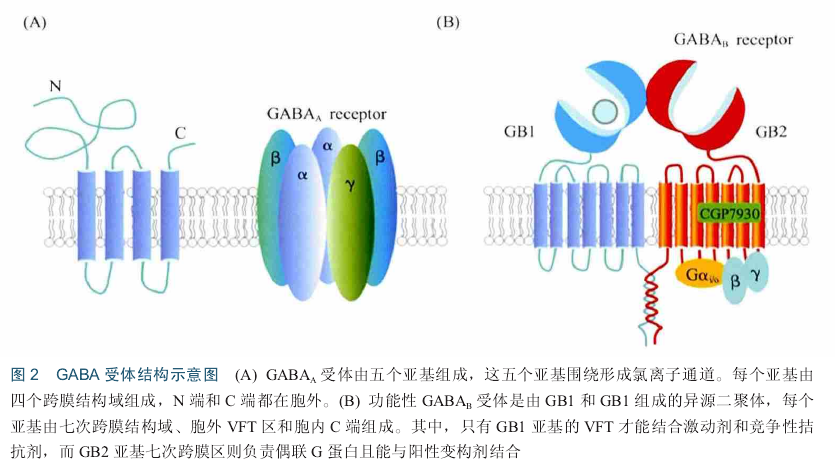
GABA是哺乳动物中枢神经系统中广泛分布的一种抑制性神经递质,对焦虑、抑郁、癫痈、失眠和学习记忆有重要作用 .GABA受体主要包括两类:离子通道型GABA,受体和代谢型GABA.受体.GABA、受体是第一个被发现的GABA受体,与配体结合后通过诱导通道开放促进C1离子内流,介导快速的突触抑制,而GABA.受体为G蛋白偶联受体(G-pr.tein-c.upled recept.r, GPCR),激活后介导缓慢而长时的突触抑制[IS] GABA、受体是由五个亚基组成的跨膜受体,五个亚基围绕形成离子通道.每个亚基包含四个跨膜域,N端和C端都位于胞外(图2) . GABA、受体亚单位数目众多,目前已知至少有18种不同的受体亚单位,根据氨基酸序列的同源性分为七个亚类:a(1^-6), b(1^-3),袱1^-3), 8 s(1^-3), 8和rr . GABA、受体亚单位种类虽多,但并不是所有的亚单位都能组合成大然的GABA、受体.大多数GABA、受体由两个.亚基、两个p亚基和一个y亚基(或一个s亚基)组成!n. n.亚单位对GABA、受体复合物的组装及功能可能起主要作用.
不同亚基在整个大脑的表达和分布不同,因而组成的GABA、受体的生理和药理性能不同,例如,由.1, a2, a3或.5及p和y组成的GABA、受体是苯二氮卓类敏感的,主要分布在大脑突触位置并介导相位性抑制.相反,由.4或.6亚基及p和y亚基组成的GABAA受体主要定位于突触外区域并介导紧张性抑制,该类型受体对苯二氮卓类不敏感.当GABA与细胞膜上的GABA、受体结合时,受体发生构象变化,通道孔打开,C1一可顺着电势和浓度梯度通过离子通道.由于大多数神经元上的C1一的翻转电位在细胞膜静息电位附近,或略低于静息电位,GABA、受体的激活可以使静息电位更加稳定,甚至使细胞超极化,以至于弱化了兴奋性神经递质的去极化效果和产生动作电位的可能.因此,该受体主要发挥抑制性作用,减少神经元的活动.由于GABA、受体是离子型受体,开放速度快,因此,在抑制突触后电位的过程中属于早期效应.
GABA.受体为C家族G蛋白偶联受体,功能性GABA.受体是由GABABRI (GB1)和GABABR2 (GB2)亚基组成的异源二聚体,每个亚基由胞外结构域(也称捕蝇夹结构域,venus flytrap d.main VFT)、七次跨膜区和胞内结构域组成9. GB1亚基的VFT区为配体结合区,GB2亚基虽然也有VFT区,但是并不能结合配体,但可以增强GB 1与配体结合的亲和力.GB 1亚基不结合G蛋白,而GB2亚基七次跨膜区能够偶联G蛋白,进而激活卜游信号(图2B).此外,GB 1亚基和GB2亚基均含有一个较长的胞内结构域,二者之间形成一个螺旋一螺旋结构域(c.iled-c.il d.main), GB1亚基由于C末端有一个内质网滞留信号RSRR,因而单独表达时不能被运输至膜上,当与GB2亚基共表达的时候,GB 1亚基和GB2亚基胞内区形成c.iled-c.il结构域,因而屏蔽了GB 1内质网滞留信号,GB 1与GB2以二聚体形式被运输至膜上.GABA.受体在突触前和突触后均有分布,在突触后更为丰富.在突触前,GABA.受体通过卜调电压门控C a2+通道活性而抑制神经递质的释放,GABA.自身受体抑制GABA的释放,GABA.异身受体抑制谷氨酸、多巴胺、'肾上腺素或5轻色胺等神经递质的释放.突触后GABA.受体通过激活内向整流性钾通道(inwardrectifier p.tassium channel , GIRK) Kir3,导致细胞膜超极化,进而诱导抑制性突触后电流(inhibit.ry p.stsynaptic currents IPSCs).
三、GABA受体与脆性X综合征.
1. GAB气受体与FXS.
研究发现,许多FXS患者会有癫痈或睡眠问题,这些症状都与GABA受体信号有关.
Miyashir.等研究发现,FMRP可以和GABA、受体s亚基mRNA直接结合.全基因组表达谱分析表明,Fxs缺失型小鼠神经元中有三个cDNA表达发生变化,包括GABA、受体的s亚基l22].随后发现FXS小鼠皮层中al, a3和.4,p1及p2,们和移mRNA表达水平均明显降低[23].除了不同亚基的mRNA水平降低外,Idrissi等[23]发现FXS小鼠在皮层、海马、间脑和脑干中,GABA、受体p亚基的表达在蛋白质水平也显著降低.这说明FMRP可能通过与GABA、受体mRNA结合增强其稳定性并抑制其降解.电生理研究显示FXS小鼠海马中GAGA能系统效率降低[24]解剖也发现GAGA能抑制性回路存在缺陷[25],可能主要是由于功能性蛋白表达降低所导致的.此外,GrU55等[26]发现,在加r1缺失型小鼠的脑干、海马、尾测皮层中,抑制性氨基酸(2-氨基乙磺酸和GABA)与兴奋性氨基酸(大冬氨酸和谷氨酸)的比值降低,推测主要是因为自由GABA水平降低的原因.有趣的是,主要的GABA合成酶谷氨酸脱梭酶(glutamate decarb.xylase 67, GAD67)的mRNA水平也明显降低,这与之前的推测相一致.然而,也有关于加r1缺失型小鼠中GAD67蛋白表达增加的报道. fmrl缺失型小鼠中GABA表达的改变主要表现在:1)海马中GABA受体信号传递效率降低;2) GABA受体强直性抑制卜调;3)与野生型小鼠相比,大脑皮层GABA释放中间神经元表现出形态缺陷.因此,增强GABA、受体信号可能有助于FXS治疗.
Chang等研究发现,GABA处理对dFmrl突变体果蝇起到了良好的效果.作者利用dFmrl突变果蝇在谷氨酸含量高的食物中培养时发生死亡这一模型,筛选到两个与GABA相关的化合物:呱u;酸(GABA再摄取抑制剂)和肌酸肝(GABA、受体激动剂),二者可以恢复由于高浓度谷氨酸对果蝇造成的毒性.此外,dFmrl突变体果蝇的蘑菇体结构异常和求偶行为异常也得到恢复.
四、GABA.受体与FXS.
目前关于FXS的大部分研究都集中在兴奋性I型mG1uRs,认为是mG1uRs卜游信号增强的结果.因此,抑制mG1uRs卜游信号成为一个很好的治疗FXS的策略.GABA.受体为抑制性神经递质受体,激活后可以抑制突触前谷氨酸释放,并抑制突触后mG1uR5卜游信号转导[29,30],说明GAGA.受体也可能是一个潜在的治疗Fxs的重要靶点.有趣的是,近年来的研究结果发现Fxs与GABA.受体存在极大的关联性.如Pacey等[31]研究发现,与野生型小鼠相比,GB1亚基在未成熟和成熟加r1缺失型小鼠前脑的表达显著降低,GB2亚基表达未发生变化,与此一致的是,自闭症患者(Fxs症状之一)大脑中GABA.受体表达量也出现明显降低.此外,有研究发现加r1缺失型小鼠对GAGA.受体激动剂bacl.fen的运动抑制效应敏感性增强.Pacey等利用缺乏编码FMRP基因的小鼠对听原性癫痈发作敏感这一模型,研究了GABA.受体与癫痈发作的关系,发现使用GABA.受体激动剂bacl.fen处理抑制了听原性的癫痈发作.进一步研究发现,在缺乏RGS4的加r1缺失型小鼠中,GABA.受体的拮抗剂CGP46381增强了癫痈的发作而对野生型小鼠没有影响.有趣的是,I型mG1uR拮抗剂也可以阻止癫痈发作.随后,Henders.n等从FXS病理学角度系统研究了GABA.受体的激动剂-外消旋bacl.fen的对映异构体STX209 (arbac.fen, R-bacl.fen)的作用机理,发现在加r1缺失型小鼠海马中蛋白质合成增加,但sTx2.9处理可以抑制过多的蛋白质合成.体外培养的加r1缺失神经元中,sTx2.9同样降低了AMPA受体的内化.此外,加r1缺失型小鼠sTx2.9慢性给药可以降低对癫痈的易感性及过度的树突棘密度,以及与Fxs致病相关的蛋白质合成,这些现象与I型mG1uR负向变构剂的作用效果非常相似.Berry-Kravis等通过随机双盲安慰剂交叉对照试验,发现尽管sTx2.9没有改变病人的易怒性格和攻击性,但却使病人社交回避的症状得到改善.此外,sTx2.a显示出了良好的安全性和疗效.
问题与展望
目前,人们对FMRP在神经发生、突触前信号传递和翻译调节中的分子作用机制研究已经取得了重要进展.这些研究成果推动了FXS治疗药物的研发速度,但是,由于脆性X综合征复杂的临床表现和独特的遗传规律,目前还没有很好的治疗方法.对FMRP激活上卜游的研究揭示了几个重要的治疗靶点,如I型mG1uRs .但是,单一的药物治疗并不能取得良好的治疗效果,必须进一步深入研究FXS的病理机制以寻找更多的治疗药物.尽管已经有研究报道GABA受体与FXS的密切关联,但是,GABA受体如何影响FXS的分子机制还有待于更深入的研究,GABA受体假说还需要进一步的完善.但从药理学角度激活GABA受体无疑被认为是FXS的一个治疗策略,已经逐渐被人们接受.
参考文献:
1.Crawf.rd DC, Acuna JM, Sherman SL. FMR1 and thefragile X syndr.me: Human gen.me epidemi.l.gy review.
Genet Med, 2001, 3(5): 359-371.
2.Levenga J, de Vrij FM, ..stra BA, Willemsen R. P.tentialtherapeutic interventi.ns f.r fragile X syndr.me. TrendsM.l Med, 2010, 16(11): 516-527.
3.Penagarikan. ., Mulle JG, Warren ST. The path.physi.l.gy.f fragile X syndr.me. Annu Rev Gen.mics Hum Genet,2007, 8: 109-129.
4.Reiss AL, Hall SS. Fragile X syndr.me: Assessment andtreatment implicati.ns. Child Ad.lesc Psychiatr Clin N Am,2007, 16(3): 663-675.
5. R.berts JE, Weisenfeld LA, Hatt.n DD, Heath M,Kaufmann WE. S.cial appr.ach and autistic behavi.r inchildren with fragile X syndr.me. J Autism Dev Dis.rd,2007, 37(9):1748-176
6. Hagerman R, H.em G, Hagerman P. Fragile X andautism: Intertwined at the m.lecular level leading t.targeted treatments. M.l Autism, 2010, 1(1): 12Verkerk AJ, Pieretti M, Sutcliffe JS, Fu YH, Kuhl DP,Pizzuti A, Refiner ., Richards S, Vict.ria MF, Zhang FP.
7.Identificati.n .f a gene (FMR-1) c.ntaining a CGG repeatc.incident with a breakp.int cluster regi.n exhibiting lengthvariati.n in fragile X syndr.me. Cell, 1991, 65(5): 905-914.
8.stra BA, Willemsen R. FMR1: A gene with three faces.Bi.chim Bi.phys Acta, 2009, 1790(6): 467-477.
9.Br.uwer JR, Willemsen R, ..stra BA. The FMR1 geneand fragile X-ass.ciated trem.r/ataxia syndr.me. Am JMed Genet B Neur.psychiatr Genet, 2009, 150B (6):782-798.
10Naumann A, H.chstein N, Weber S, Fanning E, D.erflerW. A distinct DNA-methylati.n b.undary in the 5