
着丝粒(centromere)是真核生物染色体的重要组成元件, 在细胞分裂过程中, 它作为染色体着丝点复合体形成和微管附着的位点, 与细胞有丝分裂和减数分裂染色体行为密切相关.虽然着丝粒在不同真核生物细胞分裂过程中的功能极为保守, 但是, 令人吃惊的是着丝粒在蛋白结构、DNA序列和装配方式等在不同的真核生物之间却表现出极大的差异. 早在19世纪80年代, Flemming就对着丝粒进行了描述, 但在关于着丝粒中包含的蛋白类型、DNA构成方式等结构和功能的研究上, 因涉及到复杂的基因组遗传学与表观遗传学的机制, 还远远没有揭开.真核生物着丝粒的基本单位是着丝粒核小体在着丝粒核小体中含有组蛋白H3的一种变种蛋白即着丝粒特异性组蛋白H3, 它是微管与染色质连接体的重要组成部分.着丝粒组蛋白在人和其他哺乳类中被称为CENP-A, 在果蝇中被称为CID, 在酵母中被称为CSE4, 在线虫中被称为HCP3等.生命体内常规核小体结构早在上个世纪70年就已经被确定, 常规核小体由组蛋白H2A、H2B、H3和H4,每一组蛋白各两个拷贝形成八聚体, 由直接缠绕在组蛋白八聚体上所形成.然而, 在真核生物的着丝粒区域, 着丝粒核小体是如何构成的一直没有统一的答案.近几年, 人们利用体外vitro)和体内(in vivo)实验, 提出了着丝粒核小体结构的八聚体、六聚体、同型四聚体以及半八聚体模型(图1), 对不同生物的着丝粒核小体结构进行了深入的探讨.
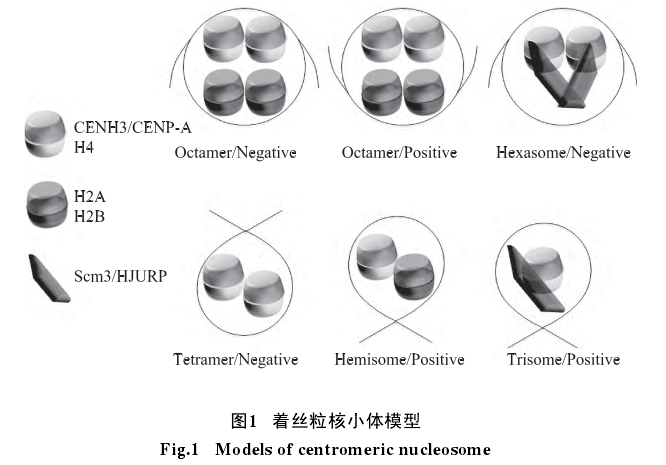
1 着丝粒核小体模型
1.1 八聚体着丝粒核小体模型
目前, 着丝粒核小体八聚体模型的主要实验证据多为体外组装实验所获得.根据含有CENP-A组蛋白的数量, 分为同型八聚体和异型八聚体两种.
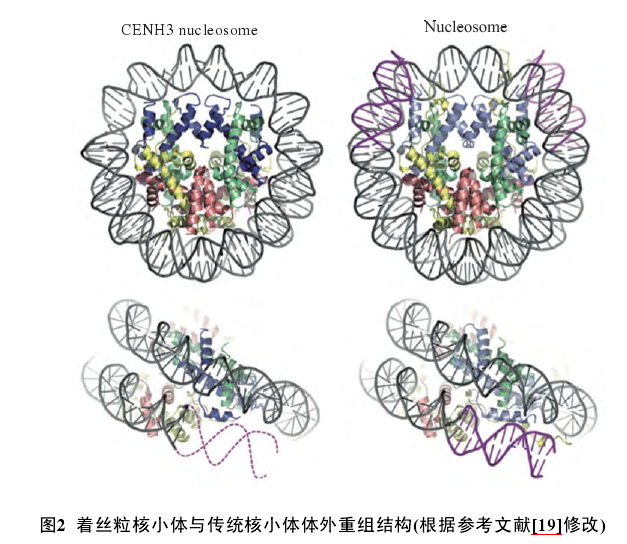
其中, 同型模型中含有CENP-A、H4、H2A和各两个蛋白; 而异型模型中除H4、H2A与H2B的数量与同型模型中相等外, H3和CENH3均为一个拷贝.体外组装实验研究发现, 由于CENP-A比CENP-A-H3的亲和力更强, 因而更容易形成同型的八聚体.如图2虚线部分所示, 根据体外重组着丝粒核小体X射线衍射结果, Tachiwana等发现人类着丝粒核小体上所缠绕的DNA为121 bp, 比常规核小体的147 bp更短.其中着丝粒核小体中每个(CENP-A -H4-H2A-H2B)四聚体上缠绕的DNA均比传统核小体(H3-H4-H2A-H2B)四聚体少.
Hasson等也通过染色质免疫共沉淀测序seq)技术证实, 人类着丝粒核小体上缠绕的DNA的长度短于传统核小体上缠绕的DNA.
1.2 半八聚体着丝粒核小体模型
半八聚体模型是在一个核小体中只含有一份拷 贝 的CENP-A、H4、H2A和H2B.Dalal等和Dimitriadis等通过体内实验(in vivo)利用原子力显微镜发现, 在果蝇和人类细胞中含有的核小体的高度只有常规核小体的一半, 而且在果蝇中着丝粒核小体无法通过交联的方式形成八聚体.Krassovsky等利用高通量测序及技术发现酵母着丝粒核小体所结合的DNA在左右, 这也远远小于八聚体模型中的147 bp或者121 bp.Densmore等的研究发现, 酵母着丝粒核小体的结合区域为序列, 而CDE序列中又可以分为CDE I、CDE II和CDE III三个元件, 其中CDE I为Cbf1蛋白的结合位点, CDE III为CEBF3着丝粒复合体的结合位点(图3B).如图3A所示, 图中横坐标为CSE4染色体免疫共沉淀(anti-CSE4 ChIPed)读段(Reads)中点到CDE序列中点的距离, 纵坐标为读段的长度.我们可以发现, 图3A中存在12 bp、125 bp和25 bp的保护区域, 这表明存在这三种不同长度的DNA片段被蛋白保护, 由于12 bp和25 bp为CBF1和CBF3所保护的区域, 从而计算出酵母着丝粒核小体所结合的序列是大约在80 bp左右.
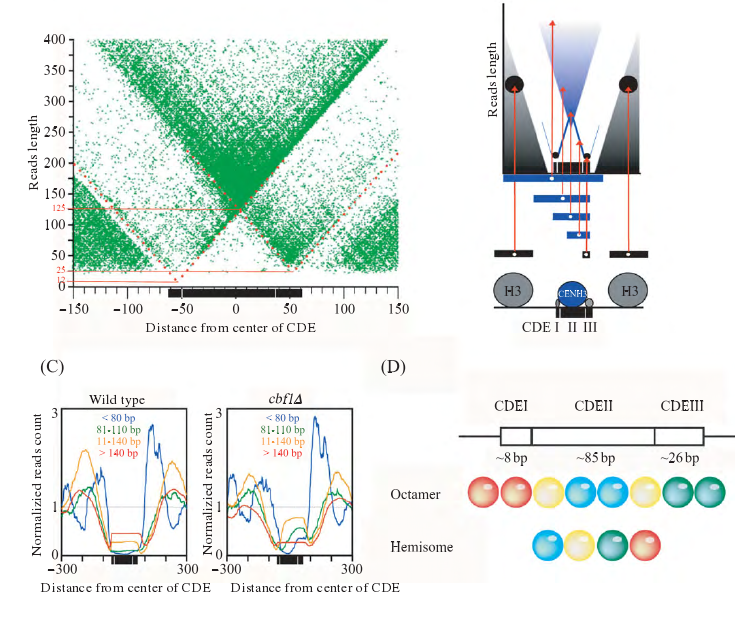
与此同时, 在Cbf1蛋白突变株cbf1?中, 小于的片段要远远多于野生型酵母.另外, 在CDE I区域也不存在被蛋白所保护的DNA, 这说明了酵母着丝粒核小体的核心区域所保护的DNA在80 bp左右(图3C).Furuyama等发现, 通过调整盐浓度, 在体外组装得到了含有CSE4的半八聚体着丝粒核小体, 解释了为什么不同的实验室的体外实验可以获得不同的着丝粒核小体结构.根据上述实验, 我们可以清楚地得出, 如果酵母着丝粒核小体为八聚体, 是可以保护全部CDE, 而这与cbf1?突变实验相互矛盾, 这也证实酵母着丝粒核小体为半八聚体结构, 并被大约80 bp的DNA所缠扰(图3D).
1.3 三聚体/六聚体模型和HJURP/Scm3
蛋白伴侣在芽殖酵母中, 研究表明存在一种仅含有CSE4、H4和SCM3的蛋白复合体, 而该复合体可能有助于着丝粒核小体的形成.而在人类中, 也发现了类似的蛋白复合体, 与酵母不同的是与Scm3起相同功能的蛋白是HJURP, 该三聚体的结构已经通过X射线衍射获得(图1).而六聚体模型, 则是含有两份拷贝的CSE4、H4和(图1).通过体外组装实验发现, 三聚体模型中的HJURP蛋白伴侣能与DNA结合.
1.4 四聚体模型
Williams等和Aravamudhan等分别在芽殖酵母的着丝粒核小体中, 发现存在一种只有两份拷贝的CSE4和H4蛋白复合体(图1), 而该复合体中并不含有H2A和H2B.
2 、着丝粒核小体DNA的缠绕方式
传统的八聚体核小体的DNA缠绕方式为负超螺旋结构.而在着丝粒核小体中, Furuyama等构建了含有酵母着丝粒的微小染色体, 通过对该微小染色体中着丝粒核小体的分析发现, DNA在着丝粒核小体上的缠绕方式为正超螺旋, 这与传统核小体的负超螺旋结构明显不同.
3 、细胞周期与着丝粒核小体的关系
常规核小体的模型早在几十年前就已经被确定, 而为何一个功能极其保守的着丝粒核小体结构会有这么多的模型而且各种模型之间互不相容, 这是一个值得深入探究的问题.首先, 体外重组装实验通常都采用在某种盐浓度条件下进行, 多数情况都没有蛋白伴侣的参与, 这导致了在同一条DNA上不能通过体外组装产生超过3个八聚体着丝粒核小体的串联结构.其次, 由于交联剂(如甲醛的使用通常会破坏蛋白的结构, 也影响了核小体的结构.再次, 由于细胞环境是动态的, 不同细胞周期着丝粒核小体的结构可能会存在一定的差异.
使用原子力显微镜进行着丝粒结构的观察, 不需要进行交联处理和超低温冷冻等可能使核小体结构发生改变的预处理, 这为观察天然状态下的着丝粒核小体提供了有利条件.
在2011年, Black等提出了半八聚体/三聚体四聚体和八聚体之间的细胞周期转换模型, 他们认为在细胞内存在多种状态的着丝粒核小体, 首先在期细胞中存在八聚体、四聚体、半八聚体、六聚体以及三聚体, 然后经过DNA复制, 在S期细胞中着丝粒核小体为八聚体并含有半八聚体, 而进入M期后均为八聚体.随着研究的深入, 这种模型得到了修订.Bui等利用原子能显微镜观察发现, 着丝粒核小体的大小随着细胞周期的变化而变化.其中/S期和/M期的着丝粒核小体明显小于S期着丝粒核小体(表1).而S期的着丝粒核小体的大小与体外组装的常规核小体及着丝粒核小体大小相当.这就说明着丝粒核小体在S期可能是八聚体, 而在其他时期为半八聚体(图4).根据进一步的实验, 发现在期HJURP蛋白不与着丝粒核小体结合, 在S期与期着丝粒染色质的核小体排布比较规则, 核小体与核小体之间存在开链染色质结构.
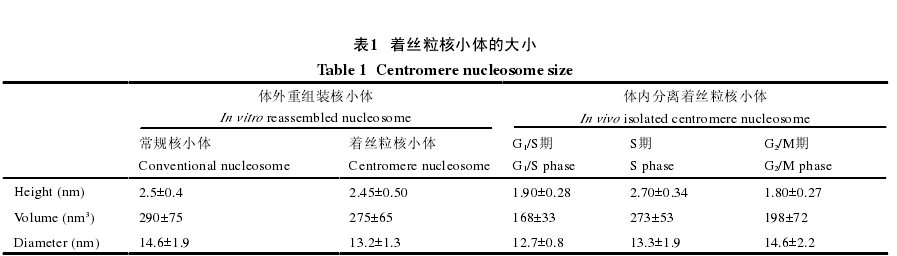
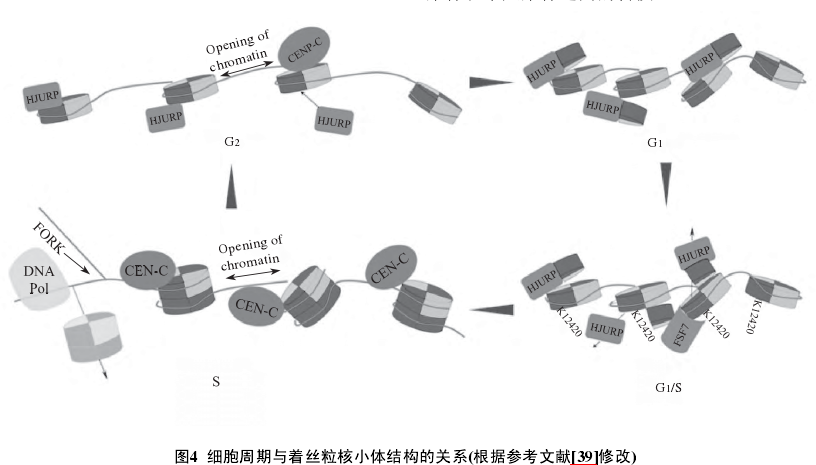
Shivaraju等通过荧光能量共振转移resonance energy transfer, FRET)实验发现, 在酵母细胞中, 随着细胞周期的改变, 着丝粒核小体也存在八聚体和半八聚体之间的转换.
4 、着丝粒核小体结构
动态变化的生物学解释首先, 着丝粒组蛋白伴侣只在、/S和S期定位于着丝粒, 而这些时期着丝粒核小体均呈现半八聚体结构.这是因为蛋白伴侣HJURP/Scm3会和CENP-A组蛋白进行竞争性结合, 如果一个组蛋白结合了HJURP/Scm3后就无法结合另外一个CENP-A而形成八聚体, 而HJURP/Scm3可以介导半八聚体转化为八聚体.然后, 在着丝粒核小体为八聚体结构时, CENP-A第124位的赖氨酸(CENP-A K124)和H4的97位赖氨酸均被乙酰化.
其中, 八聚体着丝粒核小体的CENP-A K124与传统核小体的H3K122均位于缠绕核小体的中心位置, 且H3K122在通常情况下是被乙酰化的, 传统核小体H3K122去乙酰化会影响核小体的稳定性.而在半八聚体的着丝粒核小体中发现CENP-A K124处于未被乙酰化的状态.据此我们可以推断, 着丝粒核小体八聚体结构的形成与CENP-A K124的乙酰化有一定的关系.与此同时, 在人类着丝粒间期细胞复合体(interphase centromere complex)中发现了去乙酰化蛋白酶, 这也从另外的层面表明着丝粒核小体在细胞分裂间期需要去乙酰化蛋白酶的参与而形成半八聚体.
DNA的半保留复制模型许多年前就已经确定而生命体的表观遗传信息如组蛋白修饰是否在细胞复制过程中进行传递, 目前还存在争论.例如, 含有H3.3的核小体遵从半保留复制的基本理念, 核小体八聚体的中的两份H3.3组蛋白被均匀地分配到子代细胞中.而含有H3.1的核小体则不遵循半保留复制的原则, 含有H3.1组蛋白的核小体在子代细胞中一个核小体上的两份H3.1要么全部由父代细胞获得, 要么全新合成, 不存在半保留的机制.而着丝粒核小体组蛋白是怎样遗传到子代细胞中, 目前尚不清楚.目前, 我们只知道在S期细胞中, 含有的核小体会临时占据以前含有CENP-A的着丝粒核小体的位置, 而蛋白伴侣HJURP如何识别H3.3与CENP-A的着丝粒组蛋白、如何遗传给子代细胞, 仍然有待研究.5 展望不同物种中着丝粒特异组蛋白异构体同源物的存在, 使真核细胞着丝粒核小体的结构与功能进一步复杂化.同时, DNA甲基化与组蛋白的共价修饰以及染色质重塑等, 为真核生物细胞的表观遗传信息传递起到了载体的作用.而在生命体的进化过程中, 这些经过共价修饰的组蛋白是如何嵌入核小体, 并在不同类型的染色质中形成结构和功能各异的核小体, 从而在生物体表观遗传过程中发挥非常重要功能的过程, 都值得深入研究.我们认为, 通过进一步的深入开展体内实验, 研究异常的着丝粒或人工变异着丝粒的染色体如新着丝点(neocentromere)染色体、人工染色体(artificial chromosomes)和双着丝点染色体chromosomes)等的结构与功能, 并结合高通量测序技术, 更好地阐释CENP-A分子维持生物遗传特性的独特机制, 进而透彻理解着丝粒与染色质的精确结合, 在真核生物细胞的发育、表观遗传记忆、染色质重塑和基因表达调控等方面发挥重要作用的遗传机制.同时, 拓展对更多的模式动植物物种的研究, 继续对CENH3等关键性的表观遗传元件进行详细解析, 可以在不久的将来为遗传工程实现多种重要真核生物的人工染色体构建提供依据, 并使之在农业和医学等领域得到广泛应用.
参考文献
1 王桂香, 张学勇, 金危危. 植物着丝粒研究进展. 遗传学报(Wang Guixiang, Zhang Xueyong, Jin Weiwei. An overview ofplant centromeres. J Genet Genomics) 2009; 36(9): 529-37.
2 Regnier V, Vagnarelli P, Fukagawa T, Zerjal T, Burns E,Trouche D, et al. CENP-A is required for accurate chromosomesegregation and sustained kinetochore association of BubR1. MolCell Biol 2005; 25(10): 3967-81.
3 Sullivan KF. A solid foundation: Functional specialization ofcentromeric chromatin. Curr Opin Genet Dev 2001; 11(2): 182-8.
4 Earnshaw WC, Rothfield N. Identification of a family of Humancentromere proteins using autoimmune sera from patients withScleroderma. Chromosoma 1985; 91(3/4): 313-21.
5 Stoler S, Keith KC, Curnick KE, Fitzgeraldhayes M. A mutationin Cse4, an essential gene encoding a novel chromatin-associatedprotein in yeast, causes chromosome nondisjunction and cell-cycle arrest at mitosis. Genes Dev 1995; 9(5): 573-86.
6 Henikoff S, Ahmad K, Platero JS, van Steensel B. Hetero-chromatic deposition of centromeric histone H3-like proteins.
Proc Natl Acad Sci USA 2000; 97(2): 716-21.
7 Buchwitz BJ, Ahmad K, Moore LL, Roth MB, Henikoff S. Ahistone-H3-like protein in C. elegans. Nature 1999; 401(6753):
547-8.
8 Talbert PB, Ahmad K, Almouzni G, Ausio J, Berger F, BhallaPL, et al. A unified phylogeny-based nomenclature for histonevariants. Epigenetics Chromatin 2012; 5: 7.
9 Kornberg RD, Thomas JO. Chromatin structure-oligomers ofhistones. Science 1974; 184(4139): 865-68.
10 Luger K, Mader AW, Richmond RK, Sargent DF, RichmondTJ. Crystal structure of the nucleosome core particle at 2.8 Aresolution. Nature 1997; 389(6648): 251-60.
11 Camahort R, Shivaraju M, Mattingly M, Li B, Nakanishi S, ZhuDX, et al. Cse4 is part of an octameric nucleosome in buddingyeast. Mol Cell 2009; 35(6): 794-805.
12 Erhardt S, Mellone BG, Betts CM, Zhang WG, Karpen GH,Straight AF. Genome-wide analysis reveals a cell cycle-dependentmechanism controlling centromere propagation. J Cell Biol 2008;183(5): 805-18.
13 Sekulic N, Bassett EA, Rogers DJ, Black BE. The structureof (CENP-A-H4)(2) reveals physical features that markcentromeres. Nature 2010; 467(7313): 347-51.
14 Shelby RD, Vafa O, Sullivan KF. Assembly of CENP-Ainto centromeric chromatin requires a cooperative array ofnucleosomal DNA contact sites. J Cell Biol 1997; 136(3): 501-13.
15 Foltz DR, Jansen LE, Black BE, Bailey AO, Yates JR 3rd,Cleveland DW. The human CENP-A centromeric nucleosome-associated complex. Nature Cell Biol 2006; 8(5): 458-77.
16 Kingston IJ, Yung JS, Singleton MR. Biophysical characterizationof the centromere-specific nucleosome from budding yeast. JBiol Chem 2011; 286(5): 4021-26.
17 Tachiwana H, Kagawa W, Shiga T, Osakabe A, Miya Y, SaitoK, et al. Crystal structure of the human centromeric nucleosomecontaining CENP-A. Nature 2011; 476(7359): 232-5.
18 Hasson D, Panchenko T, Salimian KJ, Salman MU, SekulicN, Alonso A, et al. The octamer is the major form of CENP-Anucleosomes at human centromeres. Nat Struct Mol Biol 2013;20(6): 687-95.
19 Maddox PS, Corbett KD, Desai A. Structure, assembly andreading of centromeric chromatin. Curr Opin Genet Dev 2012;22(2): 139-47.
20 Dalal Y, Wang H, Lindsay S, Henikoff S. Tetrameric structure ofcentromeric nucleosomes in interphase Drosophila cells. PLoSBiol 2007; 5(8): e218.
21 Dimitriadis EK, Weber C, Gill RK, Diekmann S, Dalal Y.
非编码RNA在基因调控方面有着重要功能,可广泛参与基因调控的各个层面,在发育、癌症、神经功能紊乱等生物过程中都发挥重要作用[1]。在长非编码RNA中有一重要亚类,天然反义转录本,是从已知转录序列的互补链转录的转录物[2]。有学者提出一些分子模...
引言细胞通讯使得细胞能够接收到其它细胞发来的信号,并能够准确无误地发挥功能,这对于多细胞机体的发育、免疫适应,以及组织内不同细胞类型之间功能的协调十分重要.细胞之间可以通过可溶性因子进行细胞通讯,粘附分子介导的细胞-细胞相互作用可以连接邻近...
表达CD5抗原的B细胞即B1a细胞广泛分布于小鼠胸腔和腹腔,也存在于脾脏中,约占其B细胞总量的5%.这种细胞能够产生多种多反应性及亲和力低的自身抗体,并且能够分泌具有免疫抑制作用的IL-10[1].TLR7受体是一种模式识别受体,能够识别病原相关模式分子从而...
细胞间隙连接(GJ)是细胞间直接进行物质交流的唯一膜通道结构[1].它由相邻细胞膜上间隙连接蛋白(Cx)形成的半通道(连接子)对接而成,目前所鉴定出的20多种Cx中,以Cx43表达最广泛.研究发现,在肿瘤和转化细胞中,普遍存在Cx43表达异常、细胞间隙通信(GJIC)功能缺陷...
巨噬细胞(Macrophages,M)是机体抗感染免疫的主要效应细胞,在脊椎动物中M来源于两类造血细胞.一是来源于胚胎期的卵黄囊和胎肝,并进一步发育成组织定居M;二是来源于骨髓中的单核细胞前体,经血液进入结缔组织或器官后进一步分化成组织定居M或炎性M.M主...
一、引言脆性X染色体综合症(fragileXsyndr.meFXS)是引起先大性智力低卜及自闭症的一种常见遗传病.该疾病通过遗传和非遗传因素影响世界1%^3%的人口,男性发病率为1/4000,女性发病率为1/8000z.FXS小孩患者认知和行为发生缺陷,包括注意力不集中、癫痈、社...