
厚颌鲂(Megalobrama pellegrini)俗称乌鳊, 隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、 鲌亚科(Cultrinae)、鲂属(Megalobrama)[1], 是长江上游特有的经济鱼类之一.厚颌鲂曾被认为是三角鲂(M. terminali)的同种异名, 后经罗云林[2]对鲂属物种的性状差异进行详细分析后, 将其确立为有效种.然而, 近年来, 由于栖息地不断被破坏、片段化以及过度捕捞等人为因素的影响, 厚颌鲂的种群数量处于急剧下降趋势[3, 4].同时, 三峡大坝及长江上游梯级电站的陆续开发严重改变了长江上游的水文环境,如原来的流水环境变成静水环境, 这对厚颌鲂这种在繁殖季节对流水条件要求较为苛刻的物种来说无疑是一种毁灭性的破坏[5].据调查, 目前厚颌鲂在长江上游的干流及其大型支流基本绝迹, 仅于长江上游的一级支流--龙溪河尚存在种群规模的野生厚颌鲂群体[3], 而且研究表明, 此水域的厚颌鲂种群资源由于过度开发其资源量仍处于下降趋势[4].刘军[6]曾根据濒危系数、遗传损失系数和物种价值系数将鱼类的优先保护顺序划分为四个级别, 厚颌鲂已达到三级急需保护物种.
生物的遗传多样性水平是长期进化的产物, 是评估生物资源现状的一个重要参数, 遗传多样性越高, 即遗传变异越丰富, 则对环境的适应能力就越强, 其生存的竞争力就越强.然而, 目前关于厚颌鲂遗传多样性的研究较少.刘焕章和汪亚平[8]基于同功酶标记对厚颌鲂合江群体的遗传多样性进行了初步评估; Wang 等[9]基于微卫星标记对厚颌鲂龙溪河群体的遗传多样性进行了初步评估,得到的结果均显示厚颌鲂群体的遗传多样性水平较低.本研究同时采用核基因标记--微卫星标记(Simple se-quence repeat, SSR) 和线粒体标记 (Mitochondrial DNA,mtDNA)--细胞色素 b 基因(Cytb)与控制区(D-loop)序列,分别对龙溪河水域及球溪河水域的厚颌鲂野生群体的遗传多样性进行比较分析, 试图从分子水平比较这两个厚颌鲂野生群体的遗传多样性差异, 以期为厚颌鲂的种群复壮和种质资源的合理开发与利用等保护管理研究提供有价值的科学依据.
1 材料与方法
1.1 材料
本研究中的 2 个厚颌鲂野生群体分别来源于长江上游的一级支流--龙溪河, 以及沱江的一级支流--球溪河.其中, 厚颌鲂龙溪河群体(LXH)于 2010 年不同时段采自四川省泸州市龙溪河(同 Wang 等[9]中的野生群体),实验样本量(Number of individuals, N)共计 30 尾; 厚颌鲂球溪河群体(QXH)于 2011 年 10 月购自四川省泸州市龙阳区渔种站(该群体来源于近几年球溪河水域的野生厚颌鲂作为亲本经人工繁殖得到的子一代群体, 且亲本数在 10对以上, 故本研究将其视为"野生群体"), 实验样本量(N)共计 32 尾.上述两个群体的代表样本均是随机取样, 且每尾标本分别取其新鲜肌肉与鳍条于 95%酒精中固定,–20℃保存备用.
1.2 基因组 DNA 的提取
样品基因组 DNA 的提取采用 DNeasy Blood andTissue kit(QIAGEN)试剂盒, 具体步骤参照试剂盒手册.
1.3 引物设计及 PCR 扩增
微卫星标记: 参考 Wang 等[9]研究中开发的厚颌鲂多态性微卫星标记, 本研究共选取 10 个多态性相对较高(如多态信息含量>0.5)且未偏离哈迪-温伯格平衡的微卫星标记(MP8、MP14、MP15、MP16、MP17、MP28、MP32、MP40 、 MP45 和 MP48) ( 登录号分别是 : JQ087472 、JQ087475、JQ087476、JQ087477、JQ087478、JQ087483、JQ087486、JQ087488、JQ087492、JQ087494).具体的引物序列、PCR 扩增、产物检测及其记数等详见 Wang 等[9].线粒体标记: Cytb 基因片段的引物为通用引物L 1 4 7 2 4 ( 5 - G A C T T G A A A A A C C A C C G T T G - 3 ) 和H15915(5 -CTCCGATCTCCGGATTACAAGAC-3 )[ 10];D-loop 片段的引物为本研究设计的厚颌鲂特异性引物MP-CR_F(5 -CGGTCTTGTAATCCGAAGATCG-3 )和MP-CR_R(5 -CATGTGTAAGTCGGGTAAGAGCTG-3 ).
PCR 反应总体系为 25 μL, 其中, 10×Buffer (TaKaRa)2.5 μL, MgCl2(30 mnol/μL) 1.5 μL, dNTPs (10 mmol/L)2 μL, 上下游引物(10 μmol/L)各 1 μL, rTaq 聚合酶9 (TaKaRa) 1U, 模板 DNA 100 ng.反应条件: 94℃预变性2min; 随后 30 个循环, 每一次循环的参数设置为 94℃变性 30s, 56℃退火 30s, 72℃延伸 90s; 最后 72℃终延伸7min.PCR 扩增产物于 1%琼脂糖凝胶电泳检测, 然后直接由华大基因(BGI)完成纯化回收及双向测序工作.
1.4 数据分析
微卫星标记: 应用软件 POPGENE 1.31[11]、CERVUS3.0.3[12]和 Arlequin 3.5[13]分别完成对厚颌鲂遗传结构的分析, 计算的基本参数主要有: 等位基因数(Number ofAllele, Na)、观测杂合度(Observed Heterozygosity, Ho)、期望杂合度(Expected Heterozygosity, He)、多态信息含量(Polymorphic Information Content, PIC)、哈迪-温伯格平衡(Hardy-Weinberg Equilibrium, HWE) 、 遗 传 分 化 指 数(Fixation Index, Fst)和分子方差分析(Analysis of MolecularVariance, AMOVA)等.
线粒体标记: 测序获得的 Cytb 与 D-loop 序列集分别由Clustal X 软件[14]、Seaview 软件[15]进行编辑、校正和比对.通过 DnaSP 5.0 软件[16]统计各群体的单倍型数(Haplotype,H)、单倍型多样性指数(Haplotype diversity, Hd)、变异位点数(Variable site, V)、核苷酸多态样性指数(Nucleotide diver-sity, Pi)等.使用 Arlequin 3.5 软件[13]计算两两群体间的 Fst值, 并进行 AMOVA 分析.单倍型间遗传距离通过 1000 次重抽样进行显着性检验.单倍型序列由 Sequin 12.30 软件(NCBI)完成注释, 并提交至 GenBank 获取序列号.
2 结果
2.1 厚颌鲂龙溪河群体与球溪河群体的遗传多样性
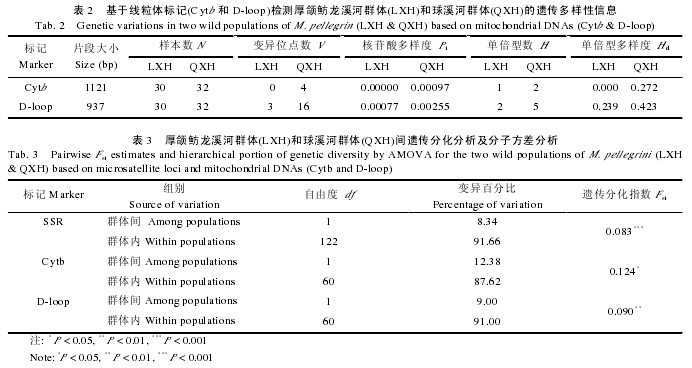
基于10个微卫星标记计算出的厚颌鲂龙溪河群体与球溪河群体的遗传多样性结果如表 1 所示.龙溪河群体所检测到的微卫星平均等位基因数为 3.8 个, 平均观测杂合度为 0.63, 平均期望杂合度为 0.62, 平均多态信息含量为0.54, 其遗传多样性呈中等水平.而与龙溪河群体相比,球溪河群体的遗传多样性与之相当, 如: 平均等位基因数为 3.7 个,平均观测杂合度为 0.64, 平均期望杂合度为0.64, 多态信息含量为 0.55.此外, 10 个微卫星标记中有 5个位点(MP16、MP17、MP28、MP40 和 MP45)在球溪河群体中显着或极显着地偏离了哈迪-温伯格平衡(P<0.05).
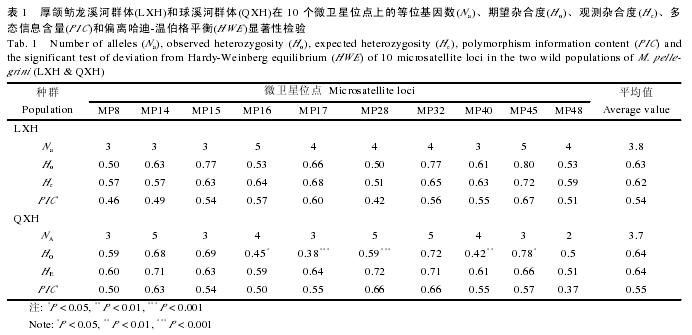
基于线粒体标记计算出的两个厚颌鲂野生群体的遗传多样性结果如表 2 所示.经比对得到的 Cytb 片段与D-loop 片段的大小分别为 1121 和 937 bp, 均无插入、缺失.Cytb 片段在两个野生群体(共计 62 个个体)中共检测到 4 个变异位点, 2 种单倍型(Ha1、Ha2); 其中, 在龙溪河群体的 30 个个体中只检测到一种单倍型(Ha1; GenBank登录号 KC425463), 因此, 单倍型多样性指数(Hd)、变异位点数(V)、核苷酸多样性指数(Pi)均为 0, 显示其遗传多样性水平极低; 而在球溪河群体中除了拥有 Ha1 单倍型(GenBank 登录号 KC425464)外, 还检测到第 2 种单倍型(Ha2; GenBank 登录号 KC425465), 表现出的多样性比龙溪河群体略高(Hd=0.272, V=4, Pi=0.00097).与 Cytb 片段相比, D-loop 片段表现出更高的序列变异, 在两个群体(共计 62 个个体)中共检测到 19 个变异位点, 组成 6 种单倍型; 其中, 在龙溪河群体中共检测到 2 种单倍型(Ha1、Ha2; GenBank 登录号分别为 KC425466 和 KC425467), 在球溪河群体中共检测到 5 种单倍型(Ha1、Ha3、Ha4、Ha5、Ha6; GenBank 登录号 KC425468-KC425472).与 Cytb的结果相似, D-loop片段的计算结果同样显示厚颌鲂球溪河群体的遗传多样性水平比龙溪河群体的遗传多样性高(龙溪河群体: H=2, Hd=0.239, V=3, Pi=0.00077; 球溪河群体: H=5, Hd=0.423, V=15, Pi=0.00243).
2.2 厚颌鲂龙溪河群体与球溪河群体的间遗传分化
分别基于微卫星标记与线粒体 DNA 标记(Cytb 和D-loop)对厚颌鲂龙溪河群体与球溪河群体间的遗传分化进行分子方差分析(AMOVA)、遗传分化指数(Fst)计算, 并进行显着性检验(表 3).结果表明, 遗传变异主要发生在群体内(87.62%-91.66%)而非群体间, 且龙溪河群体与球溪河群体间存在显着的遗传分化(Fst=0.083-0.124,P<0.05).
3 讨论
3.1 遗传标记的选择
DNA 分子标记是基因的直接反应, 不受环境和其他因素的影响, 无组织特异性, 不受基因表达与否的影响,具有数量丰富、多态性强及操作简便等特点.其中, 微卫星标记与线粒体 DNA 由于突变速率快、多态性高等特性已被广泛应用于种群遗传结构等方面的研究[17-19].在本研究中, 10 个微卫星标记与 D-loop 片段在两个群体中分别表现出多态, 但与之相比, Cytb 基因片段在野生群体的30 个个体中没有检测到变异位点, 在球溪河群体的 32 个个体中也只检测到 4 个变异位点, 2 个单倍型.理论上,D-loop 作为一个非编码区所承受的选择压力较蛋白编码基因 Cytb 要小的多(即约束力相对小), 通常情况下,D-loop 片段的进化速率普遍要高于 Cytb 基因的进化速率,如 McMillan 和 Palumbi[20]曾指出蝴蝶鱼的 D-loop 片段的进化速率非常快, 是 Cytb 序列进化速率的 33-43 倍.因此, 本研究选择的微卫星标记与 D-loop 片段较 Cytb 片段更适合作为检测厚颌鲂群体遗传变异的有效标记.
3.2 哈迪-温伯格平衡
本研究采用的 10 个微卫星标记中有 5 个位点(MP16、MP17、MP28、MP40 和 MP45)在球溪河群体中显着或极其显着地偏离了哈迪-温伯格平衡(表 1).在种群遗传学研究中, 经常会出现偏离哈迪-温伯格平衡的现象, 主要原因有华伦德效应(Wahlund effect)、近亲交配(inbreeding)、无效等位基因(Null alleles)等致使的杂合度不足等[21].在球溪河群体中, 位点 MP16、MP17、MP28 及 MP40 存在纯合子过剩现象(Ho<He), 而在位点 MP45 则存在着杂合子过剩现象(Ho>He).而球溪河群体源自于人工繁殖的子一代, 有限的亲本数量很可能导致近亲交配, 这就不难理解为何在球溪河群体中有 5 个位点都偏离哈迪-温伯格平衡.
3.3 遗传多样性
厚颌鲂是我国长江上游地区的特有鱼类, 具有重要的生态价值和遗传价值.本研究首次采用微卫星标记和线粒体 DNA 标记(Cytb 和 D-loop)对龙溪河和球溪河水域的厚颌鲂野生群体的遗传多样性进行了评估.其中, 微卫星标记的分析结果显示, 与长江上游其他特有物种相比,如圆口铜鱼(Coreius guichenoti)[22]、稀有 鲫(Gobiocyprisrarus)[23]、岩原鲤(Procypris rabaudi)[24], 厚颌鲂龙溪河群体与球溪河群体的遗传多样性均处于中等偏低水平.而从线粒体 DNA 分析的结果来看, 两个群体的单倍型多样度(Hd)与核苷酸多样度(Pi)均较小(Hd<0.5, Pi<0.5%), 暗示厚颌鲂自然群体近期可能经历过瓶颈效应(Bottleneckeffect)[25].此外, 线粒体 DNA 数据的分析结果显示球溪河群体较龙溪河群体的遗传多样性更高.用于本研究中的厚颌鲂球溪河群体来自于球溪河亲本人工繁殖的子 1 代,虽然球溪河水域尚有厚颌鲂的踪影, 但却很难再捕捞到种群规模的厚颌鲂样本.由此可见, 即使目前栖息于球溪河水域的野生厚颌鲂数量极其有限, 但仍保存着略高于龙溪河水域厚颌鲂的遗传多样性.因此, 源于球溪河水域的野生厚颌鲂较龙溪河水域的野生厚颌鲂更适用于人工繁殖, 对其种群资源的复壮具有更显着的价值.
3.4 遗传分化
遗传分化指数 Fst是揭示群体间遗传分化程度的重要参数.本研究基于微卫星标记、Cytb 和 D-loop 片段计算出的厚颌鲂龙溪河群体与球溪河群体间的遗传分化指数分别为 0.083、0.124 和 0.090, 根据 Wright[26]对 Fst值的划分显示, 本研究中的这两个野生厚颌鲂群体间存在着中等程度的遗传分化.我们分析存在这一现象的主要原因是地理阻隔, 因为龙溪河河口上游存在一个天然悬崖,形成了龙溪河和长江干流之间的天然阻隔[3], 从而导致龙溪河水域的厚颌鲂群体与球溪河(沱江一级支流)水域的厚颌鲂野生群体难以进行基因交流.
总之, 根据本研究的结果, 我们认为在野生厚颌鲂资源一时难以大量发现和获取的现状下, 现有来自于球溪河的野生群体和人工繁殖子一代群体具有重要的保护和利用价值.
参考文献:
[1] Ding R H. Fishes of Sichuan [M]. Chengdu: Sichuan Scienceand Technology Press. 1994, 238-240 [丁瑞华. 四川鱼类志. 成都: 四川科学技术出版社. 1994, 238-240]
[2] Luo Y L. A revision of fishes of the cyprinid genus Megalo-brama [J]. Acta Hydrobiological Sinica, 1990, 14(2):160-165 [罗云林. 鲂属鱼类的分类整理. 水生生物学报,1990, 14(2): 160-165]
[3] Li W J. Research on the biology and ecology of Megalo-brama pellegrini, an endemic fish of the upper Yangze River[D]. Ph D dissertation. Huazhong Agricultural University,Wuhan. 2006 [李文静. 厚颌鲂的个体生物学和种群生态研究. 博士学位论文, 华中学业大业, 武汉. 2006]
[4] Gao X, Tan D Q, Liu H Z, et al. Exploitation status andconservation of a population of Megalobrama pellegrini inLongxi River in the upper Yangzer River Basin [J]. SichuanJournal of Zoology, 2009, 28(3): 329-333 [高欣, 谭德清,刘焕章, 等. 长江上游龙溪河厚颌鲂种群资源的利用现状和保护. 四川动物, 2009, 28(3): 329-333]
[5] Cao W X. The nature reserve construction for the endemicfishes in the upper Yangtze River and the related problems[J]. Resources and Environment in the Yangtze Basin, 2000,9(2): 131-132 [曹文宣. 长江上游特有鱼类自然保护区的建设及相关问题的思考. 长江流域资源与环境, 2000, 9(2):131-132]
[6] Liu J. A quantitative analysis on threat and priority ofconservation order of the endemic fishes in upper reaches ofthe Yangtze River [J]. China Environmental Science, 2004,24(4): 395-399 [刘军. 长江上游特有鱼类受威胁及优先保护顺序的定量分析. 中国环境科学, 2004, 24(4):395-399]
[7] Wang J W, Tan D Q, Li W J. Preliminary studies on artificialpropagation and embryonic development of Megalobramapellegrini [J]. Acta Hydrobiological Sinica, 2005, 29(2):130-133 [王剑伟, 谭德清, 李文静. 厚颌鲂人工繁殖初报及胚胎发育观察. 水生生物学报, 2005, 29(2): 130-133]
[8] Liu H Z, Wang Y P. Studies on genetic structure and nullallele in a natural population of Megalobrama pellegrini [J].Acta Hydrobiological Sinica, 1997, 21(2): 194-196 [刘焕章, 汪亚平. 厚颌鲂种群遗传结构及哑基因问题. 水生生物学报, 1997, 21(2): 194-196]
细鳞鲑(Brachymystaxlenok)隶属于鲑形目鲑科鲑亚科。在我国主要分布在东北地区黑龙江流域、绥芬河、图们江、鸭绿江,新疆的额尔齐斯河,河北省北部白河及滦河上游以及秦岭北麓渭河流域。李思忠根据幽门盲囊、侧线鳞和最小性成熟年龄等形态学和生理学特征,...