
随着人们对农业生产中长期、过量施用化肥所引起的诸如土壤板结、肥力下降、面源污染和pH值降低等农业生态环境问题的关注,微生物菌肥作为改善土壤营养状况和提高植物抗逆性的作用越来越受到重视.
微生物菌肥是由一种或数种有益微生物经发酵而成的无毒害绿色生物性肥料.它通过施用于土壤后,菌肥中的微生物的生长可以矿化土壤有机养分,释放土壤闭蓄态无机养分,从而改良土壤结构和提高土壤肥力,因此微生物肥料的施用改善植物的营养条件,协助农作物吸收养分,提高植物的抗逆性.
近年来,随着生物技术的不断发展,微生物肥料的研究与应用有了很大进展,但我国目前微生物肥料、生物添加剂市场种类繁多,由于气候条件、地理环境和植株种类的不同,菌肥的施用效果差异很大.
虽然近年来我国建立起了一些规范对微生物肥料市场的法规和标准,但缺乏利用分子生物学技术来科学评价、有效监测菌肥施用效果.西藏地处我国西南边陲,素以“世界屋脊”和“地球第三极”着称.藏东南地区由于受高寒低温等极端环境胁迫的影响,土壤微生物活性下降.
土壤养分矿化能力和速率也随之降低,导致土壤较贫瘠.在海拔高度4 200m以上的农田中,青稞是唯一种植的作物,是藏族群众的基本口粮来源,也是西藏地区最具特色的原料作物.因此用微生物菌肥改善当地土壤肥力条件,提高青稞的产量和质量,是维持当地经济社会健康发展的重要保障.
目前有关外来微生物菌剂对根际微生态的研究主要集中在解磷解钾菌、固氮菌及其他PGPR促生菌方面,且大多是采用传统方法,如菌落计数法等,来研究对土壤和植物的施用效果.
变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)技术可快速从土壤中提取微生物DNA片段,揭示所研究土壤的微生物群落结构特征,该技术在分析外源物质对土壤细菌群落多样性的影响和种群动态监测方面得到广泛使用.
本研究以西藏地区广泛存在的棕色沙壤土为研究对象,在施用微生物菌肥后采用PCR-DGGE技术检测微生物菌肥对土壤微生态中细菌群落多样性的影响,研究微生物菌肥对西藏土壤微生物的影响,以期探讨微生物肥料的作用机理,并初步探究采用综合分析指标评价微生物肥料肥效的可行性.
1 材料与方法
1.1 试验地概况
试验地为西藏自治区农业研究所4号试验地,位于西藏自治区东南部拉萨市雅鲁藏布江支流拉萨河中游,主要地貌为河谷平原,91°02′E,29°38′N,属高原山地气候,海拔3 650m,年均温7.4 ℃,年降雨量500mm,降雨集中于6,7,8,9月份,多夜雨.
1.2 试验材料
供试青稞品种为藏青320,由西藏自治区农业研究所制种.供试土壤为河谷农区棕色砂壤土,基础理化性质:全氮0.98g/kg、全磷1.72g/kg、全钾5.49g/kg、碱解氮113.05mg/kg、有效磷17.86mg/kg、速效钾31.63mg/kg、有机质13.58mg/kg、pH值7.72.供试菌剂为谷特菌肥,购买自禾康肥料有限公司,菌肥配置方法为砂糖100g,黄豆粉100g,谷特菌0.25g,1000mL水.
1.3 试验设计
试验设12个处理,小区面积50m2,3次重复,施肥方式为化肥+菌肥,分根施(播种前将菌肥稀释后直接施于土壤中)和叶面喷施(三叶期后将菌肥稀释后均匀喷洒到青稞叶面上)两种.
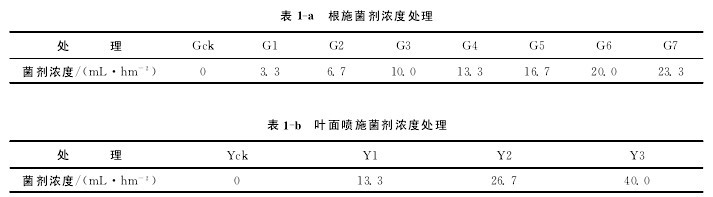
化肥的施用量为磷酸二铵0.5kg/hm2,尿素0.33kg/hm2,氯化钾0.1kg/hm2,各处理间化肥施用量保持一致,不同处理的谷特菌肥的施用量见表1-a,b.种植时间为2011年5月初,种植期间施肥、灌溉、中耕除草等统一管理.【表1】
青稞收获后,在试验小区内用土钻“S”形随机选择5个点,采样深度为0~20cm,除去可见动植物残体及小石块后混匀.用于测定土壤微生物量的土壤样品保存在4 ℃冰箱中.用于PCR-DGGE分析的样品迅速冻存于-20℃冰箱,以进行分子生物学实验.
1.4 测定项目及方法
1.4.1 土壤中可培养真菌、放线菌数量及微生物量氮的测定土壤中可培养真菌及放线菌的分离和数量测定采用稀释平板法,培养基分别为葡萄糖酵母膏培养基及高氏1号培养基.微生物量氮测定采用氯仿熏蒸提取法.
1.4.2 细菌基因组 DNA 的提取及PCR扩增
1)称取0.5g土样,用OMEGA公司E.Z.N.A Soil DNA Kit D5625-01提取DNA,得到的DNA用1%琼脂糖电泳检测,并用紫外分光光度计测定其浓度和纯度.由于土壤中含有腐殖酸,影响DNA的扩增,本研究采用稀释20倍的土壤DNA进行扩增.
2)将基因组DNA作为PCR的模板,采用细菌16SrRNA的V3区特异性引物对F338-GC和R518进行PCR扩增.它们的序列分别为338F-GC(5-GC-clamp-ACT CCT ACG GGA GGC AGC AG -3)和518R(5-ATT ACC GCG GCT GCT GG-3).GC夹序列为:CGC CCG CCG CGC GCG GCG GGC GGGGCG GGG GCA CGG GGG G)(由英潍捷基(上海)贸易有限公司合成),扩增产物片段长约200bp.
3)50μL PCR反应体系组成如下:TakaRaTaq(5U/μL)0.25μL、10×PCR Buffer(Mg2+)5μL、MgCl2(25mmol/L)3μL、dNTP Mixture(各2.5mmol/L)4μL、模板为20倍稀释的总DNA(100μg/mL)2μL、引物1(20μL)1μL、引物2(20μL)1μL,无菌纯水补齐到50μL.
4)PCR反应条件:采用普通PCR,即预变性95℃3min,32个PCR循环为94℃30s,53℃30s和72℃30s,最后在72℃下延伸10min.PCR反应的产物用1.8%琼脂糖电泳检测.
1.4.3 PCR反应产物的变性梯度凝胶电泳(DGGE)分析采用Bio-Rad公司DcodeT M的基因突变检测系统对PCR反应产物进行分离.
1)双梯度变性胶的制备:使用梯度混合装置,制备8%的聚丙烯酰胺凝胶,变性剂浓度从35%(16.8gurea;16mL formamide/100mL Denaturant)到60%(25.2g urea;24mL formamide/100mL Denatur-ant),其中变性剂和丙烯酰胺的浓度从胶的上方向下方依次递增.
2)PCR样品的加样:待变性梯度胶完全凝固后,将胶板放入装有电泳缓冲液的电泳槽中,取PCR样品30μL和6*loading buffer混合后加入上样孔.
3)电泳、染色及拍照在70V的电压下,60℃电泳14h.电泳结束后,将凝胶进行SYBR Green I避光染色后拍照.
1.4.4 特征条带的回收与测序将DGGE凝胶上不同处理的优势条带用无菌、洁净的刀片切下,放入1.5mL灭菌的离心管中,加入50μL去离子水,于4℃浸泡过夜.
次日,取1μL上清液为模板,以不加GC夹的引物,按照1.3.4中的PCR反应体系和程序再次扩增,扩增产物进行1%琼脂糖凝胶电泳,利用Biospin胶回收试剂盒回收目的条带.
胶回收产物经pMD20-T载体连接,转化E.coliDH5α感受态细胞,在含氨苄青霉素、IPTG和X-gal的LB培养基上选择白色克隆子,采用T载体通用引物进行菌落PCR检测,将菌液送至上海英骏生物技术有限公司测序.
1.5 数据分析
1)土壤理化性质数据采用Excel2007进行标准化处理,应用SPSS 17.0软件对试验数据进行方差分析,5%水平下LSD多重比较各处理平均值之间的差异显着性.
2)用Bio-Rad公司的凝胶定量软件Quantity One 4.6.2分析DGGE指纹图谱中微生物群落结构,计算土壤中细菌的Shannon多样性指数(H)、丰富度(S)和聚类分析,其中聚类分析用UPGMA方法.【1】
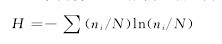
式中:H表示Shannon-Weiner多样性指数;ni是菌种i条带的亮度;N是该泳道中所有条带的总亮度.H值越大代表的物种多样性越高.S表示物种种数.采用NCBI数据库进行Blast分析,采用MEGA 4.0中的NEIGHBOR-JOINING程序进行细菌聚类分析并构建系统进化树.
2 结果与分析
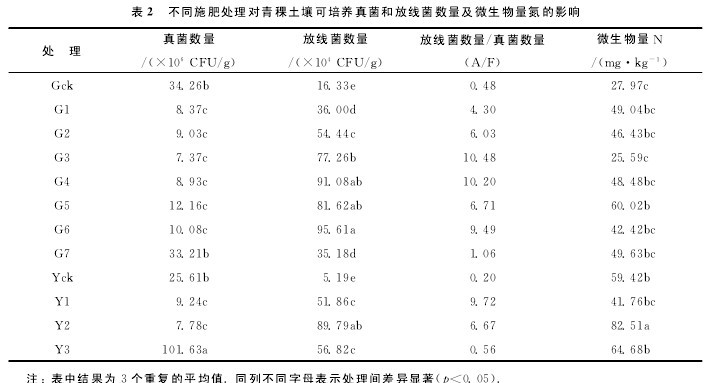
2.1 菌肥对土壤中可培养真菌、放线菌数量及微生物量氮的影响土壤中可培养放线菌与真菌数量以及两者之间的比例是反映土壤微生物区系的常用指标.
从表2可以看出,分别施入不同量菌肥,除G7和Y3(即根施23.3mL/hm2和叶面喷施40.0mL/hm2,分别是两种施肥方式的最高施肥量处理)外,与对照相比,施肥处理显着降低了土壤中的真菌数量(p<0.05),显着增加了土壤中的放线菌数量(p<0.05).
例如,根施菌肥处理土壤放线菌数量较对照分别提高的幅度为115.43%~485.49%,其中根施23.3mL/hm2提高幅度最低,根施20.0mL/hm2处理最高;叶施菌肥处理土壤放线菌数量较对照增长率分别为899.23%,1630.06%和994.80%,以叶施26.7mL/hm2提高最多;谷特菌肥包括的有益微生物主要是放线菌.
上述结果表明施用微生物菌肥可以在很大程度上改变土壤微生物区系.
根施和叶面喷施放线菌增加最多的处理并不是施肥量最多的处理,而是仅次于最高施肥量的处理,这可能是由于在相同土壤条件下,过量菌肥微生物的施入导致营养不足,无法满足施入微生物的繁殖需求.
施用菌肥青稞根际土壤中A/F值较对照增加,最大值出现在根施菌肥量10.0mL/hm2和13.3mL/hm2处理,根施A/F值整体上大于叶面喷施.
土壤微生物量是土壤有机库中的活性部分,是土壤生态系统肥力的重要生物学指标.施肥处理土壤微生物量氮整体上较对照高,根施菌肥量16.7mL/hm2和叶施菌肥量26.7mL/hm2微生物量氮含量较对照分别提高114.59%和38.86%.同时表明根施对土壤微生物区系的影响高于叶面喷施.【表2】
2.2 土壤细菌的DGGE图谱分析
2.2.1 基因组 DNA 的PCR扩增
在进行了土壤养分和微生物指标分析后,本研究试图从分子生物学角度深入地了解菌肥对土壤细菌生物多样性的影响.以等量的基因组DNA为摸板,以细菌的16SrDNA的V3区通用引物(338F-GC/518R)对每一样品的基因组DNA进行体外扩增,结果显示所用样品均扩增出单一的目的条带,得到的目的片段长度约200bp左右,是16SrDNA V3区的特异性片段,可以用于后续的环境样本多样性分析.
2.2.2 根施和叶面喷施不同菌肥施用量土壤细菌的遗传变异
土壤中细菌群落DGGE结果如图1所示.不同菌肥施用方式以及不同施用浓度的土壤样品的带型和条带数目有一定差别.各处理的条带数目、部分特异条带的宽度与着色深度比较,大致表现出根施高于叶面喷施的趋势,且根施对照Gck高于根施其他处理、叶面喷施对照Yck高于叶面喷施其他处理,说明菌肥的施用的确对根际微生态产生了影响,且根施和叶面喷施两种方式对土壤表层细菌数量和群落结构的影响存在差异.条带1,2,13和15存在于所有处理土壤中,且条带亮度较高,表明该条带所代表的微生物是土着种类和优势菌种,对环境有很好的适应性.
条带3,6,8,10,11和14来自土着细菌,菌肥施用量3.3mL/hm2时它们的灰度已明显降低,随菌肥施用量的增加逐渐减弱或消失,表明菌肥中以放线菌为主的微生物影响了这些条带所代表的土着细菌的存活.
条带4首次出现在对照Gck中,随着菌肥施用量的增加条带4消失,但菌肥施用量达到23.3mL/hm2时条带4又再次出现,表明该微生物为土着细菌,来自菌肥的放线菌大量滋生时抑制了该菌的存活,23.3mL/hm2施菌肥处理放线菌较对照增量最低,条带4细菌得以滋生;条带16存在于菌肥施用量3.3~13.3mL/hm2之间,表明该微生物来自菌肥;条带5,7和9为叶面喷施处理独有,在喷施浓度为26.7mL/hm2时出现,该处理也是叶面喷施处理中放线菌增加最多处理,表明该浓度下菌肥微生物得到较充分的繁殖条件.
2.2.3 不同处理对根际细菌群落结构多样性的影响和聚类分析
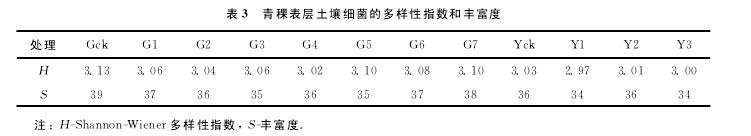
根施和叶面喷施不同浓度菌肥处理的细菌群落结构多样性指数(H)和条带丰富度(S)如表3所示.在两种施用方式中,H和S均表现为根施高于叶面喷施.
根施处理中,对照Gck的DNA条带数量最多,条带亮度最高(如条带6和条带8),且Shannon多样性指数最高.
随着菌肥浓度的增加至13.3mL/hm2,条带信号强度、多样性逐渐下降,如Gck多样性指数比G2,G4的分别高3.0%和3.6%.但当浓度升高至23.3mL/hm2(G7)时,其条带数量和多样性增加,与对照Gck的相当.该结果与土壤放线菌和真菌数量结果相似,即来自菌肥的放线菌大量滋生抑制土壤细菌多样性.叶面喷施处理中,处理与对照的条带数量和多样性处理间差异不大.【表3】
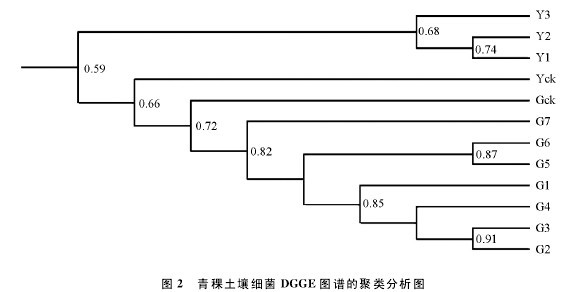
为进一步了解不同施肥方式和施肥浓度对土壤细菌群落结构的影响,用UPGMA法进行聚类分析,结果如图2所示.两种施用方式土壤细菌DGGE图谱明显地分为两大族群,7个根施处理聚为一簇,组间相似度最低为0.82,并进一步和对照Gck聚为一簇.其中特别是G2和G3处理,相似性系数高达0.91.叶面喷施的Y1,Y2和Y3聚为一簇,处理组与对照间差异较大.说明菌肥的施肥方式对土壤细菌群落结构的影响大于菌肥施用量对其的影响.【图2】
2.2.4 序列测定和分析
根据DGGE指纹图谱将各处理中共16条特征条带切胶回收,其中条带16未成功克隆,因此共获得15条序列,在其他研究中也有类似现象发生.
如图2所示,将15条带的16SrDNA进行序列测定,获得的序列通过NCBI数据库的BLAST程序与GenBank数据库中已报道的16SrDNA序列进行相似性比对分析.
结果表明,15条所测序列的最相似序列有4条来自GenBank数据库中未培养的微生物克隆,其余的来自可培养微生物(表4),所测序列与数据库中的16SrDNA序列拥有较高的相似性(≥97%).用这些序列与本实验所得的序列构建进化树,结果如图4所示.
系统进化树显示,15个克隆分属5个门:变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、厚壁菌门(Firmicutes)和酸杆菌门(Acidobacteria).其中变形细菌、蓝细菌和厚壁菌是优势菌,且是土壤中普遍存在的菌群.部分放线菌来源于菌肥,如条带5和条带9.
根施方式中,与对照相比,菌肥的施用对酸杆菌(Acidobacteria,条带10)、放线菌(Actinobacteria,条带12)和芽胞杆 菌 (Bacillus,条 带13)等 土 着 菌 的 生 长 产 生 了 促 进 作 用.菌 肥 对 土 着 的 芽 单 胞 菌 属 (Blasto-monasstrain,条带3)、不可培养的根瘤菌属(Uncultured Rhizobium,条带4)和蓝细菌(Cyanobacterium,条带6)表现出抑制作用,其中条带4在菌肥施用量为23.3mL/hm2时才再次出现.
根瘤菌属菌株具有固氮作用,可以增加土壤含氮量.叶面喷施方式中,与对照相比,处理Y2引入了放线菌(Actinobacte-ria,条带5和条带9)以及变形菌(Proteobacteria,条带7),喷施浓度为26.7mL/hm2有利于这3种菌的生长.
3 讨论
本文采用了传统的纯培养方法结合DGGE技术,研究了菌肥对青稞种植土壤中微生物群落的动态变化.一些能够分泌抗生素的土壤微生物能够影响植物根际微生物群体的数量和组成.薛泉宏研究组运用传统纯培养方法研究用放线菌制剂处理人参、西瓜等,发现土壤中放线菌的数量和比例显着增加,真菌的数量和比例减少.Khaled A.等研究发现非链霉素放线菌同样可以抑制土壤中真菌的生长,促进植物的生长.
本研究中,施用菌肥后,土壤中放线菌数量显着增加,增加幅度先快后慢;真菌数量显着降低,且真菌降低速度先快后慢,反映了谷特菌肥中放线菌与土壤真菌的拮抗和竞争营养的关系.PCR-DGGE技术是研究环境样品非(难)培养微生物的有效方法.国内外的研究表明,施加外源微生物菌剂可以改变植物根际土着微生物类群.
本研究DGGE图谱分析表明,施入适宜量菌肥施入后,菌肥微生物能够利用土壤有机无机养分迅速繁殖,本研究谷特菌肥为放线菌剂,菌肥中的放线菌产生抗生素及其竞争养分的能力抑制了真菌和细菌的生长繁殖,因而降低了土壤细菌的多样性.过量菌肥施入后,土壤有限的养分不再满足菌肥微生物大量生长的需要,表现为青稞土壤细菌的多样性缓慢升高,放线菌菌数量增加有限.所以本研究充分说明菌肥的施用量必须适宜,过多除造成不要的浪费,还影响其对土壤微生物的区系效果的发挥.所以使用DGGE测定土壤细菌多样性可以准确反映菌肥微生物繁殖和发挥作用的状况.
本研究中,根施最佳菌肥施用量为20.0mL/hm2(G6处理),G6处理的放线菌数量、A/F、微生物量氮和香农多样性指数均处于较高水平,叶面喷施最佳菌肥施用量为26.7mL/hm2(Y2处理),其放线菌数量和微生物量氮均显着高于其他处理.不同施肥方式对土壤微生物的影响不同,会导致土壤微生物多样性的系统变化,根施和叶面喷施两种施肥方式对土壤微生物的影响不同,大体表现为根施高于叶面喷施.
放线菌数量和A/F最大值均出现在根施处理,且根施处理对微生物量氮的提高率是叶面喷施处理的2.95倍,根施的着色深度及亮度明显高于叶面喷施,两种施肥方式的表层土壤Shannon多样性指数和丰富度指数也表现为根施高于叶面喷施.传统实验室培养鉴定的微生物种类数量不到其总数的1%.与传统方法相比,DGGE技术简单、快速、准确,避开了传统方法中微生物的富集培养,可以对复杂环境进行实时监测.
目前对西藏土壤微生物群落的研究还处于起步阶段.在常规土壤养分、土壤微生物分析结果的基础上,运用PCR-DGGE技术可以从微生物的角度揭示其多样性,进而准确揭示菌肥对青稞种植土壤微生态的影响.
参考文献:
[1] 黄国勤,王兴祥,钱海燕,等.施用化肥对农业生态环境的负面影响及对策 [J].生态环境,2004,13(4):196-200.
[2] 夏立江,王宏康.土壤污染及其防治 [M].上海:华东理工大学出版社,2001:7.
[3] 张喜林,周宝库,孙磊,等.长期施用化肥和有机肥料对黑土酸度的影响 [J].土壤通报,2008,39(5):1221-1223.
[4] 梁如玉,傅淡如,李登煜.水稻施用几种菌肥的根际效应和增产效果 [J].土壤肥料,1994,(3):31-33.
[5] 吴建峰,林先贵.我国微生物肥料研究现状及发展趋势 [J].土壤,2002,(2):68-72.
1我国土壤分类发展的主要阶段1.1古代朴素的土壤分类阶段我国的国土面积大,气候和自然条件都比较复杂,由于地区差异等原因,造成了土壤种类较多,早在公元前二、三世纪的《禹贡》中按土色、质地和水文等,将九州土壤分为白壤、黑坟、赤埴、涂泥等.而在《管子...
硝化和反硝化是土壤中氮素损失的潜在途径.随着人类活动的加剧,土壤中的硝化和反硝化作用会向大气中释放更多的温室气体氧化亚氮.由人为活动所产生的氧化亚氮中,耕地土壤的释放量贡献了65%左右[1].反硝化作用(denitrification)是指把硝酸盐等较复杂的含氮...
全球陆地生态系统0~100cm土层土壤有机碳(SOC)储量约为1462~1548Gt,分别是大气碳库和陆地生物量碳库的2~3倍。其中,湿地生态系统SOC库约占20%以上,是极为重要的碳汇和碳源。高海拔或高纬寒区生态系统是生态响应敏感区,而寒区湿地生态系...
1寿县耕层土壤养分现状据寿县土肥站资料,寿县自全国第二次土壤普查以后的20多年间,随着农作物种植制度不断变革,化肥的大量投入尤其是氮肥的施用量提高,土壤养分状况发生了较大变化.1.1有机质含量显着提高各乡镇耕层土壤有机质含量在0.98%~2.00%,各土...
土壤盐渍化是干旱、半干旱地区主要的土地退化问题之一[1-2],造成了农作物产量下降、区域生态环境改变.准确地获取土壤盐渍化盐分信息,对于干旱区盐渍土治理和利用,促进干旱区农业可持续发展具有重要意义[3-4].国内外在盐渍化土壤探测技术的研究中,对可见光...
土地利用方式是人类利用土地各种活动的综合反映,包括农业、林业、居住地、草地、湿地和果园等,又是影响土壤养分变化最直接、最深刻、最普遍的因素[1-2].土壤养分是土壤的基本属性,是植物群落的重要环境因子,在农业生产和科学研究中占重要地位...
引言精准农业是现代农业发展的新方向,其基本涵义是根据作物生长的土壤性状,调节对作物的投入。故实时、快速、准确地获取土壤养分空间分布信息,对精准农业中的变量施肥具有重要意义。遥感技术实时、快速、无损观测的特点为精准农业提供新的信息获取途径,目前...
红花檵木(Loropetalumchinensevar.Rubrum)花叶俱美,抗寒、耐旱、易修剪、耐贫瘠,是广泛应用于绿地花坛、隔离带等的色块造型材料和庭院及盆栽观赏植物。西洋杜鹃(Rhododendronsp)属酸性花卉,开花期长,花色鲜艳,富于变化,是园林绿化和美化的当家品种。在园...
在国土资源地质大调查中,生态地球化学评价得到了足够重视,大批量样品的测试对实验室带来了巨大挑战和压力。土壤中元素有效态是生态地球化学评价的重要内容之一,其分析大多按照相应的国家、行业或地方标准进行。但在实际工作中发现有些方法测试效率低,结...
0引言土壤中含碳量(总含碳量、有机碳含量、无机碳含量)的鉴定是土壤化学性质鉴定的一个重要环节,对分析土壤常规特性、了解土壤矿物元素的含量、确定盐渍化土壤碱化程度等都存在重要意义。同时,碳含量的测定结果可为其他检测项目提供详细参考数据,因此...