8.蛋白样品的透析:将需要透析的样品装入截流分子量为14 000的透析袋中,袋两端用封口夹封闭后浸没于透析液(ddH2O或上样缓冲液)中,磁力搅拌,每0.5h更换1次透析液,重复3次。
9.蛋白样品的浓缩:将透析处理后的样品连同透析袋包埋于PEG-20000中,浓缩样品至所需体积后回收样品。
结果
一、Bradford法绘制BSA标准曲线
根据标准的OD570值绘制出BSA标准曲线,求得R2=0.985,公式为y=0.0772x+0.8493.BSA标 准 品 的OD570值 分 别 为:0.849、1.103、1.158、1.313、1.497、1.621、1.776、1.830μg/μl.【1】

二、3种去除卵泡液中的高丰度蛋白方法 的比较
按标准蛋白曲线回归方程计算出原样品的蛋白总量为37mg,经3种方法处理后样品的蛋白总量分别为22.5mg、17.1mg、32.8mg.结果表明,样品经丙酮、乙醇、乙腈处理后分别可清除60.9%、46.3%、88.7%的高丰度蛋白,即乙腈法处理卵泡原液去除高丰度蛋白是最优的方法。(图2).
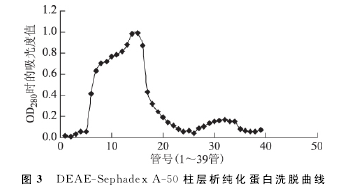
三、DEAE-Sephadex A-50柱层析纯化蛋白结果
DEAE-Sephadex A-50柱层析纯化蛋白共收集39管蛋白,从洗脱曲线可看出,洗脱峰出现在第14管和第15管(图3).【2】
四、Rotofor System蛋 白 分 离 及 等 电 点 鉴 定结果
对Rotofor System所收集的20管样品处理后用Inhibin B Gen II ELISA kit检测每管中INH-B的浓度,其中第3和第4管INH-B的浓度分别为590pg/ml和750pg/ml,蛋白质等电点(isoelectricpoint,pI)分离法测得第3和第4管pI值分别为4.5和4.6.由此可推断出卵泡液中INH-B的pI在4.55左右(表1).
五、目的蛋白INH-B的回收率
采用Inhibn B Gen II ELISA kit试剂盒绘制INH-B浓度测定标准曲线,INH-B标准品的浓度分别为0、10、30、100、250、500、1 000pg/ml,其对应OD450值 依 次 为0、0.051、0.142、0.503、1.192、2.085、3.179. 其 中R2=0.9718,公 式 为y=298.95x-35.445(图4).
以100ml原始卵泡液为初始样品,样品中总INH-B的含量为17.3μg.经乙腈、DEAE-Sepha-dex A-50柱层析、Rotofor System蛋白分离3次处理,依次编号为1、2、3,各步样品中INH-B的含量分别为10.7、8.9、6.7μg,经过3次纯化后回收率为38.70%(表2).
讨论
女性体内INH-B由卵巢中、小窦卵泡颗粒细胞产生,具有反馈性抑制垂体FSH分泌和调节生殖细胞发育的 重要功 能,可直接反映卵巢储备功能。
INH-B的监测在女性生殖及辅助生殖技术中的应用有重要意义[10].男性体内INH-B是直接由睾丸分泌的二聚体糖蛋 白 激 素,对 多 种 外 源 性 激 素 起 反 应。血 清INH-B水平受年龄、睾丸体积、青春期发生时间、标本采集时间、不同人群等多种因素影响。
INH-B能直接反映睾丸的精子发生,可作为临床评价男性生育力的重要指标[11-12].睾丸穿刺活检是诊断无精子症的“金标准”,但血液中INH-B水平检测作为部分替代和补充,可作为睾丸生精障碍的间接诊断依据,但这一依据的准确性依然存在争议[13-14].因此,随着生殖医学的发展,直接以精液为研究、检测材料的方法引起人们的兴趣。
现有的文献中,最新的对于血液中INH-B存在形式的研究已经很完整[15],而对于男性精液和女性卵泡液中INH-B的存在形式及其理化特性的相关研究基本上是空白。由于受到材料的限制,以往对于INH-B纯化方法的研究,多取材于动物,如猪卵泡液[9]等。本实验则使用人卵泡液为实验材料,利用INH-B本身的生化 性质,通过乙腈富集、阴离子交换柱分离、等电点分离的“三步分离法”,初步纯化获得人体卵泡液中天然INH-B蛋白分子粗制品,纯化回收率达38.70%,并准确鉴定出其在人体中的等电点为4.55左右,为近一步研究人体INH-B的功能和结构特征打下基础,可能为临床诊断产 品的开发提供了新的思 路 和 理 论依据。