材料热力学论文教授推荐8篇之第八篇:镁碳复合储氢材料70Mg30C的放氢热力学分析
摘要:在氢气气氛下用反应球磨法制备了镁碳复合储氢材料70Mg30C,用透射电子显微镜(TEM)和选区电子衍射(SAED)观测了材料的微观形貌和晶态特征,用X射线衍射仪(XRD)分析了其物相组成,并通过材料放氢的p-c-T曲线得到的放氢平台压强以及Van't Hoff方程计算了材料放氢的焓变和熵变。结果表明:材料的主相是MgH2,并混有少量的Fe和MgO;在一定范围内,延长球磨时间可使材料的粒径进一步减小,并可增加非晶纳米晶在材料中的含量,而且可降低材料的放氢平台压强和材料放氢时的焓变,从而降低材料的相结构稳定性,增强体系的解氢能力,最终改善材料的放氢性能;在300~380℃范围内,lnpH2与1/T基本呈线性关系,同时材料具有较长的放氢平台和较高的放氢量。
关键词:储氢材料; 热力学; 放氢反应; p-c-T曲线;
Abstract:
Mg/C composites 70Mg30 Cfor hydrogen storage were prepared by reactive ball milling method under hydrogen atmosphere.The microstructure and crystalline characteristics of materials were investigated by transmission electron microscopy(TEM)and selected area electron diffraction(SAED),the phase composition of materials were analyzed by X ray diffracmeter(XRD)。The enthalpy change and entropy change during the dehydrogenation process were calculated by Van't Hoff equation and dehydrogenation equilibrium pressure acquired from dehydrogenation p-c-T curves.The experimental results show that MgH2 is the main phase,and small amount of Fe and MgO were also found in the materials.The particle size of materials was became smaller by more ball milling time in a certain range,and the content of amorphousnanocrystalline in the materials was increased.The dehydrogenation equilibrium pressure and enthalpy change of materials were also decreased,thus the phase structural stability of materials was reduced and the dehydrogenation ability of system was improved.As a result,dehydrogenation performance of materials was improved.The experimental results also showed that the relationship between lnpH2 and 1/T was approximate linear,and the materials had a longer dehydrogenation platform and a higher dehydrogenation amount between 300℃and 380℃。
Keyword:
hydrogen storage material; thermodynamics; dehydrogenation; p-c-Tcurve;

氢是一种高热值的绿色能源,其高效利用需要解决2个问题:制氢工艺和储氢方法。传统的高压钢瓶储氢存在储氢密度小、安全性差等缺点,将氢气转化为液态氢则需耗费大量的热量,且隔热要求极高,而利用储氢材料储氢很好弥补了传统储氢方法的不足,被证明是实现氢能高效利用的切实可行的方法[1-3].
在众多的储氢材料中,金属镁由于赋存量大、储氢密度高、成本低,成为目前该领域的研究热点[4],但其放氢热力学和动力学性能差,在一定程度限制了其应用。研究热力学是要解决反应的方向、限度或平衡问题,也就是说反应能够发生的条件是什么。笔者在前期的研究中发现,在镁中添加碳(经碳化处理的无烟煤)可显著改善其热力学性能[5].本研究通过观测储氢材料的微观结构、分析放氢p-c-T曲线、计算放氢过程的焓变和熵变研究了材料的放氢热力学,特别对材料制备过程中的球磨时间和材料放氢过程中的放氢温度2个参数对放氢热力学的影响进行了研究。
1实验部分
在氢气气氛下用反应球磨法制备镁碳复合储氢材料。将镁粉[99.5%(wt,质量分数,下同)]和经1500℃高温碳化的无烟煤按70∶30的质量比均匀混合后,放入球磨罐,在300r/min的转速下,分别球磨3h和10h,磨球与物料的质量比为45∶1, 初始充入氢气的压强为1MPa,为保证氢气过量,每球磨0.5h充氢1次。为避免材料氧化和吸水,在氩气气氛保护的手套箱中取料。
用透射电子显微镜(TEM,HITACHI H-800型)表征材料的微观形貌,加速电压75kV,束流20μA,并通过选区电子衍射(SAED)分析其晶形结构。 用X射线衍射仪(XRD) (D/MAX-rB型)测定储氢材料的物相组成,铜靶Kα射线,管电压40kV,管电流150mA.
用p-c-T特性测试仪测试储氢材料放氢的p-c-T曲线。 以步进降压法放氢,测定各步放氢量的累计值,最后绘制不同温度下放氢的p-c-T曲线。将2g球磨储氢制得的储氢材料放入测试仪,测量开始时,使反应器内的温度保持在指定的测量温度,待体系稳定后,从体系内放出少量氢气,并记录开始和达到平衡时的压强,以便计算储氢密度,然后再开始下次的测量,直至放氢结束。
2结果与讨论
2.1微观结构
图1所示为不同球磨时间下储氢材料70Mg30C的TEM和SAED照片。由图可见,经3h反应球磨储氢材料的粒径已达纳米级,呈现出典型的纳米晶结构,SAED照片也证实了这一结论。当球磨时间延长到10h,材料的粒径进一步减小, SAED照片显示纳米晶的衍射斑点逐渐变弱,出现了更为明显的非晶衍射环,这说明材料内部不仅存在纳米晶,而且还出现了一定量的非晶。

图1储氢材料70Mg30C的TEM和SAED照片
用X射线衍射仪(XRD)分别测定了不同球磨时间下储氢材料70Mg30C的物相组成,如图2所示。结果显示,随着球磨时间的增加,各物相衍射峰的强度均减弱,说明材料的晶化程度降低,非晶化程度增加,这与TEM和SAED所得结果一致。谱图中检测到的主相是MgH2,说明它是储氢主体;谱图中还检测到了MgO和Fe的衍射峰,MgO的出现是样品在做XRD检测时暴露于空气中氧化所致,Fe的出现则是不锈钢制磨球和球磨罐在长时间地与样品摩擦、碰撞过程中不可避免会使Fe混入其中所致。
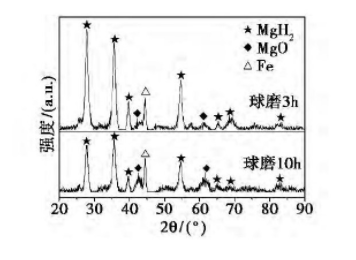
图2储氢材料70Mg30C的XRD谱图
2.2放氢p-c-T曲线
p-c-T曲线是衡量储氢材料吸放氢过程热力学性能的重要特性曲线,通过p-c-T曲线可以了解储氢材料中的氢含量和任一温度下的氢分解压强值[6].p-c-T曲线的平台压强、平台宽度与倾斜度、平台起始浓度和滞后效应是常规鉴定储氢材料吸放氢性能的主要指标,通过该曲线可以得到储氢材料的热力学参数[7].
图3、图4所示分别为球磨10h与球磨3h储氢材料70Mg30C在不同温度下放氢的p-c-T曲线。从图中可以看出,球磨10h材料的放氢平台长,具有较大的放氢量,为5.1%,在300、350和380℃ 时,放氢平台压强分别为0.20、 0.43和0.62MPa;而球磨3h的材料虽然也具有较长的放氢平台和较大的放氢量,但放氢平台压强有一定的升高,在300、 350和380℃ 下的放氢平台压强分别为0.21、0.50和0.73MPa.由此可见,增加球磨时间在一定程度上改善了储氢材料的放氢性能。这归因于增加球磨时间减小了储氢材料中MgH2的晶粒尺寸,增大了其比表面积,使其放氢的平衡压强降低;而晶粒尺寸比较大的材料则具有较高的平衡压强。 这一结果从理论上也可以得到较好地解释,因为材料的晶粒尺寸越小,比表面越大,说明材料具有比较高的表面能,更容易吸附氢,被吸附在材料表面的氢气更易发生化学分解,材料的表面状态也更趋稳定,所以材料吸放氢的平衡压强会更低[8].
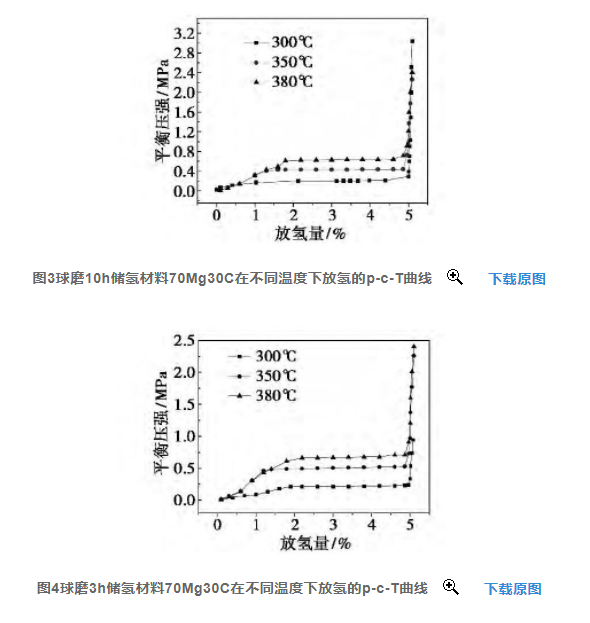
由图3和图4还可看出,相同球磨时间制得的储氢材料随着温度的升高,其放氢平台压强均升高。这主要是因为储氢材料的放氢反应是一个吸热过程,升高温度有利于材料的放氢,若要保持吸放氢的平衡,只能提高体系的氢气压强。此结论与Zeng等[9-12]整理的金属镁及镁基复合粉末的吸放氢平衡压与温度关系的试验数据相吻合。
2.3放氢焓变与熵变
取图3、图4中各温度下平台区的压强中值,作lnpH2~ 1/T关系图,即Van't Hoff曲线,如图5所示。 储氢材料70Mg30C的放氢焓变与熵变可分别通过lnpH2~1/T关系图的斜率与截距计算得到:
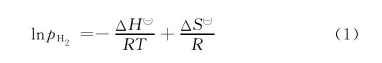
式(1)为氢化物的Van't Hoff方程[13],pH2为平台压强与1个标准大气压的比值,无量纲; 为氢化反应标准自由焓变,kJ/mol; 为氢化反应标准自由熵变,J/mol·K;R为气体常数,8.314J/mol·K,T为反应的热力学温度,K.由图可见,在300~380℃范围内,lnpH2与1/T基本呈线性关系,说明测试结果与Van't Hoff方程基本相符。
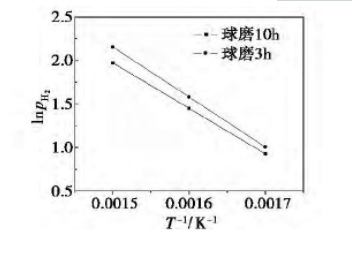
图5储氢材料70Mg30C的放氢Van't Hoff曲线
将球磨10h储氢材料70Mg30C的放氢p-c-T曲线在300、350和380℃下的平衡压强分别代入式(1),任意2个温度下可分别得到相应的焓变 ΔH和熵变 ΔS,再将所得到的焓变 ΔH和熵变 ΔS取平均值,即为在300~380℃范围内, 储氢材料70Mg30C最终的 ΔH和熵变 ΔS。经过计算得, ΔH=43.44kJ/mol,ΔS=81.58J/mol·K.用同样的方法对球磨3h储氢材料在300、350和380℃下放氢反应的焓变 ΔH和熵变 ΔS进行计算,所得结果为 ΔH=47.70kJ/mol, ΔS=89.46J/mol·K.可见,球磨10h储氢材料70Mg30C在发生放氢反应时的焓变更低。而实际应用的氢化物平衡压力大都在0.01~1MPa之间,选择氢化物的放氢 ΔH范围在29~46kJ/mol[14],说明球磨10h储氢材料70Mg30C更接近实际应用。在恒定温度下,氢化物焓变 ΔH的大小决定了放氢平台压的高低,ΔH越小,放氢平台压越低,则氢化物放氢越容易,因此,球磨10h储氢材料其相结构稳定性更差,体系解氢能力更强[15].这与2.2所得结果一致。作为储氢材料,其放氢反应的焓变是表征材料稳定性的一个重要参数,其焓变适当小一些有利于氢化物的形成与分解[16].
3结论
(1)利用反应球磨法制备镁碳复合储氢材料70Mg30C,对其微观结构研究表明,在一定范围内,延长球磨时间可使材料的粒径进一步减小,并可增加非晶纳米晶在材料中的含量;材料的主相是MgH2,并混有少量的Fe和MgO.
(2)储氢材料70Mg30C的放氢p-c-T曲线显示,材料的放氢平台长,具有较大的放氢量,在一定范围内,延长球磨时间可降低材料的放氢平台压强,改善材料的放氢性能;而相同球磨时间制得的储氢材料随着温度的升高,其放氢平台压强均升高。
(3)利用Van't Hoff曲线计算储氢材料70Mg30C的放氢焓变与熵变,结果表明,在300~380℃范围内,lnpH2与1/T基本呈线性关系,延长球磨时间可以降低材料放氢时的焓变,降低材料的相结构稳定性,增强体系的解氢能力。
点击查看>>材料热力学论文(推荐10篇)其他文章热力学第二定律是人类社会以及自然界中一个普遍适用的规律,主要体现的是不可逆性质,启示我们要尊重自然、顺应自然、不可以违背自然规律。...
工业是国民经济的耗能大户, 亦是节能的重点行业, 在我国, 至少50%的工业耗能以各种形式的余热被直接废弃, 这既造成能源浪费, 又造成环境热污染, 所以回收利用工业低品位热能具有重要的现实意义[1]....
熵(Entropy)既是一个古老的字眼,又是一个年青的概念。说它古老,是指它由德国物理学家克劳修斯首先提出至今,已有150多年历史;说它年青,是指它的内涵随时代变迁而依然日益丰富而充满活力。...
丙酮-异丙醇-丙烯可以互为原料与产品。丙烯与苯共氧化法生成异丙苯,再氧化后转化为丙酮,丙酮加氢可生成异丙醇,异丙醇脱氢可生成丙酮,丙烯直接水合可生成异丙醇,异丙醇脱水生成丙烯。...
油田蕴藏有丰富的超稠油资源,然而由于超稠油自身物性差、粘度高、凝固点低、胶质沥青质含量高,脱水非常困难,为实际生产、处理和运输造成了较大的难度。辽河油田超稠油处理站日处理原油采出液10000m左右,综合含水60%-70%,原油脱水温度为85℃,...
热力学第一定律论文经典范6篇之第六篇:热力学第一定律教学方法 摘要: 热力学第一定律在热学中占有重要的地位, 但内容多而散, 知识点高度密集。文章依据内容之间的相互关系, 对一般教材中的准静态过程、热力学第一定律、功、热量、内能等有关问题进行了...
目前大规模氢气制备过程中,所得产物含有一些使燃料电池电极催化剂中毒的气体,从而使燃料电池催化剂活性减弱、寿命缩短,这也成为制约清洁、高效燃料电池在实际推广应用中最主要的障碍之一。因此,从混合气体中分离出氢气,是获得高纯度氢气的一...
搞好节能,挖掘节能潜力需要我们了解能量损失的原因及分布、科学用能的基本原则、节能的方案对策等。热力学就是研究能量及其转换的科学,节能的理论基础就是热力学。...
铝铬耐火材料因具有优异的抗侵蚀性广泛应用于煤气化、有色金属冶金和还原炼铁等领域[1,2,3].深入研究熔渣侵蚀铝铬耐火材料反应过程及机理对材料设计及性能改进具有重要的意义...
我们在高中物理中学习热力学第二定律时, 对其适用范围进行过分析, 通过仔细的辨别, 我们可以发现其适用范围之间存在矛盾之处。于是, 我们可以认为热力学第二定律并不是普遍适用的, 对于这项定律, 我们需要进行再思考。...