
睡眠和觉醒过程不仅仅是某个神经核团的单独活动,而且是全脑众多神经核团的集体活动(网络活动)过程.研究[1 -2]结果表明,下丘脑腹外侧视前区(ventrolateral preoptic nucleus,VLPO)与结节乳头体核(tuberomammillary nucleus,TMN)分别是促睡眠中枢和促觉醒调节中枢之一.80% 的 VLPO 神经细胞为 γ-氨基丁酸(GABA)能神经细胞和甘丙肽能神经细胞,而 TMN 是脑中组胺能神经细胞胞体集中聚集的区域,这两个核团之间是否存在直接的双向纤维投射以及其递质释放对睡眠 - 觉醒节律的形成与维持起何作用是目前研究的热点.为了进一步证实 VLPO 和 TMN 核团是否存在双向纤维投射,该研究通过脑立体定位技术,在大鼠的 VLPO 和 TMN 脑区分别微量注射荧光探针 Fast DiO[3](一种可被纤维末梢吞噬,通过轴浆运输达到胞体的荧光探针),观察 TMN 和 VLPO 脑区神经细胞是否表达荧光.
1 材料与方法
1. 1 材料
1. 1. 1 实验动物 清洁级成年 SD 大鼠 32 只,雌雄不拘,体重 250 ~300 g,安徽医科大学实验动物中心提供.所有动物随机分组,对照组(12 只)(ACSF组,VLPO 与 TMN 均微量注射 ACSF),实验组(各10只):① TMN + ACSF&VLPO + DiO 组(TMN 内微量注射 ACSF 以及 VLPO 内微量注射 Fast DiO);②TMN + DiO&VLPO + ACSF 组( TMN 内微量注射 FastDiO 以及 VLPO 内微量注射 ACSF) .大鼠均置于室温 22 ~24 ℃,湿度维持 55% 以及 12 h 明/暗(光照08 ∶ 00 - 20 ∶ 00) 的通风环境中单独饲养,自由饮水与摄食,活动不受限制.
1. 1. 2 药品与剂量 细胞膜荧光探针 Fast DiO( Ex= 644 nm,Em = 663 nm,分子量:881. 72 ( 美国 LLC公司);戊巴比妥钠(中国医药集团上海化学试剂采购供应站分装厂进口分装提供),使用前用 ACSF 配置;ACSF 成分(mmol/L):124 NaCl,4. 5 KCl,1. 6NaH2PO4,2. 1 MgCl2,2. 7 CaCl2,26 NaHCO3,10Glucose(pH = 7. 4).
1. 1. 3 主要仪器 脑立体定位仪( 深圳瑞沃德公司);ZH-GSZ 高速颅骨钻(淮北正华公司);MODEL828 pH 计 ( 美 国 Orion 公司); 微量注射器 ( 瑞士Hamilton 公司); Leica 冰冻切片机 ( 德国 Leica 公司);荧光显微镜(日本 Nikon 公司).
1. 2 方法
1. 2. 1 动物手术 大鼠经戊巴比妥钠(50 mg /kg)腹腔注射麻醉后,将其头部固定于脑立体定位仪上,常规头部备皮,无菌手术操作暴露颅骨并用 0. 3%H2O2烧灼清洁颅骨表面,将两个不锈钢引导管(22-gauge)按照 Paxinos 和 Waston 大鼠脑立体定位图谱[4]分别插入 VLPO(AP: -0. 36 mm;R:1. 30 mm;H:- 7. 00 mm) 和 TMN(AP: - 3. 96 mm;R:1. 50mm;H:- 7. 70 mm),引导管底端距目的核团 2 mm,供 VLPO 和 TMN 内微量注射荧光探针使用.注射完毕后,逐层缝合,送回动物室,自由饮水进食.术后将大鼠置于记录室中休息,待麻醉苏醒后观察动物行为活动.
1. 2. 2 药物注射 使用 Hamilton 微量注射器( 针尖直径 26-gauge)通过引导管向目的核团注射 ACSF(对照组)或含荧光探针 ACSF(实验组)3μl,注射速度为 1 μl/min,注射完毕滞针 3 min 防止药液溢出.
1. 3 组织学鉴定 大鼠术后 72 h 后,行戊巴比妥钠(50 mg/kg)腹腔注射麻醉并仰卧位固定于手术台上,暴露心脏,从心尖处进行灌注,首先注入 0. 01mmol / L PBS 液,待肝脏颜色变淡,心耳处流出液清亮后更换为 4% 多聚甲醛,先快后慢继续灌注(PBS液用量约200 ml,多聚甲醛用量约250 ml).灌注结束后完整取下脑组织并 4% 多聚甲醛固定 24 h,次日使用 30%蔗糖 PB 溶液脱水至沉底.取各组大鼠的大脑的 TMN 和 VLPO 进行冰冻切片,片厚20 ~25μm,光学显微镜下观察引导管位置以及药物注射位点,仅对定位准确的大鼠进行实验数据的统计.共计 8 只大鼠因定位不准确予以剔除实验,其中对照组 4 只,实验组各 2 只.荧光显微下观察 Fast DiO标记的荧光效果并拍照.
2 结果
2. 1 神经损伤严重程度 ( neurological severity-score,NSS)评分 采用双盲法,在标志物注入脑室后 2 h 和 24 h 对各组大鼠进行 NSS 评分.麻醉良好的动物在注射过程中没有发生抽搐、呼吸紊乱等异常情况.术后 24 h 所有大鼠评分已基本正常.
2. 2 荧光显微镜观察荧光标记效果2. 2. 1 TMN + ACSF&VLPO + DiO 组 TMN +ACSF&VLPO + DiO 组在 VLPO 核团内注射荧光探针 Fast DiO 后 72 h,TMN 脑区可见明显的绿色荧光,荧光均匀存在于细胞质中,核未清晰显示,见图1.神经细胞的荧光强度相对强,成像清晰,对比度高,容易辨别.TMN 之外的区域鲜见绿色荧光标记,绿色荧光可持续到药物注射后 120 h.而 VLPO核团内注射 ASCF,TMN 脑区未见荧光(结果未显示).
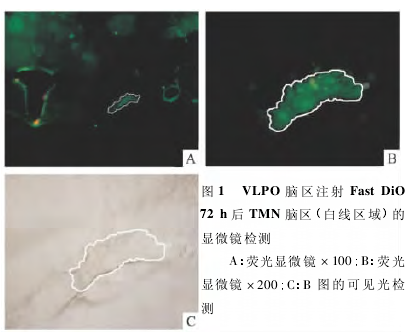
2. 2. 2 TMN + DiO&VLPO + ACSF 组 TMN +DiO&VLPO + ACSF 组在 TMN 核团内注射荧光探针Fast DiO 后 72 h,VLPO 脑区可见明显的绿色荧光,荧光均匀存在于细胞质中,核未清晰显示,神经细胞的荧光对比度高,容易辨认,但成像的密度较低,见图 2.而 TMN 核团内注射生理盐水,VLPO 脑区未见荧光(结果未显示).
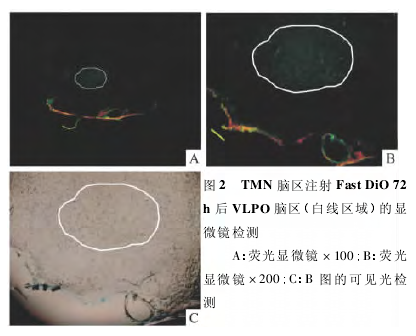
3 讨论
Saper et al[5]曾提出促睡眠神经细胞与促觉醒神经细胞相互抑制的假说,即 flip-flop 模型,其控制着睡眠觉醒之间的时相转换.VLPO 80% 的神经细胞是 GABA 能和甘丙肽能神经细胞,且向脑中与觉醒相关的众多区域发出纤维投射,调节睡眠 - 觉醒时相间的相互转换[6].下丘脑后部的 TMN 及其邻近区域含有组胺能神经细胞,是该神经细胞在中枢神经系统中聚集的唯一部位,其神经纤维以两条上行和一条下行通路广泛投射至全脑,其中以下丘脑核团,内侧隔核以及斜角带密度最高[7 -8].TMN 神经纤维直接向皮质进行投射的同时又间接地通过丘脑 - 皮质系统和基底前脑的胆碱能神经细胞共同激活皮质,维持觉醒,并同时接受 GABA 能抑制性纤维投射[7,9].
轴浆运输是神经细胞的特性之一.神经细胞不断地从胞体中将各种成分运输至轴突及其分支,也从支配的靶组织中摄取营养以维持其正常代谢,有效的轴浆运输必须依赖于完整的神经通路.细胞膜荧光探针 Fast DiO 是一种亲脂性荧光探针,可通过细胞膜进入纤维末梢,然后经过轴浆运输达到胞体的荧光探针.与膜结合或者与亲脂性生物分子结合时,其荧光强度显着增强.这种荧光探针可以被神经末梢吞噬,通过逆向轴浆运输到胞体,但是被吞噬后的荧光探针不能从细胞内释放出细胞[3],因此是研究中枢核团中是否存在直接投射的理想工具.
Sherin et al[10]发现 TMN 脑区有 GABA 能神经细胞末梢,推测此神经末梢来自 VLPO.本研究在 TMN脑区注射 Fast DiO 荧光探针后,在 VLPO 神经细胞内检测到绿色荧光信号,表明 VLPO 肯定有神经纤维投射至 TMN.另外,在 VLPO 脑区注射 Fast DiO荧光探针后,在 TMN 神经细胞内也能够检测绿色荧光信号,表明 TMN 也有神经纤维直接投射至 VLPO脑区.研究[11]显示 VLPO 神经细胞可通过抑制TMN 神经细胞的活动产生促睡眠效应.以上研究结果显示 VLPO 核团与 TMN 核团存在双向联系,进一步支持 Saper et al[5]提出的 flip-flop 模型假说.
参考文献
[1]Gervasoni D,Peyron C,Rampon C,et al. Role and origin of theGABAergic innervation of dorsal raphe serotonergic neurons[J].Neurosci,2000,20(11) : 4217 - 25.
[2] Ko E M,Estabrooke I V,McCarthy M,et al. Wake-related activ-ity of tuberomammillary neurons in rats[J]. Brain Res,2003,992(2):220 -6.
[3] Zaidi F N,Whitehead M C. Discrete innervation of murine tastebuds by peripheral taste neurons[J]. Neurosci,2006,26(32):8243 - 53.
[4] Paxins G,Watson C. The rat brain in stereotaxic coordinates[M]. San Diego:Academic Press,2007.
[5] Saper C B,Chou T C,Scammell T E. The sleep switch: hypotha-lamic control of sleep and wakefulness[J]. Trends Neurosci,2001,24(12):72631.
[6] Chou T C,Bjorkum A A,Gaus S E,et al. Afferents to the ventro-lateral preoptic nucleus[J]. J Neurosci,2002,22(3):97790.
[7] Brown R E,Stevens D R,Haas H L. The physiology of brain his-tamine[J]. Prog Neurobiol,2001,63(6):637 - 72.
[8] Haas H L,Panula P. The role of histamine and the tuberomammil-lary nucleus in the nervous system[J]. Nat Rev Neurosci,2003,4(2): 121 - 30.
[9]Liu Y W,Li J,Ye J H. Histamine regulates activities of neuronsin the ventrolateral preoptic nucleus[J]. J Physiol,2010,588(21):4103 - 16.
[10]Sherin J E,Elmquist J K,Torrealba F,et al. Innervation of hista-minergic tuberomammillary neurons by GABAergic and galaniner-gic neurons in the ventrolateral preoptic nucleus of the rat[J]. JNeurosci,1998,18(12):4705 - 21.
[11] 吴 芳,张 瑾,王烈成,等. 下丘脑腹外侧视前区通过抑制结节乳头体核对大鼠睡眠觉醒进行调控[J]. 中华行为医学与脑科学杂志,2014,22(2):97 -100.
引言鸟类鸣唱是一种复杂的发声行为,需要感知和运动技能学习等神经过程的参与。与人类语言学习的过程相似,鸟类鸣唱学习过程由脑中的一整套神经结构所控制,我们称之为鸣唱控制系统[1]。该系统由发声运动通路(vocalmotorpathway,VMP)和前端脑通路(ant...
动物生理学是一门研究动物体的机能、机能的发展变化及对环境条件所引起的反应的学科,侧重研究正常动物有机体机能活动或生命活动规律,在人才培养中起着承前启后的作用,是生命科学的核心[1,2].动物生理学注重培养学生科学实验的基本功,实验操作性很强,对...