摘 要: 随着人们对基因结构的了解加深,关于生命科学的研究也慢慢进入了后基因组时代,这也就是功能基因组时代。功能基因组顾名思义就是对基因的功能进行挖掘,中心法则中DNA会调控RNA的转录,RNA又会调控蛋白质的翻译,但实验结果表明RNA对蛋白质的翻译率并不是很高,而蛋白质又是生命活动最直接的执行体,因此对蛋白组学的研究将成为生物学研究的一个热点,将会为生命活动原理的解读带来重大的贡献。本文就通过对蛋白组学的相关论文进行总结,分析蛋白组学目前使用的研究方法,并对相关蛋白质的分离进行重点介绍。
关键词: 蛋白质组学; 研究方法; 蛋白质分离;
Abstract: With the deepening of people's understanding of gene structure, research on life sciences has gradually entered the postgenomic era, which is also the era of functional genomics. The functional genome, as its name implies, is to excavate the function of genes.In the central law, DNA regulates the transcription of RNA, and RNA regulates the translation of proteins. However, experimental results show that the translation rate of RNA to proteins is not very high, and proteins are the most direct executive body of life activities, so research on proteomics will become a hot spot in biological research, and it will bring significant contributions to the interpretation of the principle of life activity. This article summarizes the relevant papers on proteomics, analyzes the research methods currently used in proteomics, and focuses on the separation of related proteins.
Keyword: proteomics; research methods; protein separation;
0、 引言
蛋白质组是指一种细胞、组织乃至一种生物所表达的全部蛋白质。相较于传统的蛋白质研究,蛋白质组学可以在大规模水平上一次性鉴定成千上万种蛋白质的表达水平、修饰水平相互作用等,从而揭示蛋白质参与生命活动的作用。近几年来蛋白组学不断发展,蛋白组学在各个方面应用越来越广泛,如植物逆境蛋白组学在研究植物的生长、发育、代谢等生理活动规律;另外,蛋白组学也渐渐成为肿瘤研究中寻找标志物的有力手段,为肿瘤的致病机理研究及药物研究提供了新思路。蛋白组学也渐渐成为生命科学研究的最前沿领域。
1、 蛋白质的提取
为了更好地研究蛋白质,首先要做的就是从组织样本中获取较纯的蛋白样品。蛋白存在于组织细胞中,获得蛋白之前需要将组织细胞进行破碎,破碎细胞的方法包括石英砂研磨、超声波震碎、微波提取法、超临界萃取法、反复冻融法、高速组织捣碎、玻璃匀浆器匀浆、振荡珠击破碎法、高速搅拌珠研磨破碎法、渗透压冲击破碎法、酶溶破碎法、化学破碎法、去垢剂破碎法等。将蛋白从组织细胞中释放出来后就可以进行蛋白质组学研究的后续过程,包括蛋白纯化、鉴定等过程。
1.1、 蛋白质的沉淀
在将蛋白质从组织细胞中释放出来的同时还会在蛋白的提取液中混有其他的物质,为了更好的研究蛋白质,需要将蛋白质从复杂体系中纯化出来,首先考虑根据蛋白质的特性将其从复杂体系中沉淀下来,常用的蛋白质沉淀方法有盐析法和有机溶剂沉淀法。
1.2、 蛋白质的分离
蛋白质的分离在最开始是用一些简单的离心技术进行处理的,但仅利用物理方法无法实现物质彻底的分离,分离后仍混有较多杂质,而蛋白质组质谱技术要求较精确,目前蛋白质组的分离方法朝向更加精确的方向发展,例如双向电泳法,高效液相色谱法等。

1.2.1、 离心法
离心法是较为基础的分离方法,高速旋转中的物体会有强大的向心力,从而使得放入其中的物体中的悬浮颗粒发生不同程度的漂浮或沉降,最终使得部分颗粒发生浓缩,与其他物质发生分离,整体的操作没有太高的技术要求但无法将各物质彻底分离,如Herbik等在1996比对正常番茄与缺铁性番茄中蛋白质表达方式的不同时,使用离心法无法完全分离甘油醛_3_磷酸脱氢酶,甲酸脱氢酶等一些可帮助获得铁的酶,使用更精确的双电泳凝胶法才将此类酶成功分离。一般,离心法无法将物质完全分离,处理后产物仍混有较多杂质,需要在离心后采用其他技术进行下一步分离。
1.2.2、 色谱法
离子交换色谱法。离子交换色谱法是利用蛋白质含电量的不同进行分离,层析柱中填充阴(阳)离子交换树脂颗粒,根据电荷同性相斥,异性相吸的原理,洗柱时用含阴(阳)离子的溶液,若蛋白质所带电荷较小,静电力较小,则会先与层析柱分离,增加溶液离子浓度,所带电荷较多的蛋白质也会与层析柱分离,即可分离蛋白。
凝胶排阻色谱法,或称凝胶过滤或分子筛,当分子量不同的物质通过多孔性亲水性凝胶时,若蛋白质分子直径太大无法进入凝胶的孔径内,则不会通过凝胶内部直接顺着凝胶的缝隙流出,若蛋白质分子直径小于凝胶的孔径,则会进入凝胶内部,增大了通过凝胶需经过的长度。这样,通过在柱内停留时间的不同,可达到将蛋白质分离的目的。(如图2)
图1 离子交换层析原理(赵永,2015)
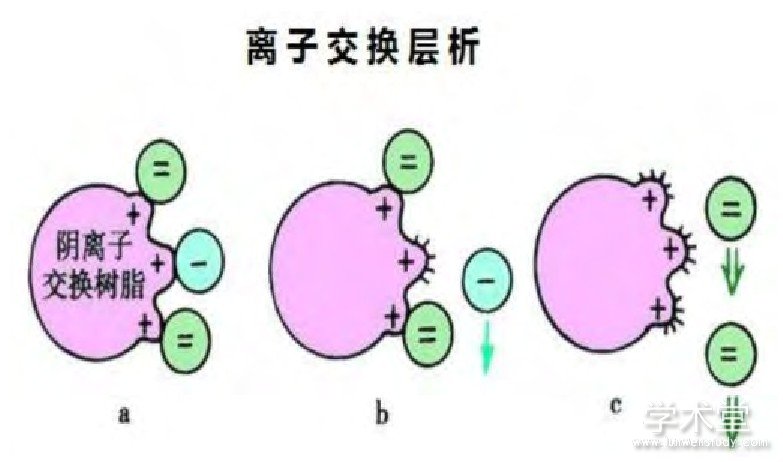
图2 凝胶排阻色谱法原理(王娜娜、姚秀清等,2011)
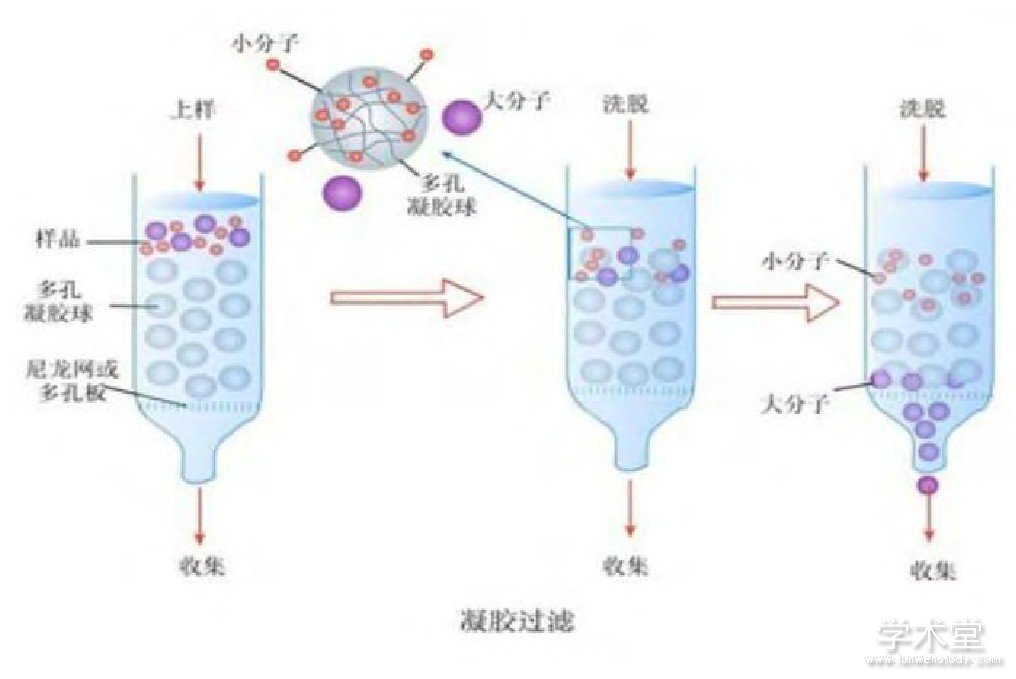
如阮振刚等在检测酚醛树脂中的游离酚时,使用凝胶排阻色谱法无法得到分离度很好的谱峰,增大了实验的误差。
亲和色谱法利用某些物质存在特异性结合,混合物通过层析柱时柱内凝胶只与和凝胶有特异性结合的物质结合达到从原混合物中分离特定物质的目的,抗体与抗原之间可用亲和层析进行分离。
高效液相色谱法,采用高压输液系统,将待检测的液相进行多次的层析分析,随着蛋白质分离检测的次数增多,蛋白质被检测的精度也越高。如高旭东等建立了黄芩苷,盐酸小檗碱和大黄素的高效液相色谱检测方法;色谱法作为目前较为常用的方法,分离效率较高,具有较快的分析速度,灵敏度高,选择性好,可同时分析多组,易于自动化,如张元梅等利用高效液相色谱法鉴定柑橘过时中18种类黄酮的含量,实验结论证明其分离效果较好。经检测,各类黄酮均被成功分离,偏差较小;但高效液相色谱法不能进行蛋白质的定性分析,不能进行相关蛋白质的具体检测。
1.2.3、 电泳法
SDS—聚丙烯酰胺凝胶电泳(SDS—PAGE)。SDS—PAGE法是利用蛋白质分子量大小不同进行分离[8]。SDS—PAGE技术相对误差较小,如朱广廉等在用SDS—PAGE分离蛋白质时测定丙酮酸激酶等蛋白质的分子量,多次测定的误差均远小于利用层析法测定所产生的误差;但凝胶浓度对实验的精确性有较大影响,在同一实验中,朱广廉等通过实验结果分析出若胶浓度太低,无法分离核糖核酸酶和嗅酚蓝带,增大了实验的误差。若分离胶过浓,则无法分离分子量相似的蛋白质分子,使实验误差增大。
1.2.4、 等电聚焦法
等电聚焦法是利用蛋白质等电点不同进行分离。等电聚焦pH梯度电泳法可以随意设定p H梯度,尤其第二轮分析可缩小测定pH值的范围,提高分辨率及重复性。
1.2.5、 双向电泳
利用蛋白质分子大小和等电点不同。第一向等电聚焦电泳,第二向SDS—PAGE电泳[10],经过双向电泳的分离,蛋白质会在二维平面上形成不同的点,每个点就可认为是被分离出的不同蛋白质。双向电泳技术对蛋白质的检验较为灵敏,同时检测后的分辨率较高;但对酸碱性极强的蛋白质,疏水性蛋白质及含量较少蛋白质用此种技术不易分离,双向电泳技术仍存在不足之处。
2、 蛋白质分析
2.1、 含量的检测方法
凯氏定氮法、双缩脲法、紫外吸收法、考马斯亮蓝法等是蛋白质含量检测的常用方法,在实验中考虑采用何种方法,都是需要结合不同的环境进行选择的,需要用不同的实验去确定采用的方法。
2.2、 蛋白质功能分析
酵母双杂交法免疫共沉淀法和蛋白质芯片质谱技术等可以用来对蛋白质的功能进行分析。对于蛋白质的功能进行分析是一个比较复杂的实验操作,但是为了研究蛋白质在不同生物通路上的作用,对于蛋白质功能的研究是必须的,因此应该考虑使用不同的适用方法进行研究。
2.3、 蛋白质的鉴定
以前对蛋白质的鉴定主要通过测序和双向电泳来完成。双向电泳通过蛋白质分子量和等电点的不同使蛋白质在凝胶上移动分离,将凝胶上的蛋白质位置对比已有的蛋白质数据库,鉴定出蛋白质种类的方法特异性低、低效、且准确率低。利用质谱技术可以快速、高效地对目的蛋白进行鉴定分析,且使用的样品量小。原理是将分子离子化后的样品,根据分子离子间荷质比的不同来分离并生成图谱。
3、 蛋白组学的现状及改进
目前蛋白组学的应用存在于多个方面,在各个生物领域均可发挥其作用。利用研究植物在极端条件下(高温)的蛋白质种类变化,即将正常的植株进行一定的处理,使其形成突变体,将突变体内的蛋白质种类与正常个体内的蛋白质种类进行比较,得出极端条件下植物体内的蛋白质种类会发生变化,分析含量变化的蛋白质可能存在的对植物在非生物胁迫下的抗性能力的影响,并据此对蛋白组学相关应用展开展望。同时,可利用蛋白组学分析具有将强活性的生物碱的分泌机理,在蛋白组学上更好的研究如何对植株进行诱导使其活性增加。针对较复杂的(全身性自身免疫疾病)疾病,如类风湿关节炎,单从基因水平无法阐释病理各环节错综复杂的联系,而利用蛋白组学技术则在蛋白质组水平上解释该类问题,加快了相关疾病治疗的效率。但若疾病涉及的易感因子较多,考虑将多个蛋白进行结合以检测。蛋白组学技目前存在较广泛的应用,但仍有待改进,发展之处,其中大概包括蛋白质的动态分辨率,定量,纯化方面存在的问题。之前的蛋白质组学检测技术的定量精度都非常低,甚至是无法实现定量。但是在现如今生命科学发展迅猛的情况下,对于蛋白质的动态变化要求很高,所以对于蛋白质的定量精度也提高了要求。例如在SDS-PAGE胶上用荧光染料来检测蛋白质,同样质谱法也可对蛋白质进行定量。值得注意的是,疏水蛋白因其难溶于水的性质,在蛋白组学的研究中难以进行实验,因而可以采用有机溶剂溶解疏水性蛋白后进行下一步的实验。
4、 总结与展望
质谱技术、色谱技术的不断研究和创新,使植物蛋白组学不断向前迈进。植物蛋白组学凭借其广泛的应用范围和巨大的利益效应,取得许多重大的成就,充分体现蛋白组学巨大的发展潜力。本文就蛋白组学的研究方法做了总结,包括蛋白质的获取以及蛋白质含量的测定、功能分析,再到蛋白质组的鉴定,着重介绍了研究过程中涉及到的技术,以期能够为想开展蛋白质组学研究的人员提供参考,同时也希望能对蛋白组学技术的发展起到铺垫作用。
参考文献
[1]李肖芳.应用蛋白质组学方法研究盐角草(Salicornia europaea L.)的抗盐性[D].中国科学院研究生院(植物研究所),2006.
[2]李雪辉,段红丽,潘锦添,等.离子交换色谱法检测离子液体中阴离子[J].分析化学,2006,34(u09):192-194.
[3]张根连,范术丽,宋美珍,等.植物蛋白质组学技术研究进展[J].生物技术通报,2011(7):26-30.
[4]杨中华,张立娜,张锦,等.中空纤维离心超滤-高效凝胶排阻色谱法测定青霉素V钾中蛋白杂质[J].分析科学学报,2018(2).
[5]余秀娟,王骊丽,张如月,等.L-精氨酸对提高蛋白质复性与纯化率的作用及其分析[J].内蒙古大学学报(自然科学版),2017(6):612-618.
[6] 高旭东,师永清,陈士恩,等.双波长HPLC测定栀子金花丸中栀子苷、黄芩苷、盐酸小檗碱和大黄素的含量[J].国际药学研究杂志,2015,42(3):409-412.
[7]高旭东,师永清,陈士恩,等.双波长HPLC测定栀子金花丸中栀子苷、黄芩苷、盐酸小檗碱和大黄素的含量[J].国际药学研究杂志,2015,42(3):409-412.
[8]Liang X,Bai J,Liu Y H,et al. Characterization of SDS--PAGE-separated proteins by matrix-assisted laser desorption/ionization mass spectrometry[J]. Analytical Chemistry,1996,68(6):1012.
[9]张元梅,周志钦,孙玉敬,等.高效液相色谱法同时测定柑橘果实中18种类黄酮的含量[J].中国农业科学,2012,45(17):3558-3565.
[10]朱广廉,杨中汉.SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的分子量[J].植物生理学报,1982(2):45-49.
[11]刘素丽,鲁勇,王学军,等.一种新型速效人胰岛素类似物的构建、制备及性质研究[J].东南大学学报(医学版),2009,28(5):371-375.
[12]邓湘雄,张晓勤,胡江,等.一种适用于双向电泳的水稻磷酸化蛋白富集方法———酚提取法结合固相金属离子亲和层析法[J].中国生物化学与分子生物学报,2012,28(11):1057-1063.
蛋白质组学研究的主要内容包括在蛋白质水平上大规模地分析组织细胞的蛋白质表达水平、翻译后修饰、蛋白质间的相互作用等,从而揭示蛋白质的功能,已在疫苗筛选、指导治疗、临床药物开发及预后判断等领域发挥了重要作用。...
绝大多数真核生物的生命活动都离不开氧气,氧气与高等生物体的能量代谢等过程密切相关。氧气分子在代谢中间体、酶和辐射作用下产生活性氧(Reactive oxygen species,ROS),其在正常生理条件下对细胞代谢的调控发挥着至关重要的作用。...
膜蛋白是生物膜功能的主要承担者,根据膜蛋白的分布,膜蛋白可以分为三类:外周膜蛋白、整合膜蛋白和脂锚定蛋白。膜蛋白的功能具有多方面性,有些膜蛋白可以作为载体而将物质转运出细胞;有些膜蛋白是激素或者其他化学物质的专一受体;有些膜蛋白作为专一的...
食品风味是消费者选购和接受食品的决定性因素之一,风味取决于多种挥发性成分在顶空中的浓度,阈值等,与温度、挥发性成分的蒸汽压及其他食品组分之间的相互作用有关。目前,风味研究主要集中于风味成分的形成机制,而有关风味成分的释放与感知报...
生物膜主要由磷脂双分子层和镶嵌或附着在其上的蛋白质构成。动物、植物和微生物通常都有一种或多种膜系统。细胞质膜 (质膜) 是最为常见的一种膜系统,负责把细胞质和其他内溶物与周围环境分隔开,并负责与环境交换物质和感受信号。...
自2003年中国人类蛋白质组组织(Chinahumanproteomeorganization,CNHUPO)成立至今,中国的蛋白质组学研究经历了十年多的发展,呈现出百家争鸣、百花齐放的局面.继中国科学家领衔人类肝脏蛋白质组计划(humanliverproteomeproject,HLPP)之后,2014...