
对血红蛋白可逆载氧的系统研究是生物无机化学领域的重要成果之一,其结构与功能的关系也一直是相关教学关注的重点。在近一个世纪以来的研究中,人们对于血红蛋白的分子结构、载氧机理与生物学功能都有了较为全面的认识; 但是对于其活性中心血红素在结合氧分子前后的相关结构变化,目前仍然存在多种争议,其中包括: 血红素中心的亚铁离子在和氧分子结合的过程中是否发生了电子转移?
氧分子与血红素铁是端配位还是侧配位? 在脱氧状态下是否有水分子占据第 6 个配位点? 本文结合研究进展对这些争议进行总结分析,以期加深对血红蛋白结构功能的理解,辅助教学内容,并对血红素类功能配合物的设计合成提供参考。
1 血红素的结构与功能
血红蛋白在高等动物体内起运载氧气的作用。血红蛋白[1]具有的四级结构为4 个亚基构成的异源四聚体 α2β2,其中每个蛋白亚基都结合一个血红素辅基,且将其包裹于蛋白侧链构成的疏水核心( 图1) 。
脱氧状态的血红素分子由卟啉与亚铁离子配位形成。虽然不同血红素分子的卟啉环外衍生结构不同,可以分为多种异构体,但其利用环上 4 个氮原子进行配位的方式是一致的。同时,蛋白中 87 位( α亚基) 或 92 位( β 亚基) 的组氨酸残基上的咪唑氮原子从卟啉环平面上方与亚铁离子配位,构成第 5 配位点( 图 2) 。

实验证明,在脱氧血红素中,亚铁离子半径较大( 92pm) ,不能嵌入卟啉环内,因而高出卟啉环平面60pm。当氧分子配位后,中心铁离子半径缩小至 75pm 而进入卟啉环平面。在结合氧分子过程中还伴随着中心铁离子的磁矩变化。在脱氧状态下,血红素铁呈现顺磁性; 而在氧合状态下呈反磁性[1]。
对于血红素氧合前后铁离子半径和磁性变化的原因存在多种争议,其中血红素中心亚铁离子在氧合过程中是否发生了电子转移是最重要的一个。穆斯堡尔谱( Mssbauer spectroscopy) 只显示中心铁离子与氧分子之间有强的共价作用,但是难以对铁离子的氧化态进行清楚的说明[2]。另外,IR 谱中观察到的O—O键的红外伸缩振动频率在数据与结论上都存在分歧[3],但是明确的一点是O—O键的键级为1. 5,与超氧负离子的键级相同[4]。Raman 光谱也提供了一些数据[5]。不过由于中心铁离子与氧分子配位前后的原子轨道、分子轨道发生重组,光谱数据以及键级、键长、键角等数据自然会发生变化。在没有直接证据的情况下,直接对比配位前后的相关性质和谱学数据,从而得出支持某种假设的结论是不够充分可靠的[6]。
另外还有两个争议,一是与铁离子相结合的氧分子的配位方式,即是端配还是侧配; 二是脱氧血红素中亚铁离子是 5 配位,还是有水分子配位形成 6 配位。人们提出了不同的氧合理论模型,试图对以上争论进行解释。
2 理论模型研究
由于以上实验证据表明在脱氧血红蛋白转变为氧合血红蛋白过程中存在某些复杂的结构变化和电子重排过程,人们对血红素中铁氧键合过程和结构提出了多种理论模型。
最早,Pauling 运用经典价键理论建立模型[7-9]对此过程进行说明: O2以端配方式与亚铁离子结合,其中一个氧原子的一对孤对电子与铁配位,未发生电子转移,亚铁离子由 5 配位高自旋状态转变为 6 配位低自旋,因而半径缩小,由于电子配对,顺磁性转变为反磁性。血红素与一氧化碳结合的产物具有相似的分子结构,可以说明血红素氧合后的配合物存在一种共振体,因而亚铁-氧之间的键有部分双键性质( 图 3a) 。
后来,Weiss 提出电子转移模型[10-11],认为在血红素与双氧结合后,中心的亚铁离子 Fe( Ⅱ) 首先转移一个电子给 O2形成超氧负离子 O-2,自身变成半径较小的高铁离子 Fe( Ⅲ) ,然后超氧负离子与高铁离子配位。虽然低自旋的高铁离子有一个未成对电子,本身呈顺磁性,但是与同样具有一个未成对电子的超氧负离子配位结合后,电子配对,各自的顺磁性消失,整体显示抗磁性( 图 3b) 。
除此之外,Griffith 还提出另外一个侧配氧合模型[12]。他通过对中心原子铁及氧分子的轨道计算得出,其配位模式既不是垂直端配共振体,也不是倾斜端配共振体。结合自旋状态分析,他认为 O2是平行于卟啉-铁配位平面进行配位的,即侧配氧合,利用亚铁离子空的 d2sp3杂化轨道和 O2的 π2p轨道重叠形成 σ 键,而亚铁离子的 3dxz原子轨道上的电子可以和 O2的 π*2p空轨道形成反馈 π 键( 图 3c) 。
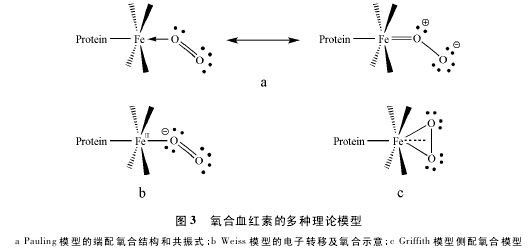
综上,现在存在 3 种不同理论模型,下面对几个争议分别进行论述。
3 争议一: 氧合血红素中铁离子的氧化态问题
首先,对于结合双氧前后血红素中心亚铁离子氧化态的变化情况长期存在争议。
对公认的磁性与半径变化的事实,Pauling 理论解释为 Fe( Ⅱ) 离子的电子自旋状态的改[]综上,现在存在 3 种不同理论模型,下面对几个争议分别进行论述。3 争议一: 氧合血红素中铁离子的氧化态问题.首先,对于结合双氧前后血红素中心亚铁离子氧化态的变化情况长期存在争议。对公认的磁性与半径变化的事实,Pauling 理论解释为 Fe( Ⅱ) 离子的电子自旋状态的改变,这与键长、键角等数据也相符合[13]; Weiss 模型则认为铁( Ⅱ) 被氧化为铁( Ⅲ) ,而不仅仅是电子自旋状态的变化。中心原子氧化态的升高必然伴随着半径的减小和磁性的改变。前文提到在 IR 谱中观察到O—O键的红外伸缩振动频率对应着O—O键的键级为 1. 5,与超氧负离子的键级相同[14]。此外,X 射线光电子能谱( X-ray photoelectron spectroscopy) 研究表明,中心铁原子具有一个约为 3. 2 的氧化态[15]。Durham等人[6]利用 X 射线吸收近边结构光谱( X-ray absorption near edge structures) 研究中心铁离子在氧合过程前后的能级变化情况,证明铁离子在氧合后有效正电荷增加了。这些都能够被 Weiss 模型合理地解释。
对于 Pauling 模型存在一些困惑。比如通过高自旋到低自旋的转变看似能够解释磁性的变化,但是这同时要求氧分子首先由两个电子自旋平行的三线态转变为自旋配对的单线态,这是一个能量上不利的过程。同时,在 Pauling 理论中,认为氧配位之后使八面体场的晶体场分裂能升高,从而导致中心亚铁离子由顺磁性的高自旋( t42ge2g) 转变为抗磁性的低自旋( t62ge0g) ,进而使其半径减小。在这个推理过程中,配位场分裂能的变化,以及高低自旋的转变对半径的影响,是缺乏直接量化证据的。相比之下,Weiss模型中亚铁离子转变为高铁离子,离子半径自然减小的解释更加直接有力。
但是,目前对 Weiss 模型最大的非议是典型的高铁血红素却不具备可逆载氧功能。对于这一点,我们认为可以这样解释,一是因为在 Weiss 模型中,与铁离子配位的实际上是超氧负离子,而不是空气中直接存在的双氧分子。故而,这一点不能作为否定 Weiss 模型的证据。另外,实验[16]表明,从血红蛋白中分离出 的 血 红 素 暴 露 在 氧 气 中 时,氧 分 子 会 与 两 个 血 红 素 铁 以 桥 配 配 位,形 成 稳 定 的Fe( Ⅲ) -O2-Fe( Ⅲ) 产物,血红素亚铁被不可逆地氧化为血红素高铁。同时,珠蛋白链形成的疏水结构可以保护血红素亚铁在可逆载氧过程中不被氧化,这已被公认。因此我们可以认为,在 Weiss 模型中,从血红素亚铁离子到氧分子的一个电子转移只发生在氧合配位体中,而且是可逆的。在脱氧过程中,受到外围蛋白结构的保护,氧合配位体脱掉氧分子,血红素恢复为亚铁离子。可见,Weiss 模型可以较为合理地解释现有大部分现象而没有明显不合理之处。
氧合血红素中铁离子的氧化态之争在教学体系中是非常分明的,因为涉及血红蛋白的可逆载氧的氧合机理是非常重要的。历史上 Pauling 模型有着广泛的影响,目前国内外很多经典教科书中都认同这一观点。例如,Miessler[17]在《Inorganic Chemistry》中阐述血红蛋白的存在可以保护血红素铁使其与氧气结合后仍保持 Fe( Ⅱ) 形式,而不被氧化为 Fe( Ⅲ) 。麦松威[18]在《高等无机结构化学》中也强调了在血红蛋白中,O2结合于 Fe( Ⅱ) ,不会氧化为 Fe( Ⅲ) 。随着一些新的谱学实验的研究,Weiss 模型也得到越来越多的支持。Cotton[19]在《Advancd Inorganic Chemistry》中也提到,在脱氧条件下血红素铁是Fe( Ⅱ) 高自旋; 氧合后变为 Fe( Ⅲ) 低自旋,通过与超氧负离子结合而电子配对呈现反磁性。郭子建等在其《生物无机化学》教材[15]中支持氧合过程中的 Weiss 模型。
4 争议二: 双氧配位方式
关于 O2对于铁离子的配位是弯曲型端配( bent end-on) 还是侧配( side-on) 也一直存有争议。在Griffith 模型中,O2与血红素中心铁原子配位方式为侧配; 而在 Pauling 模型[7-9]和 Weiss 模型[10-11]中,O2以弯曲型端配方式与铁结合。模型化合物和血红蛋白、肌红蛋白的 X 射线晶体衍射数据都证实双氧与铁离子以端配方式结合且有一定倾斜角。而 Mssbauer 谱也证明 O2既不是平行也不是垂直于血红素平面。
最初因难以获得准确的蛋白晶体结构数据,一系列与血红蛋白复合体几何构型相似的模型化合物被构建用来研究蛋白质结构与功能之间的关系[20]。血红蛋白中氧气对铁的弯曲型端配结构最早在尖桩篱笆型复合体( “picket fence”complex) ( 图 4) 中被观测到[21-22],后来人们在氧合肌红蛋白[23]及氧合血红蛋白[24]的晶体结构中也观察到了这种配位方式( 图 5) 。氧合血红素中的Fe—O—O键在不同物种的同源蛋白质及模型化合物中有特定角度,Fe—O—O键的键角在 Fe( TpivPP) ( 2-Melm) 尖桩篱笆型复合物中为 129°; 在氧合无脊椎动物血红蛋白中为 170°,近乎为直线型[25]; 在脊椎动物氧合肌红蛋白中为 115°[26]; 在脊椎动物氧合血红蛋白中为 156°,介于尖桩篱笆型复合物和无脊椎动物血红蛋白之间。
蛋白空腔的大小、双氧与蛋白上特定氨基酸之间氢键的形成会影响Fe—O—O键角。例如,根据空间位置判断,氧合血红蛋白和氧合肌红蛋白中 α-亚基 E7 位的组氨酸上的 Nε与 O 的间距是 2. 7,有利于形成 Nε H 帿O 的氢键,氢键的强弱、α-亚基 E7 位组氨酸与双氧的相对位置将影响Fe—O—O键角。
5 争议三: 铁离子配位数问题
在氧合血红蛋白中,血红素铁形成6 配位结构,而且 CO、NO 等小分子极易取代 O2与血红素铁形成弯型端配结构[27]。在生物体的脱氧血红蛋白中,水是否与血红素铁配位也小有争议。大部分教材描述脱氧血红蛋白中亚铁离子为 5 配位,因为血红素所处的疏水蛋白结构应不利于水的配位结合; 但也有研究[28]报告在脱氧血红蛋白中,水分子可以作为血红素铁的轴向配体参与配位,即在脱氧情况下血红素铁为 6 配位。如果血红素铁在氧合前后都是 6 配位,即只是水分子被氧分子取代,则很难解释血红素铁在氧合过程中的巨大结构变化。对于水分子与血红素铁的配位情况,目前所得的血红蛋白及血红素模型化合物的晶体结构显示很少有水参与中心金属的配位[19]。但 Priedman 等人[29]在研究 Scapharca 的二聚血红蛋白结构时发现,在此血红蛋白亚基界面上有水分子团簇结构。根据二聚血红蛋白晶体结构,脱氧二聚血红蛋白的血红素铁可与水分子配位。他们用定点突变、改变渗透压的方法进一步研究水分子配位对血红蛋白功能的影响,发现将 Scapharca 血红蛋白的 72 位苏氨酸突变为缬氨酸后,氧气对血红蛋白的亲和性提高了 40 倍; 造成这一结果的最重要差异就是: 突变后血红蛋白中的血红素铁与水分子的结合能力变弱了。此外,增加渗透压将降低人血红蛋白对氧气的亲和性,这说明水分子和氧气在与血红素铁配位时存在竞争关系,人血红蛋白中血红素铁可能与水分子存在类似的弱配位键。

综上所述,目前只在极少数血红蛋白晶体中观察到了水与血红素铁的配位。一般认为,脱氧时血红素铁为 5 配位,即血红素铁不与水分子配位。
6 结论
对于血红蛋白中血红素的氧合过程及氧合前后的结构变化,人们采用了多种物理和化学手段进行研究,获得了丰富的数据。基于此,人们提出了 Pauling 模型、Weiss 模型等不同的理论模型试图解释血红蛋白的氧合机理,但是对其具体结构某些方面的认识仍然存在一些争议。本文通过分析比较几种理论模型,结合相关研究的最新进展,对目前教学中有争议的问题进行了梳理和总结,提出相关看法。对于氧合过程中铁离子的氧化态问题,我们认为 Weiss 理论中 Fe( Ⅲ) 与超氧负离子的配位模型比较合理; 对于 O2配位方式的争议,目前已基本解决,晶体结构表明其为弯曲型的端配; 对于脱氧血红素中铁离子的配位数其实争议不大,均认为是 5 配位。但某些研究表明在脱氧情况下,一些物种的血红素铁可与水、组氨酸和卟啉环形成 6 配位结构,值得关注。
参 考 文 献
[1] 项斯芬,姚光庆. 中级无机化学. 北京: 北京大学出版社,2003
[2] Lang G,Marshallproc W. Proc Phys Soc,1966,87: 3
[3] Momenteau M,Reed C A. Chem Rev,1994,94: 659
[4] Barlow C H,Maxwell J C,Wallace W J,et al. Biochem Biophys Res Commun,1973,55: 91
[5] Tsubaki M,Nagai K,Kitagawa T. Biochemistry,1980,19: 379
教师是教学行为的主体,课堂是教学行为发生的主要场所.前苏联教育家苏霍姆林斯基认为教师的语言在很大程度上决定着学生在课堂上的脑力劳动的效率[1],教师的语言是一种什么也代替不了的影响学生心灵的工具.弗兰德斯认为,研究者不可能也没必要把课堂中所发生的...
以聚乙烯亚胺修饰后的荧光碳点为荧光源和载体, 采用溶胶-凝胶法制备了高灵敏度和高选择性的荧光牛血红蛋白印迹聚合物。在优化的检测条件下, 此荧光印迹聚合物成功应用于实际样品中牛血红蛋白的选择性识别和检测...