
聚丙烯酰胺凝胶电泳是分离、分析蛋白质常用的方法。在蛋白质组学试验中,蛋白质经聚丙烯酰胺凝胶电泳后的染色是十分重要的环节。电泳后的常规染色方法已有很多,目前一般采用的染色、脱色方法是用甲醇-醋酸〔1〕.但在学生的实验中,脱色液用量相当大,且脱色时间长〔2〕,不但试剂成本耗费比较高、实验时间长,而且甲醇的毒性有害健康〔3〕.为此,本文用乙醇代替甲醛,用 10% 的三氯醋酸代替高浓度的醋酸配制染色、脱色液,并用微波炉加热染色、脱色的方法〔4,5〕,建立了一种成本低、无毒性的快速染色、脱色方法。
1 材料与方法
1. 1 材料
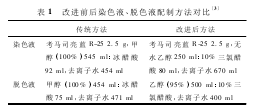
1. 1. 1 主要试剂和仪器 丙烯酰铵、N,N'-甲叉双丙烯酰铵、过硫酸铵、三羟甲基氨基甲烷(Tris) 、三羟甲基甘氨酸(Tricine) 、盐酸、氢氧化钠、四甲基乙二胺(TEMED) 、核黄素、甘氨酸、蔗糖、溴酚蓝、三氯乙酸(TCA) 、考马斯亮蓝 G250、95% 乙醇(均为上海生工生物工程有限责任公司) .电泳采用 MV-Ⅱ型双垂直板微型电泳系统。
1. 1. 2 染色液、脱色液的配制 见表 1.
1. 2 实验方法1. 2. 1 制胶 取小烧杯,根据预定胶浓度,吸取定量的凝胶应用液,依次加入分离胶应用液、水、TEMED,慢速搅拌,并在真空干燥器中抽气 3 min.加入过硫酸铵轻轻搅拌后,立即将胶液沿玻壁注入倾斜一定角度的垂直板型凝胶玻璃板模具中,至距上沿 约 3 cm 处。然后用滴管沿玻璃板内壁缓缓注入一 层蒸馏水隔离空气,室温垂直放置,使凝胶液聚合。30 ~40 min 后分离胶完全聚合,倾出分离胶上的覆盖层液体,用滤纸条吸干残留水分。注入浓缩胶(小心不要产生气泡) ,将胶液加到距玻璃顶端 1 cm 处插入样品模具梳子,放在紫外灯下,使凝胶聚合。
胶凝后,去掉硅胶条。将凝胶板安装在微型电泳槽上。在内外缓冲液槽中均加入电极缓冲液,小心拔出样品槽模具,加样。
1. 2. 3 加样和电泳 在样品槽内用微量注射器依次加入 20 ~30 nm 样品溶液,电泳的条件为浓缩胶中的电压 120 V,待样品进入分离胶后,改为150 V,当溴酚蓝指示剂距玻璃板底部1 cm时,停止电泳。
1. 2. 4 固定和染色 方法 1: 将电泳完的凝胶放入用考马斯亮蓝 R-250、甲醇、冰醋酸配制的染色液中,然后放在摇床上摇动染色,15 min 后取出凝胶,用蒸馏水冲洗 3 次,再加入 100 ml 的脱色液,在摇床上脱色,20 min 后倒掉变蓝脱色液,然后用蒸馏水冲洗 3 次,弃去变蓝的蒸馏水,再倒入 100 ml 脱色液重复上面操作 3 次。方法 2: 将电泳完的凝胶放入盛有 100 ml 的用考马斯亮蓝 R-250、10% 三氯醋酸、乙醇配制的染色液的塑料盘中,盖子扣严,在微波炉中用高火照射 10 s 染色,然后用蒸馏水反复冲洗 3 次。再将凝胶放入 100 ml 脱色液中,高火档照射20 s,然后倒掉脱色液,用蒸馏水冲洗,弃去变蓝的蒸馏水。再加入新鲜脱色液再照射 20 s,重复 3 次,凝胶体积会逐渐缩小,将其用蒸馏水反复冲洗,恢复到原来的体积。凝胶先出现紫色条带,然后逐渐变成较清晰的蓝色条带。
2 结 果。
2. 1 不同染色方法比较 实验表明用乙醇代替甲醇,实验分辨率几乎没有区别。见图 1,图 2.
图 1 用方法 1 染色、脱色的效果图 2 用方法 2 染色、脱色的效果2. 2 不同脱色方法的比较 用原来的方法,加入脱色液然后放在摇床上染色脱色需要 1. 5 ~ 2 h; 改用微波炉加热方法染色、脱色只需要 20 ~ 30 min,并且脱色效果更清晰。见图 1,图 2.
3 讨 论。
蛋白质染色及固定原理实际上就是使蛋白质变性,从水相中析出到凝胶相中,使其不再发生自由扩散,使用的染色剂中有三氯乙酸、乙醇,其分子不仅与蛋白质的带正电荷的侧链结合,而且通过氢键和肽键结合,其结果使蛋白质分子失去水化水分子,同时在肽键表面包上一层疏水的基团,这样蛋白质的水溶性被破坏后就从水相中沉淀到凝胶相上。另外,蛋白质变性后结合染料的能力也大大增强了。所以,只要有足够的三氯乙酸和乙醇溶液,染料的染色、固定作用就会好。经过大量实验证明,用乙醇和 10%的三氯醋酸代替有毒性的甲醛及高浓度的醋酸完全可以达到同样的染色效果,且减少了污染、降低了试剂的成本。
微波加热能够促进试剂向凝胶内渗透和扩散以及分子间相互作用。水浴或微波加热处理的目的是将凝胶中的蛋白快速地固定,以免其扩散,并可以大大节省胶片固定和染色时间、省却过多的漂洗步骤。通过微波加热处理可以在 20 ~ 30 min内完成凝胶的染色和脱色过程,与使用摇床染色、脱色方法相比,极大缩短了染色、脱色时间。胶片经微波染色 20 s 即可达到用摇床方法染色 1 h 的效果,且微波脱色可在短时间内使胶片底色脱除更加彻底。
通过实际应用,笔者发现用改进的染色、脱色方法不仅减少了毒性药品的使用,同时大大缩短了实验时间,且降低了实验成本,可以在实验室推广。
4 参考文献:
1 练玉银,刘志刚,温岸玲 . 鲤鱼主要变应原的分离、鉴定与纯化〔J〕。
中国公共卫生,2006; 22(8) : 947-9.
2 倪菊华,梁 静,贾竹青 . 生物化学与分子生物学实验教程〔M〕。 北京: 北京大学医学出版社,2008: 26-39.
双酶切联合琼脂糖凝胶电泳是鉴定DNA重组成功与否的重要方法[1],琼脂糖凝胶电泳图像质量直接影响鉴定结果的判读、论文发表。条带弥散是图像质量不佳的主要表现之一,研究者多将其归咎于不合理的酶切和不规范的电泳操作[2],而很少报道质粒抽提策略对弥散的影...