肿瘤已成为威胁人类健康的最严重疾病之一,世界卫生组织( WHO) 2015 年 2 月的实况报道,2012 年全球约有 1 400 万新发肿瘤病例和 820 万例肿瘤相关死亡,是全球发病和死亡的主要原因[1].
WHO 在 2015 年 2 月 3 日发表的《全球癌症报告2014》显示[2],新增癌症病例有近一半出现在亚洲,其中大部分在中国,新增癌症病例高居第 1 位。中国肿瘤登记中心《2013 年中国肿瘤登记年报》也显示,我国肿瘤发病和死亡情况在逐年增加。如此高的发病率和死亡率导致对于抗肿瘤药的大量需求,加速了抗肿瘤药研发的进程,作为人口资源大、疾病种类分布广泛、研究费用相对较低的发展中国家[3],我国必定成为抗肿瘤药研发和销售的主要市场,世界也纷纷在我国建立研发中心,开展临床试验。本文通过检索国际临床试验注册网站 Clinical-Trials. gov 收录的相关临床试验数据,分析国外在我国开展抗肿瘤药临床试验的现状。
1 数据库选择与检索分析
1. 1 数据库选择 2004 年 9 月,国际医学期刊编辑委员会( ICMJE) 宣布,从 2005 年 7 月 1 日起,其成员期刊只发表已经注册的临床试验[4].2005 年 1月 6 日,欧洲制药工业协会联盟 ( EFPIA) 、国际制药企业协会联合会( IFPMA) 、日本制药企业协会( JPMA) 以及美国药品研究与制造商协会( PhRMA)共同发布了《通过临床试验注册簿及数据库使临床试验情报公开化的共同指南》[5],这些宣言和《指南》加速了临床试验注册的步伐。ClinicalTrials. gov是《指南》唯一推荐也是符合 ICMJE 要求的临床试验注册平台,由美国国立医学图书馆( NML) 和美国食品药品监督管理局 ( FDA) 于 1997 年共同建立,于 2004 年对国际上开放,由于网站内含大量临床试验信息和数据,因此也作为重要的临床试验资料库[6].本文选择 ClinicalTrials. gov 作为检索平台,由于不是所有的临床试验都在 ClinicalTrials. gov 网站登记注册,可能存在局限性,但 ClinicalTrials. gov收录的世界 187 个国家的数据,在注册数量、数据全面性和参与注册国家广泛性上都居世界首位[7],通过此数据库得出国外在我国进行抗肿瘤药临床试验的结果,也相对具有代表性。由于网站定期更新,本文所选数据截至 2015 年 3 月 6 日。
1. 2 数据检索与分析方法 首先以“Tumor”,“Ne-oplasm”,“Cancer”,“tumour”等关键词在 ClinicalTri-als. gov 网站上进行模糊检索,并将地区定位在中国大陆,注册时间节点选择 2005 年 1 月 1 日至 2015年 3 月 6 日,摘取申办者/合作者为国外制药企业的抗肿瘤药临床试验,然后以试验设计、试验分期、研究类型、研究疾病情况、申办方信息、预期样本量等指标进行分类汇总,最后对汇总结果进行分析,得出结论。
2 全球抗肿瘤药临床试验整体概况
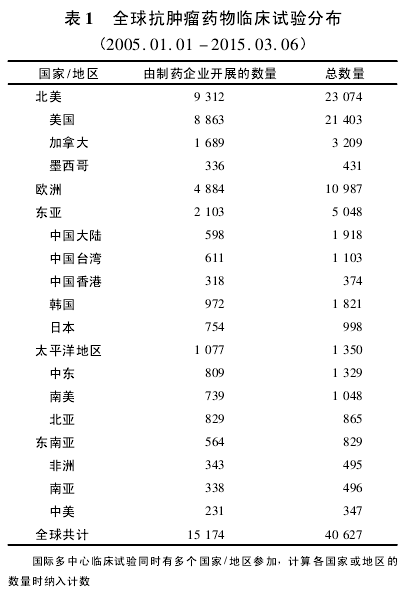
2005 年 1 月 1 日至 3 月 6 日,全球在 Clinical-Trials. gov 网站注册登记的抗肿瘤药临床试验项目有 40 627 项,数量最多的为北美和欧洲地区,分别为 23 074 项和 10 987 项,占据全球在研项目总量的80% 以上,其次为东亚地区,共有 5 048 项,而东亚地区有 60%以上( 中国大陆 1 918 项,中国台湾地区1 103 项,中国香港地区 374 项) 是在我国开展,尤其是大陆地区,是继美国和欧洲部分发达国家之后数量最多的地区( 表 1) ,而由制药企业开展的抗肿瘤药临床试验,我国只有 598 项,居美国、加拿大、欧洲部分发达国家、韩国、日本等之后。经筛查,由国外制药企业在我国( 不含香港、台湾地区) 开展的抗肿瘤药临床试验共 309 项。
3 国外在我国开展抗肿瘤药物临床试验的现状
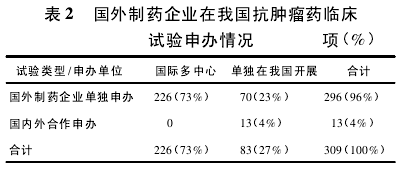
3. 1 申办情况 国外制药企业在我国开展或参与开展的抗肿瘤药临床试验共计 309 项,其中 296 项是由国外制药企业单独申办,包括国际多中心试验226 项和单独在我国开展的试验 70 项; 而国内申办、国外制药企业参与合作的项目只有 13 项,全部在我国单独开展( 表 2) .2005 - 2013 年,国外制药企业每年在我国开展的抗肿瘤药临床试验整体上稳步上升,其中数量增加最多的年份为 2009 年,共 46项,而 2014 年则较少,只有 18 项( 图 1) .
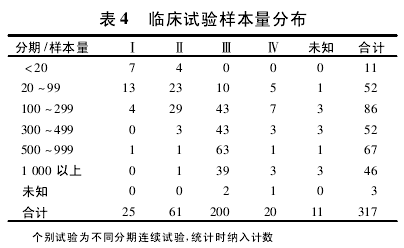
3. 2 试验规模 我国、美国与欧盟对于临床试验样本量的规定如表 3[8].在预期样本量上,多数试验都为 100 ~300 例; 在不同试验分期的样本量选择上,与规定或建议的样本量相比,其规模多数普遍较大( 表 4) ,所有试验对受试者需求量达 183 947人次( 包括已完成试验入组数量和在研项目的预期数量) .
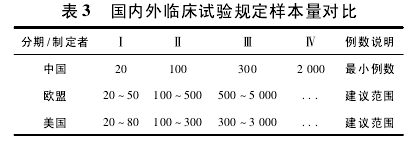
而对于临床试验的时间跨度来说,整体上时间跨度都相对较长,最长的达 15 年之久,这与抗肿瘤药临床试验自身的特点有关。多数试验时间集中在3 ~ 6 年,其中 4 年的最多,达 64 项( 图 2) .
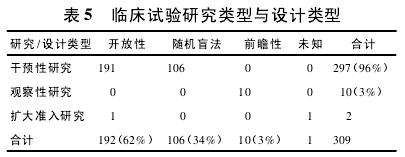
3. 3 试验设计与研究类型 国外在我国在研的抗肿瘤药物临床试验中,试验类型包括开放性、随机盲法、前瞻性试验等,其中开放性试验 206 项,占绝大多数,盲法试验 108 项,前瞻性试验 16 项。
总体上,试验设计以开放性试验为主,这可能与抗肿瘤药物难以找到合适的安慰剂以及难以双盲这种特殊性有关[5].而研究类型多数为干预性研究,共 297 项。其他为观察性研究 10 项,扩大准入研究 1 项( 表 5) .