3. 4 试验进展情况 国外制药企业在我国开展的抗肿瘤药临床试验中,在研且正在招募的试验 71项,在研而未在招募的 102 项,已完成的 120 项,中止 13 项( 图 3) .其中,60%以上的试验是其试验药物在国外上市之后在我国开展,与国外同步进行的试验较少,共 21 项。整体上,制药企业开展抗肿瘤药临床试验的进度滞后于国外。对于试验分期情况,最多的为Ⅲ期试验,共 200 项( 63%) ; Ⅱ期试验次之,共61 项( 19%) ; Ⅰ,Ⅳ期试验较少( 表6 ~7) .
这与我国对于药物临床试验的要求有关,《药品注册管理办法》要求必须是开发进入Ⅱ期后的新药才可以在中国申请国际多中心临床试验[9],其附件 2对临床试验的要求中规定“属注册分类3 和4 的,应当进行人体药动学研究和至少 100 对随机对照临床试验”[8],这两方面可能是导致国外制药企业在我国开展的抗肿瘤药临床试验多为Ⅲ期的主要原因。
3. 5 试验药物 国外制药企业在我国开展的抗肿瘤药临床试验涉及的抗肿瘤药物共 102 种。截止2015 年 3 月 6 日,83 种已在国外上市( 除 1 项上市时间为 1986 年,其他已上市抗肿瘤药上市时间均在1992 年以后) .其中,有 68 种在美国 FDA 注册上市,19 种在国内外正处于研发阶段。笔者通过检索美国FDA 网站得知,1991 年至 2015 年 3 月 6 日,其审批通过的新分子实体抗肿瘤药物共计88 种,2005 年后审批通过的53 种[10].在所截取的数据中,国外制药企业在我国进行的新分子实体抗肿瘤药临床试验包括其中的47 种,共 208 项临床试验,而同阶段这 47 种新分子实体在美国开展的临床试验数量为2322 项( 表8) .
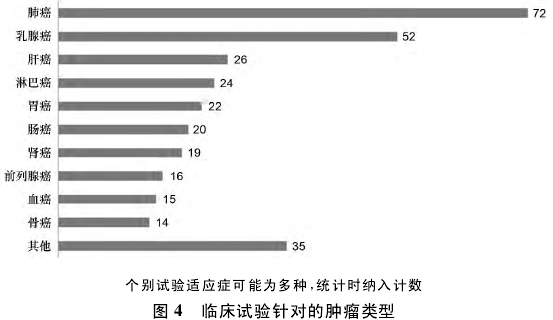
3. 6 肿瘤类型 在肿瘤类型方面,国外制药企业在我国开展的抗肿瘤药临床试验数量包括 23 种肿瘤疾病。排名前 10 位见图 4,数量最多的是肺癌和乳腺癌,分别为 72 项( 23% ) 和 52 项( 17% ) ,其次是肝癌和淋巴癌等。这与国际国内癌症发病率和死亡率的数据吻合,WHO 刚刚发布的数据显示,2012 年男性 5 个最常见确诊癌症是肺癌、前列腺癌、结肠直肠癌、胃癌和肝癌,女性 5 个最常见确诊癌症是乳腺癌、结肠直肠癌、肺癌、宫颈癌和胃癌,而其后发布的《全球癌症报告 2014》关于中国的数据显示,在我国,肺癌成为发病率第 1 位的恶性肿瘤,病例总数达 652 482 例,乳腺癌 187 213例。在女性群体中,乳腺癌与肺癌的病例数目不相上下,成为女性最大的杀手。巨大的市场需求在一定程度上刺激了国外制药企业的抗肿瘤药研发偏向肺癌和乳腺癌领域。
3. 7 临床试验申办者情况 对于试验的申办方来说,共有 36 家国外制药企业先后在我国开展抗肿瘤药临床试验,其中以罗氏、诺华、辉瑞等为代表的少数国际制药巨头占据了试验总量的绝大部分,其中诺华 44 项( 13. 5%) 、罗氏 38 项( 11. 7%) 、辉瑞 36项( 11. 0%) 、阿斯利康 26 项( 8. 0%) 、拜耳 25 项( 7. 7%) 、葛兰素史克 21 项( 6. 4%) 等,占总数量的60% ,其试验研究的肿瘤类型也多数集中在肺癌、乳腺癌等领域( 表 9) .总体上呈现数量和研究领域分配不均的格局,少数国际大型制药企业占据大多数临床试验资源,同时试验研究的领域集中在肺癌、乳腺癌等死亡率和发病率较高领域,其他大多数制药企业及研究机构则分散在抗肿瘤药物其他领域。
4 结论
通过对 ClinicalTrials. gov 注册数据的统计与分析,笔者对于国外在我国开展抗肿瘤药临床试验的现状进行分析得出以下结论。
4. 1 我国抗肿瘤药临床试验水平仍未得到国际完全认可 就 ClinicalTrials. gov 注册数据的来看,首先,虽然我国开展的抗肿瘤药临床试验总量已是继欧美之后最多的地区,但与欧美发达国家相比总量仍相差很大,由制药企业开展的抗肿瘤药临床试验数量即使和东亚其他国家相比也不在前列,而对于由国外制药企业在我国开展的试验项目来说,其数量更少,并且 96%的试验项目都由国外单独申办开展,国内制药企业及科研单位参与申办的甚少。同时,对于在 FDA 上市的新分子实体抗肿瘤药物来说,虽有一半药物已在我国开展临床研究,但其试验数量与同期在美国开展的数量相差甚远,其比例为0. 09∶ 1,可见我国抗肿瘤药临床试验总体水平尤其是在肿瘤创新药临床研究方面,接触的数量相对较少,与国际发达国家水平相差很大,未得到国际完全认可。
4. 2 我国抗肿瘤药临床试验资源有待开发 从WHO 数据看,我国癌症发病率和死亡率居世界前列,具有丰富的潜在抗肿瘤药受试者群体。同时,截止 2014 年底,全国有 156 家具有肿瘤专业临床试验资格认证的医疗机构,其中未包括正在认定的医疗机构[11].而在所截取的数据中,15 年间,国外制药企业在我国开展的抗肿瘤药临床试验累计受试者总需求量也不过 18 万余人,参加试验研究的中心一般在 10 ~30 家。有数据显示,全球患者的贡献程度美国占 41%、德国 7%、法国 4%、英国 4%,而中国占的比例不足 1%,全球排名大概在 25 或 26 位[12].可见在我国,无论是抗肿瘤药临床试验的潜在受试者资源还是医疗资源都未充分利用,仍有待开发。
4. 3 临床试验研究进度相对滞后,试验分期阶段性集中 与国外相比,国外制药企业在我国开展抗肿瘤药临床试验有 60% 以上都是试验药物在国外上市之后才在我国启动开展,与国外同步开展的试验仅占 7%,研究进度明显滞后于欧美发达国家。同时,在所有的抗肿瘤药临床试验中,有 60% 以上为Ⅲ期试验,其他阶段的试验数量较少,尤其是Ⅰ,Ⅳ期试验,仅占 8% 和 6%,试验分期出现阶段性集中的现象。《药品注册管理办法》规定,开发进入Ⅱ期后的新药才能在我国申请国际多中心临床试验[8],这限制了Ⅰ期临床试验的开展。Ⅰ期临床试验是药物临床试验的起步阶段,是后期临床试验的基础,国外制药企业在我国开展Ⅰ期抗肿瘤药临床试验,有利于我国对抗肿瘤药临床试验的全程把控和对于药物安全有效性的全面理解。因此,如何吸引鼓励国外申办方在我国开展更多的Ⅰ期临床试验,也是一个值得思考的问题。
5 结语
国外抗肿瘤药临床试验多属国际前沿药物,国际发达国家进驻中国进行抗肿瘤药临床试验,可以使我国更多地踏足国际前沿抗肿瘤药物研究领域,获取更多信息。同时,也有利于我国吸收和借鉴其先进的肿瘤新药的研究设计思路和临床试验操作管理模式,从而提高我国抗肿瘤药研发能力和管理水平。此外,对我国肿瘤患者来说,特别是肿瘤复发、难治的患者,参加国际前沿的抗肿瘤药临床试验,可以接受先进抗肿瘤药物治疗,可能会有收益。近几十年,药物研发周期不断延长、欧美临床试验费用不断攀升,东亚地区人口基数大、研究成本低廉,药品消费市场庞大[12],欧美发达国家将药物研发转向东亚地区成为必然趋势,我国作为东亚地区最大的发展中国家,有着巨大的机遇。但就国外在我国开展抗肿瘤药临床试验的现状来说,其数量并不多且覆盖的疾病领域也不够全面,同时又缺少前期试验,丰富的临床试验资源未被充分利用。如何在这巨大的机遇面前抓住机会,一方面需要加强医疗机构建设,提高抗肿瘤药临床试验水平和承接国际临床试验的能力; 另一方面需要从政策和相关管理规范的完善和改进入手,包括完善 GCP 以同世界接轨,缩短审评时限、适当放开对国际多中心临床试验的限制以消除进入壁垒等,从内部质量和外部环境为国际抗肿瘤药临床试验的进入创造更舒适的条件,从而吸引更多的国际抗肿瘤药临床试验在我国开展,只有如此,才不会与机遇失之交臂,达到国际化标准。
[ 参 考 文 献 ]
[1] WHO. Media centre. Fact sheet N°297[EB/OL]. [2015 -02 -02].
[2] WHO. Cancer country profiles 2014 [EB/OL]. [2015 - 02 -03].
[3] 杨志敏,温宝书,史继峰,等。 国际多中心临床试验在中国申报和审评状况研究[J]. 中国医药工业杂志,2009,40( 2) :155 - 157.