生物技术是从上个世纪末开始兴起的综合学科。被认为是21世纪科学技术的核心之一。它与新材料、新能源技术与微电子技术形成了影响未来国际民生的四大科学体系。在医药领域,生物技术得到了长足的发展与进步。在诊断、预防和治疗人类重大疾病等方面发挥了极其的重要作用。下面是医学生物技术论文8篇,供大家参考阅读。
医学生物技术论文第一篇:医药领域中CRISPR-Cas9技术应用现状与问题
摘要:CRISPR-Cas9是存在于细菌和古细菌中的一种抵御噬菌体或质粒侵染的获得性免疫防御系统,它由成簇规律间隔短回文重复基因序列(clustered regularly interspaced short palindromic repeats,CRISPR)和Cas(CRISPR-associated)蛋白组成。天然的II型CRISPR系统已经被改造成第三代基因编辑工具,将单链向导RNA(single-guide RNA,sgRNA)和作为DNA内切酶的Cas9蛋白导入细胞内,即可在基因组特定位置上进行基因编辑。由于CRISPR-Cas9具有简便高效、脱靶效应低等特点,目前已被广泛应用在动物、植物、微生物的生理和病理研究以及药物研发等领域。本文着重讲述了CRISPR-Cas9的作用机制以及它在医药领域中的应用,包括构建生物模型、疾病治疗、药物靶点筛选和CRISPR与免疫疗法的联合应用。
关键词:CRISPR-Cas9; 基因编辑; 构建生物模型; 药物靶点筛选; 联用免疫疗法;
CRISPR-Cas9 and its application in medical field
SUN Mingyao BAI Wei LIANG Hongyu ZHAO Qiurong ZHANG Yuerong XU Weizhuo
School of Pharmacy,Shenyang Pharmaceutical University School of Functional Food and Wine,Shenyang Pharmaceutical University
Abstract:CRISPR-Cas9 system,consisting of clustered regularly interspaced short palindromic repeats(CRISPR)and CRISPR-associated(Cas) proteins,is an acquired immune system that confers resistance to foreign genetic elements such as plasmids and phages.The natural type II CRISPR system has been transformed into a third-generation gene editing tool,which can conduct gene editing at specific positions in the genome by introducing single-strand guide RNA(sgRNA) and Cas9 protein as DNA endonuctase into cells.Due to its characteristics of simplicity,efficiency and relatively low off-target effect,CRISPR-Cas9 has been widely used in the physiological and pathological research of animals,plants and microorganisms as well as drug′s research and development.This review focuses on the mechanism of CRISPR-Cas9 and its application in the medical field,including the construction of biological models,disease treatment,drug target screening and its combination with immunotherapy.
2012年,第三代基因编辑技术——CRISPR-Cas的发现震撼了整个基因编辑领域,它是继锌指核酸酶(zinc finger nuclease,ZFN)[1]和类转录激活因子效应物核酸酶(transcription activator-like effector nuclease,TALENs)[2]之后的又一个如日中天的基因编辑工具。CRISPR-Cas9系统原本是一种细菌和古细菌在数十亿年进化历程中产生的获得性免疫系统,用于防御外源核酸的入侵[3,4,5]。早在1987年科学家就在大肠埃希菌基因组中发现了成簇规律间隔短回文重复序列[6],自此之后的大量研究表明大约有40%的细菌和90%的古细菌中都含有CRISPR-Cas9系统[7]。
作为新一代基因编辑技术,相较于ZFN和TALENs,CRISPR-Cas9系统具有结构简单、操作便捷、脱靶效应低、特异性强、效率高且价格低廉等优势[8]。CRISPR-Cas9技术的应用并不局限在基因编辑领域,由于在新药研发和疾病治疗等过程中药物与药物靶点结合的高效性至关重要,CRISPR-Cas9技术的优势也因此能在医药科研领域中得以完美地展现,CRISPR-Cas9技术通过基因敲除或敲入、定点替换以及同源重组等方式[9],使药物研发者能更加高效地筛选药物作用靶点,加速新药研发进程。
1 CRISPR-Cas9系统的结构与作用机制
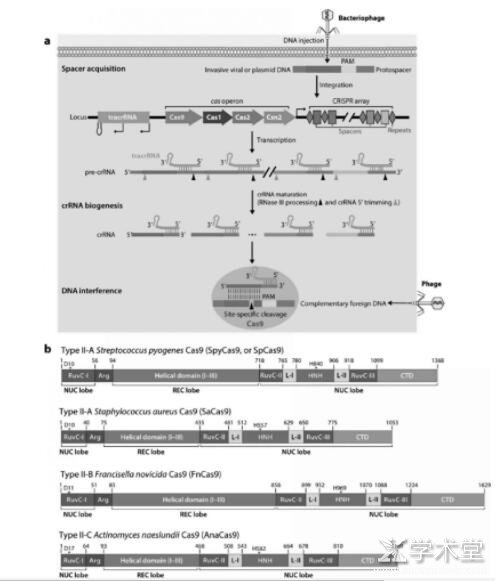
如今,根据 CRISPR 系统中Cas蛋白的种类和同源性,CRISPR系统被分成Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五种类型[10,11],其中最简单且应用最广泛的是Ⅱ型的CRISPR-Cas9系统。在Ⅱ型CRISPR-Cas9系统中,典型的CRISPR基因由一系列保守的重复序列和分散在其间的来源于病毒或质粒等外源DNA的非重复间隔序列(见图1),以及一组Cas基因的操纵子组成。位于Cas操纵子之前的是反式激活CRISPR RNA(trans-activating RNA,即tracrRNA)基因,tracrRNA与Cas操纵子的转录各自独立进行。
1.1 CRISPR-Cas9作为细菌或古细菌的免疫系统的作用机制
天然的CRISPR-Cas9系统介导的免疫机制分为整合(integration)、转录(transcription)和干扰(interference)三个阶段。在整合阶段,当含有CRISPR-Cas9系统的菌体遭遇噬菌体或质粒侵染时,细菌或古细菌通过Cas1、Cas2和Csn2将入侵的DNA作为新的间隔基因整合到CRISPR阵列(CRISPR array)中[12]。在整合后的转录阶段,新的间隔基因将与所有其他间隔基因转录生成一个前体CRISPR RNA(precursor CRISPR RNA,pre-crRNA),其中包含重复序列和间隔序列。tracrRNA的转录独立于Cas操纵子进行, 它与前体crRNA结合并通过RNase Ⅲ限制性内切酶的活性切割前体crRNA,使crRNA成熟[13],起到激活crRNA的作用。在干扰阶段,当相同的噬菌体或质粒再次侵染该菌体时,成熟的crRNA-tracrRNA复合物与Cas9结合并引发一系列变化。首先CRISPR-Cas9复合物中crRNA-tracrRNA复合物与外源性DNA通过碱基互补配对进行特异性结合[14],然后Cas9的HNH结构域和RuvC结构域发挥其限制性核酸内切酶的作用,各自切割外源DNA双链的一条链,形成DNA双链断裂(DSB)[15,16]。另外,若使Cas基因发生点突变,使位于RuvC亚基或HNH亚基的催化中心部位的氨基酸残基D10或H840改变,则使Cas9转变成只能使目标DNA分子发生单链断裂(SSB)的DNA切口酶;而如果两个亚基催化中心同时改变,Cas9则变成只保留与外源DNA结合能力而无法进行酶切的dCas9 (“dead”Cas9)[3]。
图1 在细菌的获得性免疫中由CRISPR-Cas9介导的DNA干扰。(a)CRISPR-Cas9作为细菌或古细菌的免疫系统的作用示意图;(b)不同亚型的典型Cas9基因示意图,其中星号D10和星号H840表示Cas9酶分子中保守的介导DNA裂解的催化中心
图2 CRISPR-Cas9介导的基因编辑的作用机理
1.2 人工构建的具有基因编辑功能的CRISPR-Cas9系统的结构与作用机制
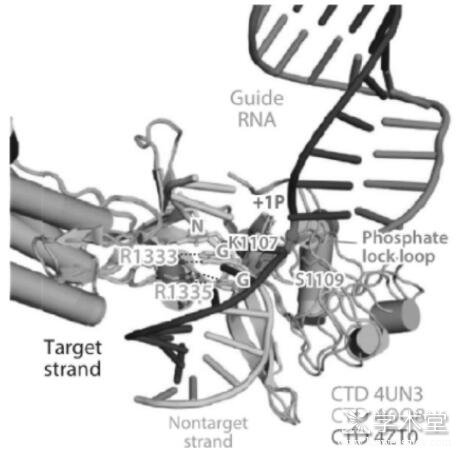
被人工改造而作为基因编辑工具的CRISPR-Cas9系统较天然的CRISPR-Cas9系统在RNA分子结构上稍做修饰但作用机制大同小异,前者将crRNA和tracrRNA合并成一条约100 nt的sgRNA[3],sgRNA包含20 nt与目标DNA分子互补的RNA序列。当CRISPR-Cas9系统被直接注射或通过病毒搭载进入目标细胞并发挥作用时,Cas9蛋白首先与sgRNA结合并经历构象重排转变成适合目标识别的构象[14],然后sgRNA的互补区域也变构形成A型螺旋以便与互补的目标DNA链相结合。接下来Cas9通过多个协同步骤被进一步激活,首先PAM——其序列为NGG(N代表任一碱基)与CTD结构域的第1333位和1335位的精氨酸残基通过多条氢键与GG序列相互作用并识别(见图3)[17,18],接着局部DNA分子解开双螺旋,磷酸锁定环(Phosphate lock loop)与目标链解旋区的第一个磷酸基团相互作用并使之发生扭转[17],sgRNA链侵入并与目标链互补结合,不与sgRNA 互补的非目标链被逐步替换并形成R环(R-loop)结构,最后通过HNH结构域的构象变化对RuvC结构域进行变构调控,以协同DNA切割。最终形成的DSB可以通过两种途径修复:非同源末端连接(nonhomologous end joining,NHEJ)[19]和同源重组型修复(homology-directed repair,HDR)[20],前者会导致目标基因发生随机的插入、缺失或替换突变,适用处于分裂期和非分裂期的细胞;而后者则利用提供的供体DNA(donor DNA)作为模板与靶位点重组,从而引入需要的序列,但此法仅适用处于分裂间期的S期和G2期的细胞。
2 CRISPR-Cas9技术在医药领域中的应用
2.1 构建动物模型和细胞系模型
测试药物的性质需要进行药理学实验,因此就需要构建相应独特的动物模型或细胞模型。而应用CRISPR技术可以拓宽动物模型的构建渠道,利用传统方式构建小鼠模型需要借助基因工程和抗生素筛选,再经过受精卵发育,然后再将基因编辑过的模式小鼠与同种小鼠进行10代以上的多次杂交才能获得相应遗传背景的模型小鼠,整个过程往往需要耗时数年。相比之下 CRISPR-Cas9 技术则可以通过直接对受精卵进行基因编辑,因不必进行多次杂交而大大缩短了构建动物模型的时间,快者仅需数月。因此,CRISPR-Cas9 技术已被广泛地应用于动物模型的构建。
图3 PAM被CTD结构域结构域识别以及磷酸锁定环作用的示意图
抗癌药物是目前新药研究的热门领域,迄今为止利用CRISPR-Cas9技术已经成功构建了小鼠肺癌[21]和肝癌模型[22]。前者运用AAV载体(adeno-associated viral vector,腺相关病毒载体)搭载CRISPR-Cas9复合物构建在肺中产生p53基因缺失突变、Lkb1基因突变以及HDR介导的Kras G12D基因突变的模型小鼠,可以对肺癌进行病理学模拟并帮助科学家更深层次的理解肺癌的病理机制;后者将编码 Cas9和sgRNA的质粒递送到肝脏,通过靶向敲除抑癌基因p10和p53来构建肝癌模型,为肝癌研究作出贡献。近年来,全球各地的研究者在多能干细胞、成体干细胞、生殖干细胞、造血干细胞以及单倍体干细胞中成功进行了CRISPR介导的基因编辑,所获得的模式生物包括小鼠[23]、斑马鱼[24]、酵母[25]、拟南芥[26]、果蝇[27]等,促进了现代生物医学的病理研究。
利用CRISPR-Cas9技术还能以最低概率的脱靶效应干扰人类原代CD4+T细胞和HSPCs(造血干细胞)中的B2M和CCR5基因的表达,且能保留HSPCs的多向分化潜力,其高效性对艾滋病的临床治疗有重要意义[28]。由此表明,CRISPR-Cas9技术在造血干细胞疗法中具有确实的可行性。于海川等人应用CRISPR-Cas9技术对研究红系造血分化调节机制的最佳模型细胞——K562细胞中造血转录因子GATA-1基因成功的进行了敲除,其可用于研究后续的造血分化机制[29]。杜氏肌萎缩症是常见的儿童致死性遗传病,DMD基因的突变破坏了正常基因的阅读框架,导致了杜氏肌萎缩症。Young等人对人类诱导性多能干细胞(hiPSC)应用CRISPR技术介导了迄今为止范围最大的DMD基因的敲除,发现重新构建的hiPCS中的抗肌萎缩糖蛋白复合物得到修复,此项实验证明用CRISPR-Case9技术来纠正大多数DMD患者基因的移码突变是可行的[30]。
2.2 用于疾病治疗
目前基因编辑技术正处于一个发展非常迅速的时期,近年来关于利用CRISPR-Cas9技术在实验动物或人体的临床试验上进行特异性基因编辑的成功报道数量激增,这些实验表明该技术具有相当大的潜力可以帮助治疗癌症、病毒感染等类型的疾病。CRISPR-Cas9技术在医疗领域的应用有望推动多项疾病治疗的研究。
2.2.1 CRISPR-Cas9系统在癌症中的应用
我国四川大学附属华西医院的卢铀教授团队开展了全球第一例应用CRISPR-Cas9技术治疗非小细胞肺癌的人体临床试验,该团队于2016年11月对常规治疗无效的患者进行了应用 CRISPR 技术改造T 细胞的治疗,他们将病人的 T 细胞提取出体外后对PD-1基因进行敲除,随后筛选敲除成功的细胞重新注射回患者体内,触发患者的免疫反应以清除肿瘤细胞,此次治疗进展顺利,该患者将准备接受第二次注射治疗[31]。大量的实验证实由人乳头瘤病毒(HPV)感染引起的宫颈癌细胞的生长依赖于HPV E6和E7蛋白的表达,因此抑制E6和E7mRNA转录[32,33,34,35]是治疗宫颈癌的有效方法之一。Edward M.Kennedy等人在 HPV-16 和 HPV-18 细胞系中,通过CRISPR-Cas9系统敲除 E6和 E7 两个基因后发现细胞的P53和PRb基因表达水平恢复正常,从而导致了宫颈癌细胞的程序性死亡[36]。目前国内学者利用CRISPR-Cas9技术在人慢性髓系白血病K562细胞中进行基因敲除,通过抑制LSD1的表达来降低K562等恶性细胞的增殖速率[37]。近期也通过实验证明这是由K562细胞增殖周期发生改变、进入DNA复制期和分裂期的细胞减少所导致,而与细胞凋亡水平的变化无关。此方向的研究有望推动慢性髓系白血病等癌症在治疗方法上的拓展[37,38]。
2.2.2 CRISPR-Cas9系统在病毒感染疾病中的应用
乙肝病毒(HBV)是人类肝脏疾病的主要病原体之一,如今全世界有超过4亿人感染乙肝病毒,许多HBV患者最终都会患上严重的疾病,如肝硬化和肝细胞癌,然而由于HBV的共价闭环DNA(cccDNA)高度稳定,以前的抗病毒治疗并不能治愈HBV感染而且在治疗停止后还会复发。现有的研究证实,CRISPR-Cas9系统作为一种新疗法能够在体外或体内剪切HBV的cccDNA,实验结果显示经CRISPR-Cas9处理的小鼠肝脏中几乎没有HBV表面抗原HBsAg呈阳性的细胞,从而达到治愈乙型肝炎的目的[39,40,41]。但是目前CRISPR-Cas9技术在丙肝病毒的治疗中并未体现出优势[42]。HIV-1是另一种给人们的生命安全带来巨大威胁的病毒,某些哺乳动物蛋白如APOBEC3G(A3G) 和 APOBEC3B(A3B)可以抑制HIV-1的复制,但这些蛋白通常不会在相关靶细胞中表达。然而实验数据表明,同时导入两分子sgRNA可以显著增强T细胞中的A3G和A3B基因的表达并抑制 HIV-1的复制[43,44]。疱疹病毒是一类可导致显著的发病率和死亡率的DNA病毒,其中单纯疱疹病毒1型(HSV-1)可以引起唇疱疹和单纯疱疹角膜炎;单纯疱疹病毒2型(HSV-2)可引起生殖器疱疹;人巨细胞病毒(HCMV)是导致先天性缺陷的最常见的病毒影响因素;Epstein-Barr病毒(EBV)与传染性单核细胞增多症和多种恶性肿瘤如Burkitt淋巴瘤和鼻咽癌等有关。由于疱疹类病毒能够在人体内建立潜伏期,目前的核苷类似物类药物治疗在从宿主中清除这些病毒方面并无显著效果,然而利用CRISPR-Cas9系统可以有效地靶向疱疹病毒基因组,作为一种有效地预防和治疗策略用于削弱疱疹病毒的复制和清除潜在的病毒感染。实验结果显示,将sgRNA靶向于对病毒重要的基因可以有效地消除HCMV和HSV-1;同时使用多个sgRNA靶向HSV-1甚至可以完全消除人类细胞中感染性颗粒的产生;同样的方法几乎也可以完全清除潜伏感染的EBV[45,46]。
2.2.3 CRISPR-Cas9系统在其他疾病中的应用
将包含能表达sgRNA和Cas9基因的腺病毒载体导入小鼠肝脏中,对Pcsk9基因引入插入或敲除突变,可以显著降低小鼠的胆固醇水平,并达到根治高胆固醇症的目的,另外此研究还表明该方法也有望应用于预防人类心血管疾病[47,48]。CRISPR-Cas9技术的优势也在研究眼部疾病中得以凸显,近几年有持续的研究证实将AAV介导的CRISPR-Cas9系统运送到视网膜光感受器并破坏Nrl基因,可以使视杆细胞获得了视锥细胞的部分特性,并且提高了视杆细胞在Nrl基因突变存在下的生存能力,从而预防了视锥细胞的二次退化而造成失明[49,50]。此外,CRISPR-Cas9还可以结合电穿孔技术在大鼠视网膜下注射sgRNA-Cas9质粒复合物来特异性破坏Rho S334等位基因,从而纠正视网膜营养不良并改善视觉功能[51]。
2.3 药物靶点的筛选与靶向治疗
药物靶点的筛选和鉴定是新药研发历程中至关重要的一步,相较于传统的基因编辑技术和RNAi(RNA 干扰)技术,CRISPR具有显著的操作简单快捷,成本低,脱靶效应低等优势。Yegor smurnyy等人利用新一代耐药克隆测序和CRISPR-Cas9介导的基因编辑技术开展验证药物靶点实验,他们通过基因编辑破坏功能性HPRT1基因或在ERCC3基因上引入点突变,结果使细胞产生了耐药性[53],说明针对细胞的耐药性研究可以从HPRT1和ERCC3基因着手。此外,将CRISPR-Cas9应用于单倍体细胞模型KBM7,证明CRISPR-Cas9技术可用于针对显性和隐性耐药性基因的验证[52]。
除此之外,CRISPR技术还可以被用来制造高安全性的靶向治疗系统。如近年来,癌细胞的自主归巢特性成为靶向肿瘤研究的热门方向,癌细胞的自主归巢是指散播到循环系统的癌细胞以及转移灶释放的癌细胞可以返回原发病灶,这实际上是一个肿瘤筛选更强癌细胞的过程。Reinshagen等人利用CRISPR技术敲除癌细胞的死亡受体基因DR,被改造的癌细胞能够释放诱导癌细胞凋亡的配体ST,这种配体是一种肿瘤坏死因子(TNF)的分泌变体,它能够在多种不同类型的癌症中有效地诱导细胞凋亡,而对正常细胞不会产生影响,因此是一种极具发展前景的抗肿瘤药物。将患有乳腺癌小鼠的ST敏感型癌细胞经过CRISPR改造后的成为递送ST的载体,即改造后的癌细胞可以靶向原发病灶中癌细胞,将其运用于治疗复发性和转移性肿瘤,实验结果显示经用此法治疗的小鼠肿瘤有明显缩小。此技术有望在未来用于临床病人使用自体癌细胞来治疗多种类型的癌症[53]。
2.4 联合免疫疗法治疗癌症
自1893年美国医生William Coley意外发现病人术后受到酿脓链球菌感染后可以导致癌症的消退,免疫疗法发展至今已如雨后春笋,方兴未艾。如今,将CRISPR-Cas9技术与免疫疗法结合可以有效的治疗癌症。Levi 等人发现PD-L1基因的表达会抑制嵌合抗原受体T(chimeric antigen receptor-T,CAR-T)细胞的肿瘤清除效应,因此将 sgRNA 通过慢病毒转导融合进入细胞基因组,从而获得PD-L1 缺陷的CAR-T细胞,改善了其对胰腺癌细胞的清除能力,说明了精确的基因编辑技术可以增强下一代免疫疗法的效果[54]。宾夕法尼亚大学医学院的Saar Gill博士以及美国国立卫生研究院的Cynthia E.Dunbar博士带领的团队首创了一种用CAR-T 细胞治疗急性髓系白血病(Acute Myeloid Leukemia,AML)的新方法,他们利用CRISPR-Cas9来敲除健康的造血干细胞中的CD33基因,缺失CD33基因的干细胞同样能够发挥正常功能,这使得CD33分子成为白血病细胞的唯一标记,因此靶向CD33分子的CAR-T细胞疗法就能够轻松绕过造血干细胞识别并且攻击癌细胞,同时又不会损伤健康的造血干细胞[55]。
3 CRISPR-Ca9技术存在的问题与近况
持续的机理研究和不断扩大的应用前景使CRISPR-Cas9技术正在推动一场生物技术革命[56]。尽管如此,CRISPR-Cas9技术仍存在许多有待解决的问题,例如脱靶效应、靶向平台范围较窄、NHEJ修复机制对HDR修复机制的竞争以及伦理问题等等。但与此同时,全世界的科学家们也在逐步地修复或解决上述问题。
3.1 脱靶效应
虽然CRISPR-Cas9系统比前两代的基因编辑工具都要高效,但它目前还存在一个限制其发展的重大缺陷——脱靶效应[57]。目前有学者表明由于癌细胞系的基因组和DNA修复机制与正常体细胞不同,所以以往在癌细胞系里研究Cas9的脱靶效应并将结果外推至正常的组织细胞的做法是存在问题的。对此,Bradley等人改用具有正常染色体组数和DNA修复机制的小鼠胚胎干细胞来研究Cas9对DNA造成意外损伤的程度。其实验结果显示sgRNA-Cas9可以在目标编辑位点附近造成数千碱基对的大规模丢失以及复杂的DNA重组[58]。
目前已有多个高保真性Cas9突变体对此做出了改善——它们的脱靶效应非常低,然而它们多数对目标序列的切割效率也相对较低。Zheng等人采用分子动力学模拟的方法,对spCas9和高保真性Cas9突变体进行了动力学研究。研究发现,突变导致Cas9与R-loop之间的静电作用减弱,因此目标DNA链与sgRNA链结合成异源双链核酸分子的灵活性降低,这可能是异源双链区域错配耐受性降低的原因。此外,突变还会影响Cas9结构域的变构效应,在Cas9突变体中,HNH结构域与RuvC结构域之间的相互作用减弱以及突变体的构象略微开放,导致了Cas9突变体具有较低的对目标DNA的切割效率以及较低的脱靶效率[59]。
但也并非所有的Cas9突变体在降低脱靶效应的同时牺牲了对目标序列的切割效率。近日,博德研究所的David Liu在Nature杂志上报道了一种全新的Cas酶——xCas9,比起目前使用最广泛的Cas9,xCas9在转录激活、DNA剪切、单碱基编辑等方面的应用范围扩大了四倍。与此同时,令人喜出望外的是,xCas9的脱靶效应比spCas9(streptococcus pyogenes Cas9,酿脓链球菌的Cas9)低得多,部分序列的试验数据仅为原始spCas9的百分之一[60]。此外,近期研究报道了另一种变体——spCas9-HF1,spCas9-HF1可以把全基因组的脱靶率降到高通量测序等方法无法检测到的水平,几乎可以消除不同频率的脱靶效应[61]。
3.2 拓宽靶向平台的范围
减少或避免与目标序列的脱靶效应的发生以及扩大对目标DNA分子识别的平台范围对CRISPR介导的临床应用至关重要[62,63],而二者均与Cas9对PAM的识别密切相关[17]。现有的实验结果表明设计Cas9的突变体可以增加CTD结构域结构域对PAM识别的可塑性,例如将Cas9的第1337位氨基酸修改为精氨酸,则其可以识别的PAM序列由5′-NGG-3′转变为5′-NGNG-3′[19]。由此可见,对Cas9与DNA分子作用构效关系的深刻理解以及对Cas9进行分子设计有利于不断拓宽CRISPR的靶向平台范围,进而拓宽CRISPR的应用范围。
3.3 NHEJ修复机制对HDR修复机制的竞争
通过同源重组修复机制(HDR)可以在目标DNA位点上引入需要的DNA序列,使细胞按照人类的意愿表达相应的产物。然而,HDR的修复效率因受到来自其他修复机制(包括非同源末端连接(NHEJ))的竞争而受到限制[64]。对此,M.D.Canny等人报道了一种53BP1基因编码抑制剂。53BP1是真核细胞DSB修复通路的关键调控因子,通过抑制HDR启动的限速步骤——端部切除,而使NHEJ优先于HDR发挥作用。该组实验人员筛选了一种名为i53 ——53BP1抑制剂的变体,使其在人和小鼠细胞中进行表达并阻断53BP1在DNA损伤位点的积累,通过提供双链DNA或单链寡核苷酸供体改善了基因编辑的效率,结果显示其效率与之前相比提高了5.6倍[65]。
3.4 伦理问题
由于CRISPR技术的特殊性——可以通过修改基因从而永久地改变性状,该项技术在发展的过程中就一直向人类的伦理观念提出挑战。治疗疾病是有益的,那么人们能否以此“预防”疾病呢?但一旦“治疗”和“预防”的边界被打开,那么从“预防”到“改善”的窗户纸又会不会被捅破 2015年,中山大学黄军教授在Protein & Cell杂志上发表了一篇对利用CRISPR技术编辑人类胚胎的研究性论文,结果显示CRISPR技术在精确基因编辑的应用上还不够完美[66];而2018年11月26日美联社报道了中国科学家贺建奎改造的CRISPR基因编辑双胞胎婴儿已经在该月出生,此消息当即引发了全国乃至全世界的关注与讨论。目前,大多数科学家认为该项技术仍然不足以被应用于改造人类的基因组,直接在人类个体身上尝试高风险的基因改造实验不仅是不科学的,同时也违反了科学家理应遵守的道德规范。
4 展望
CRISPR技术是目前最高效的基因编辑技术。作为基因编辑工具,CRISPR-Cas9以其结构简单、脱靶效应低等优势揽获了生命科学突破奖,但它不仅是基因编辑领域的一座里程碑,CRISPR也为癌症、病毒感染等疾病的治疗提供了新思路,而且还在发现和验证药物靶标方面展现了具有巨大潜力。近日CRISPR又与多种免疫疗法强强联合,冲破了免疫疗法固有的壁垒,为医疗领域带来了新的曙光。诚然CRISPR技术仍存在缺陷,但随着CRISPR技术的不断完善,CRISPR-Cas9技术定能为人类健康事业作出巨大贡献。
参考文献
[1] BHAKTA M S,HENRY I M,OUSTEROUT D G,et al.Highly active zinc-finger nucleases by extended modular assembly[J].Genome Res,2013,23(3):530-538.
[2] MOSCOU M J,BOGDANOVE A J.A simple cipher governs DNA recognition by TAL effectors[J].Science,2009,326(5959):1501.
[3] JINEK M,CHYLINSKI K,FONFARA I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[4] HELER R,MARRAFFINI L A,BIKARD D.Adapting to new threats:the generation of memory by CRISPR-Cas immune systems[J].Mol Microbiol,2014,93(1):1-9.
[5] MARRAFFINI L A.CRISPR-Cas immunity in prokaryotes[J].Nature,2015,526(7571):55-61.
[6] ISHINO Y,SHINAGAWA H,MAKINO K,et al.Nucleotide-sequence of the iap gene responsible for alkaline-phosphatase isozyme conversion in Escherichia coli and identification of the gene product[J].J Bacteriol,1987,169(12):5429-5433.
[7] HORVATH P,BARRANGOU R.CRISPR/Cas,the immune system of bacteria and archaea[J].Science,2010,327(5962):167-170.
[8] PAUWELS K,PODEVIN N,BREYER D,et a1.Engineering nucleases for gene targeting:safety and regulatory considerations[J].N Biotechnol,2014,31(1):1871-6784.
[9] 单奇伟,高彩霞.植物基因组编辑及衍生技术最新研究进展[J].遗传,2015,37(10):953-973.
[10] 冯红,董阁,雍彬,等.原核CRISPR-Cas系统的结构功能及应用[J].四川学报,2014,37:269-376.
[11] JIANG F G,DOUDNA J A.CRISPR-Cas9 structures and mechanisms[J].Annu Rev Biophys,2017,46:505-529.
[12] HELER R,SAMAI P,MODELL J W,et al.Cas9 specifies functional viral targets during CRISPR-Cas adaptation[J].Nature,2015,519(7542):199-202.
[13] DELTCHEVA E,CHYLINSKI K,SHARMA C M,et al.CRISPR RNA maturation by trans-encoded small RNA and host factor RNase[J].Nature,2011,471(7340):602-607.
[14] JIANG F G,ZHOU K,DOUDNA J A,et al.Structural Biology.A Cas9-guide RNA complex preorganized for target DNA recognition[J].Science,2015,348(6242):1477-1481.
[15] GARNEAU J E,DUPUIS M E,VILLION M,et al.The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA[J].Nature,2010,468(7320):67-71.
[16] HALE C R,ZHAO P,OLSON S,et al.RNA-guided RNA cleavage by a CRISPR RNA-Cas protein complex[J].Cell,2009,139(5):945-956.
[17] JINEK M,JIANG F G,TATLOR D W,et al.Structures of Cas9 endonucleases reveal RNA-mediated conformational activation[J].Science,2014,343(6176):1215-1227.
[18] STERNBERG S H,REDDING S,DOUDNA J A,et al.DNA interrogation by the CRISPR RNA-guided endonuclease Cas9[J].Nature,2014,507(7490):62-67.
[19] LIEBER M R.The mechanism of double-strand DNA break repair by the nonhomologous DNA end-joining pathway[J].Annu Rev Biochem,2010,79:181-211.
[20] SAN F J,SUNG P,KLEIN H.Mechanism of eukaryotic homologous recombination[J].Annu Rev Biochem,2008,77:229-257.
[21] PLATT R J,CHEN S,ZHOU Y,et al.CRISPR-Cas9 knockin mice for genome editing and cancer modeling[J].Cell,2014,159(2):440-455.
[22] XUE W,CHEN S,YIN H,et al.CRISPR-mediated direct mutation of cancer genes in the mouse liver[J].Nature,2014,514(7552):380-385.
[23] SHEN B,ZHANG J,WU H,et al.Generation of gene-modified mice via Cas9/RNA-mediated gene targeting[J].Cell Res,2013,2013(5):720-723.
[24] HWANG W Y,FU Y,REYON D,et al.Efficient genome editing in zebrafish using a CRISPR-Cas system[J].Nat Bio-technol,2013,31(3):227-229.
[25] DICARLO J E,NORVILLE J E,MALI P,et al.Genome engineering in saccharomyces cerevisiae using CRISPR-Cas systems[J].Nucleic Acids Res,2013,41(7):4336-4343.
[26] LI J F,NORVILLE J E,AACH J,et al.Multiplex and homologous recombination-mediated genome editing in Arabidopsis and Nicotiana benthamiana using guide RNA and Cas9[J].Nat Biotechnol,2013,31(8):688-691.
[27] YU Z,REN M,WANG Z,et al.Highly efficient genome modifications mediated by CRISPR/Cas9 in Drosophila[J].Genetics,2013,195(1):289-291.
[28] PANKAJ K M,LEONARDO M F,DERRICK J R,et al.Cowan efficient ablation of genes in human hematopoiet stem and effector cells using CRISPR/Cas9[J].Cell Stem Cell,2014,15(5):643-652
[29] 于海川,吴娇,翟鹏飞,等.基于CRISPR/Cas9技术的GATA-1基因敲除K562细胞系的构建[J].中国细胞生物学学报,2016,38(5):593-602.
[30] YOUNG C S,HICKS M R,ERMOLOVA N V.A single CRISPR-Cas9 deletion strategy that targets the majority of DMD patients restores dystrophin function in hiPSC-derived muscle cells[J].Cell Stem Cell,2016,18(4):533-540.
[31] CYRANOSKI D.Chinese scientists to pioneer first human CRIS-PR trial[J].Nature,2016,535(7613):476-477.
[32] DEFILIPPIS R A,GOODWIN E C,WU L,et al.Endogenous human papillomavirus E6 and E7 proteins differentially regulate proliferation,senescence,and apoptosis in HeLa cervical carcinoma cells[J].J Virol,2003,77(2):1551-1563.
[33] Goodwin E C,YANG E,LEE C J,et al.Rapid induction of senescence in human cervical carcinoma cells[J].Proc Natl Acad Sci.USA,2000,97(20):10978-10983.
[34] THIERRY F,HOWLEY P M.Functional analysis of E2-mediated repression of the HPV18 P105 promoter[J].New Biol,1991,3(1):90-100.
[35] ROMANCZUK H,THIERRY F,HOWLEY P M.Mutational analysis of cis elements involved in E2 modulation of human papillomavirus type 16 P97 and type 18 P105 promoters[J].J Virol,1990,64(6):2849-2859.
[36] KENNEDY E M,KORNEPATI A V,GOLDSTEIN M,et al.Inactivation of the human papillomavirus E6 or E7 gene in cervical carcinoma cells by using a bacterial CRISPR/Cas RNA guided endonuclease[J].J Virol,2014,88(20):11965-11972.
[37] 高洁,任思蕊,王冰蕊,等.利用CRISPR/Cas9 技术敲除 LSD1 基因显著抑制人慢性髓系白血病 K562 细胞的增殖与 CD235a 的表达[J].中国实验血液学杂志,2017,25(5):1327-1333.
[38] 任思蕊,王冰蕊,郭青,等.敲除LSD1基因对人慢性髓系白血病K562细胞周期的影响[J].生物技术进展,2018,8(03):269-273.
[39] ZHEN S,HUA L,LIU Y H,et al.Harenessing the clustered regularly interspaced short palindromic repeat(CRISPR)/CRISPR-associated Cas9 system to disrupt the hepatitis B virus[J].Gene Therapy,2015,22(5):404-412.
[40] SAKUMA T,MASAKI K,ABECHAYAMA H,et al.Highly multiplexed CRISPR-Cas9-nuclease and Cas9-nickase vectors for inactivation of hepatitis B virus[J].Genes to Cells,2016,21(11):1253-1262.
[41] HUANG C Y,PEI J R.The potential and challenges of CRISPR-Cas in eradication of hepatitis B virus covalently closed circular DNA[J].Virus Research,2018,244:304-310.
[42] BUHLE M,KRISTIE B,TRISTAN S,et al.Advances with using CRISPR/Cas-mediated gene editing to treat infections with hepatitis B virus and hepatitis C virus[J].Virus Research,2018,244:311-320.
[43] BOGERD H P,KORNEOATI A,MARSHALL J B,et al.Specific induction of endogenous viral restricition factors using CRISPR/Cas-derived transcriptional activators[J].Proc Natl Acad Sci USA,2015,112(52):7249-7256.
[44] WANG G,ZHAO N,BERKHOUT B,et al.CRISPR-Cas based antiviral strategies against HIV-1[J].Virus Research,2018,244:321-332.
[45]SASKIA I.CRISPR/Cas9-mediated genome editing of herpesviruses limits productive and latent infections[J].PLoS Pathog,2018,59(9):512.
[46] VAN DIEMEN F R,LEBBINK R J.CRISPR/Cas9,a powerful tool to target human herpesviruses[J].Cell Microbiol,2017,19(2),DOI:10.1111/cmi.12694.
[47] DING Q R,STRONG A,PATEL K M,et al.Permanent alteration of PCSK9 with in vivo CRISPR-Cas9 genome editing[J].Circ Res,2014,115(5):488.
[48] WANG X,RAGHAVAN A,CHEN T,et al.CRISPR-Cas9 Targeting of PCSK9 in Human Hepatocytes in vivo[J].Arterioscler Thromb Vasc Biol,2016,36(5):783-786.
[49] MORENO A M,FU X,ZHU J,et al.In Situ Gene Therapy via AAV-CRISPR-Cas9-Mediated Targeted Gene Regulation[J].Molecular Therapy,2018,26(7):1818-1827.
[50] GE X L,XI H T,YANG F,et al.CRISPR/Cas9-AAV mediated knock-in at NRL locus in human embryonic stem cells[J].Molcular Therapy-Nucleic Acids,2016,5:2162-2531.
[51] BAKONDI B,LV W J,LU B,et al.in vivo CRISPR/Cas9 gene editing corrects retinal dystrophy in the S334ter-3 rat model of autosomal dominant retinitis pigmentosa[J].Mol Ther J Am Soc Gene Ther,2016,24(3):556-563.
[52] SMURNYY Y,CAI M,WU H,et al.DNA sequencing and CRISPR-Cas9 gene editing for target validation in mammalian cells[J].Nat Chem Biol,2014,10(8):623-625.
[53] REINSHAGN C,BHERE D,CHOI S H,et al.CRISPR-enhanced engineering of therapy-sensitive cancer cells for self-targeting of primary and metastatic tumors[J].Sci Transl Med,2018,10(449),DOI:10.1126/scitranslmed.aao3240.
[54] RUPP L J,SCHHUMANN K,ROYBAL K T,et al.CRISPR/Cas9 mediated PD-1 disruption enhances antitumor efficacy of human chimeric antigen receptor T cells[J].Scientific Reports,2017,7(1):737.
[55] KIM M Y,YU K R,KENDERIAN S S,et al.Genetic inactivation of CD33 in hematopoietic stem cells to enable CAR T cell immunotherapy for acute myeloid leukemia[J].cell,2018,173(6):1439-1453.
[56] SLAYMAKER I M,GAO L,ZETSHCE B,et al.Rationally engineered Cas9 nucleases with improved specificity[J].Science,2016,351(6268):84-88.
[57] COX D B T,PLATT R J,ZHANG F,et al.Therapeutic genome editing:prospects and challenges[J].Nat Med,2015,21(2):121-131.
[58] KOSICKI M,TOMBERG K,BRADLEY A.Repair of double-strand breaks induced by CRISPR-Cas9 leads to large deletions and complex rearrangements[J].Nature Biotechnology,2018,36(8):765-771.
[59] ZHENG L,SHI J,MU Y.Dynamics changes of CRISPR-Cas9 systems induced by high fidelity mutations[J].Physical Chemistry Chemical Physics,2018,20(43):27439-27448.
[60] HU J H,MILLER S M,LIU D R,et al.Evolved Cas9 variants with broad PAM compatibility and high DNA specificity[J].Nature,2018,556(7699):57-63.
[61] KLEINSTIVER B P,PATTANAYAK V,PREW M S,et al.High-fidelity CRISPR-Cas9 nucleases with no detectable genome-wide off-target effects[J].Nature,2016,529(7587):490-495.
[62] SANDER J D,JOUNG J K.CRISPR-Cas systems for editing,regulating and targeting genomes[J].Nat Biotechnol,2014,32(4):347-355.
[63] TSAI S Q,JOUNG J K.Defining and improving the genome-wide specificities of CRISPR-Cas9 nucleases[J].Nat Rev Genet,2016,17(5):300-312.
[64] HUSTEDT H,DUROCHER D.The control of DNA repair by the cell cycle[J].Nature Cell Biology,2017,19(1):1-9.
[65] CANNY M D,MOATTI N,WAN L C K,et al.Inhibition of 53BP1 favors homology-dependent DNArepair and increases Crispr-Cas9 genome-editingEfficiency[J].Nature Biotechnology,2017,36(1):95.
[66] LIANG P P,XU Y W,ZHANG X Y,et al.CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes[J].Protein and Cell,2015,6(5):363-372.
医学生物技术论文第二篇:人类基因编辑技术的伦理困境与规制措施
摘要:人类基因编辑技术的研究和应用近年来被得到广泛关注,因为对人类种群多样性的挑战、人格尊重和人权隐私、谁有资格决定基因的改变等等存在立场疑惑,所以衍生出诸多伦理和技术风险问题。针对人类基因编辑技术研究的伦理立场,我们讨论“该不该”和“应不应该”的问题,并考虑到科学技术的双重性也基于对生命伦理原则的探讨,我们提出在不出于生殖目的的前提下应该可控的进行基础研究,并在伦理底线的风险规制上做出具体决策分析。
关键词:人类基因编辑; 风险规制; 伦理规范;
Ethical Issues in the Study of Human Gene Editing Technology
CHEN Shi-yu YANG Fang
Academy of Marxism, Anhui Medical University
Abstract:The research and application of human gene editing technology has received wide attention in recent years. Because of the challenges of human population diversity, personality respect and human rights privacy, and who is qualified to determine genetic changes, there are many doubts and ethics. In response to the ethical stance of human genetic editing technology research, we discuss the issue of the necessity, and consider that the duality of science and technology is also based on the discussion of bioethical principles. It is proposed not to be reproductive under the premise of the purpose, basic research should be conducted under control, and specific decision analysis should be made on the risk regulation of the ethical bottom line.
近年来,人类基因操作作为科技发展的新兴产物,在干细胞重组、基因编辑以及胚胎操作等方面有了重大技术变革,由此引发关于生命的思考。由于技术本身的风险以及不同国家、民族、宗教和不同利益群体的价值之间的文化差异,因此人类基因编辑研究成为医学研究的热点。也由于这些原因,这项研究不断面对研究过程中出现的伦理问题。随着现代医学技术的迅猛发展,基因检测技术的应用也逐渐得到推广,在临床上使用基因检测技术的现象也越来越多,而应用于这种选择的基因检测技术所带来的伦理问题也日益明显。
一、人类基因编辑技术及其研究进展
基因编辑技术包括锌指核酸内切酶(ZFN)和类转录激活因子效应物核酸酶(TALEN)以及CRISPR/Cas系统技术。[1]简单来说就是运用CRISPR/Cas技术可以将目标的基因进行靶向修饰,用特定的某种方式引入双链DNA的断裂,即对特定的脱氧核糖核酸DNA片段进行插入或者删除,改变基因组,实现对目标基因的精确修饰,[2]这就意味着其可改变生物体的遗传现状。而CRISPR/Cas编辑技术具有特定位点高、效率高及操作便利的特点,因此具有精准的打靶作用。[3]
2009年初,奥巴马上任后批准了人类胚胎干细胞试验。2014年,Yin等人报道了利用CRISPR/Cas9技术介导的HDR来修复FAH基因点突变治疗遗传性高酪氨酸血症的研究。这个创新性的研究展示了CRISPR/Cas9技术在成功修复体内基因点突变的能力,为CRISPR/Cas9治疗基因缺陷疾病提供了有力的证据。
我国学者黄军就团队等人于2015年3月在《蛋白质与细胞》的杂志上刊发了关于人类受精卵基因编辑的研究论文,在国内外生命科学界犹如一石激起千层浪引发了强烈的探讨。而后,在2015年12月1到3日,在美国华盛顿召开了由中国科学院、美国科学院、美国医学科学院和英国皇家学会组成的“人类基因编辑峰会”。由此引出相关的伦理冲突,并引起相关的重视。
2016年4月,广州医科大学第三附属医院范勇等人在《辅助生殖与遗传学》期刊上称能够利用CRISPR-Cas的靶向技术阻止艾滋病病毒对人类免疫T细胞的侵染。并且该研究获得了伦理准入与审查批准。在2017年8月《NATURE》的报道中获知,在中国深圳国家基因库,美韩国际合作组及我国科学家的通力协作下,第一次成功地利用CRISPR-Cas9系统在人类早期胚胎中对导致肥厚型心肌病(HCM)的基因突变进行了安全修复。
二、关于人类基因编辑的伦理问题
目前,我国的人类基因编辑技术研究还处于早期临床试验阶段,其中包括对糖尿病、心肌梗塞、视网膜变性等疾病的治疗。[4]但目前其对于人类的作用和确切疗效以及运用的安全性都有待考证,因此尚不能在临床广泛推广应用。
但在2018年11月26日,34岁的生物学家贺建奎对外宣布一对“基因编辑婴儿”降生。由于这对双胞胎的一个基因经过修改,她们出生就能抵御艾滋病病毒HIV,此事件震惊中外。随后国家卫健委也做出了相关回应,表示对此事会依法依规处理。从贺建奎事件中我们能够得出的经验教训也启示了所有相关医学研究的活动,需要进行政府的监管审查。生命科技的应用是为了更好的造福人类,是为了给个人做出更多的抉择,而不是以制度的缺失为缺口作为政府做出选择的利用工具。我们也知道,生命伦理学的核心在于关注人,在于保护人的自主性以及内在价值。这就要求我们在医学相关研究制度的建立考量中,加入代理同意的考虑。同时,对于伦理法律问题应该有明确的规章制度。
由此可见我们在此项技术的运用中所面临的伦理问题和伦理审查尚存问题,医学技术的创新是为了使人类拥有更健康的生活,但若是违背了伦理道德就有违科技的初衷。因此这一事件足以引起我们对伦理问题的重视。
第一,基于技术本身的风险。技术风险是指在技术创新过程中由于技术方面的因素及其变化的不确定性导致创新失败的可能性。技术风险中最明确的两个特点是不确定性和后果的严重性,正因技术风险事件时有发生,那么对技术风险的认知和学习就显得更加重要。而技术决策的失误和影响,会给科技本身和人类种族带来不可逆的影响。“如果我们原来关心的是外因导致的危险(来自自然和神),那么今天风险的新的历史本性则来自内在的决策。他们同是社会的建构。”乌尔里希·贝克的社会风险理论包含了丰富的技术风险思想。贝克认为,现代技术风险究其本质是一种人为制造的风险。CRISPR/Cas技术对于基因的修饰并不能保证完全的精准,其基因链中crRNA的序列较短,容易造成基因的脱靶,产生细胞毒性,并由此导致不可逆转的疾病和不可控的遗传,对于人类种群来说具有极大的破坏力。而且,被修改的基因可能存在抵抗流感等其它病毒侵染的可能性,那么我们的随意修改即不符合人文尊重的根本。也就是说,在技术安全性尚未得到明确确保前,如何保障人类种群的正常多样性发展,也成为了争议的主体。随之而来的问题在于,若是由于不合理的滥用或误用,是否会出现“超强基因”,部分对于技术接受度更高的父母是否会选择利用基因编辑技术增强基因“定制婴儿”。那么这样的举动是否会对人类的价值观念和生物进化方式产生影响,以及对于是否有权力进行此项技术的实施主体都未能有相关的规范。因此,我们必须对于技术的实施行为谨慎。
第二,对技术操作相关的医务人员责任管理至关重要。目前的技术研究现状不可否认的说明,基因编辑已经有能力对人类基因做出永久性改变。那么犹如“潘多拉魔盒”一般,若是打开后,究竟会有怎样的后果,会对人类未来造成好的还是坏的社会影响?[5]争论主要围绕在是否会对人类种群的多样性造成损害,以及对人格生命的尊重和基因隐私的保护。从伦理道德的角度,胚胎即人,人即面临受试者,那么就要明确受试者的尊重问题。因此要维护受试者知情权、选择权、安全权等的权益。[6]不仅如此,我们从伦理的角度上来说,医学研究必须考量“接受这项技术的人”的最大利益,而受试者却是婴儿,因此在相关人员审查和操作的过程中,如何保障受试者的最大权益也亟待解决。因上述表达了技术本身的风险问题,那么更要明确责任主体,除了进行更加专业的技术培训外,还要对技术操作相关的医务人员进行道德伦理及法律教育,让其在技术进行中行为更加谨慎。而科研人员应当对于人类基因编辑技术的研究三思而后行,以防剑走偏锋。
另外,在精准医学高度发展的今天,面对基因编辑技术在伦理学上存在的困境,除了落实知情同意原则,在确保隐私安全并服务人类的前提下,应当维护相关科学研究人员的权益,以此才能更好地把技术本身做好,为技术和相关法律的制定而服务。
第三,人类基因编辑技术存在对生命伦理原则的冲击,即强调在那些涉及他人利益的行动或决策中,行动者在未得到他人许可之前不得对他人利益进行干涉。产生相关伦理冲突的原因是由于基因编辑技术的研究取得突破性进展,因由黄军就教授的研究是第一次针对于人体生殖细胞做出的基因编辑尝试,因此直逼伦理底线。但是其论文中注明了该项研究符合《赫尔辛基宣言》的伦理要求以及国家制定的有关法规。说明了这86枚废弃的三核受精卵均来自于中山大学附属第一医院伦理委员会的审查,并且患者提供三核受精卵都签署了知情同意书,并且同意在研究中使用。[7]因此,在此层面的考虑下我国对于人类基因编辑的研究并没有突破伦理红线。在无法预知后果的前提下,这种与人类遗传相关的问题总是与各种权利冲突和社会正义交织在一起,使其对于个体或者种群的决策充满复杂性。于是,和其他生物医学领域的新兴技术出现一样,人类胚胎基因技术在上述两方面会产生巨大的社会分化,带来不平等的伦理争辩,引发对社会大众乃至人类控制的问题,带来更加深远的公平问题。[8]在尊重自主的原则下,尽管基因编辑的技术旨在为消除人类遗传疾病而服务,但是人类种群具有多样性,谁有权利来决定对于未来人类的基因组做出改变或编辑。在面对未知下一代的生活时,我们似乎没有权利决定他们想要怎样的生命。[9]由此引发诸多问题,比如如何保证人类种群的多样性?如何保障人性和人格的尊重?如果可以对基因缺陷进行修饰,是否会出现基因歧视?每个人在工作、择偶时需不需要公开自己的基因,为此又如何确保基因的隐私性?谁应该作为基因编辑的责任承担主体和权利归属?怎样才能体现出生物的个体差别?而根据峰会最后的讨论决定得知,基因编辑技术可以进行可控、有限的基础临床研究,但不能出于生殖目的,并声明禁止改变人类胚胎或生殖细胞。因此,出于不伤害和行善的原则。谁来负责基因编辑的决策,如何确定相关决策的伦理底线,需要进一步的讨论和规范。
三、关于人类基因编辑技术的伦理规制
由于人类基因编辑技术的飞速发展,使人类对自身生命特质的控制日渐便利化,技术化,但生命的技术控制所带来的伦理问题不容小觑。[10]由于贺建奎事件的发生,我们由此暴露出来的监管不足,以及是否该承担此项技术的额外风险值得我们考虑。基于此,我们从技术本身风险以及生命伦理的考量上得知,应对其进行相关伦理规制。
第一,我们需要明确相关的技术准入原则,出于对技术风险的不确定和不可预知后果的考虑,也出于对知情同意的缺乏。[11]由于一些程序的不可操纵性,就一定要让其在实行中透明化,以避免过度的功利化。为了避免过度利益化和商业化引发煽动性的社会舆论,应该进行相关的风险规制。同时,对于伦理审查本身,监督与审查是在此环节中至关重要的一部分。之所以我们要进行伦理审查,大致要在三个方面进行统筹规划,即“控制”、“管理”、“制约”,从大致理解意义上进行的医学研究的伦理审查,其实就是在教育对象上进行道德约束的一种。在道德约束上一旦产生相应的结果,那就实现了在伦理道德的实现上内外在机制的相互作用,也就在结果影响中掌控了伦理审查在教育中的道德失范和价值离散。基于人类共同体的群体安全的考虑,社会组织群体应该构建相关的可以让公众参与进来的平台,明确大众对于人类基因编辑技术的负责任研究。同时举办各种开放性会议及座谈,加强中外交流,以此推动科学家、公众及决策执行者之间的相互交流,进而更加广泛的评估人类基因编辑带给社会的风险,监督科学家更好的研究,做出更好的影响分析,才能更好的为政府制定政策提供依据。[12]因此,不仅要对于基因研究领域做出重点支持,还应该加强法律法规对于伦理指导原则的建设。此外,还要在研究中遵循如下治理原则:应该以促进福祉为原则,保障病人不受到伤害并能从其中获益;遵循信息透明及共享原则;秉承负责任的研究态度;建立在尊重人的基础上;并要求公平公开以及展开良好的跨国合作。[13]美国基因治疗先驱曾提出,满足以下三个条件可以考虑进行人类生殖系基因治疗(1)当体细胞基因治疗的安全有效性得到了临床的验证;(2)建立了安全可靠的动物模型;(3)公众广泛认可。我们可以从中得到启发,在证据和审查机制的基础上,分阶段进行研究。[14]
第二,应当完善技术本身的社会风险应对体系,通过做出与预估分析并提出有效措施加以干预应对。从社会责任感角度来看,也出于技术人员对人类基因编辑技术研究的应用有可能会对社会产生的后果。伦理责任作为社会风险管理的内在着力点,应当增强政府及相关技术管理者的伦理责任意识。以此形成良好的伦理道德风尚,为跨越风险社会提供有效路径。人类基因编辑技术的应用上,需要规定明确的责任伦理主体,进行相关的规范和管控,并择令相关部门进行有效的监管监督。因涉及到重大的生命权利问题,国家的法律法规应尽快出台。在法律层面上,应设立严格的技术门槛和技术伦理审查。其实这项技术在一定程度上扩大了人类对生命的自主选择权,那么什么样的疾病适用于基因修改,基因修改的步骤应遵循哪些原则,权利主体的归属是否有明确的标准都需要斟酌。此外,由于涉及人类种群本体,因此若有相关研究应遵循知情同意的原则。[15]另外,监测技术的部门,要做好相关的研究才能更好地监测这项技术,以防止技术的滥用,并管理有无出现对于生殖系统的编辑错误。人类基因编辑是涉及到全人类基因的大事,因此国家伦理相关的委员会和负责人要做好相关的文化沟通,积极进行多方位的国际交流,并努力让人类基因编辑技术技术在相应伦理的标准下得到广泛认可。目前人类基因编辑技术在全世界层面的认识上都不够成熟,不是通过几次会议或者科普论文就能被大众所接受。基因研究包括基因编辑技术应该树立一个原则,即应该把公众利益优先化,这应该成为不管是法律还是社会层面的最高伦理准则。
第三,应该做出风险防范和法律规制,建立健全法制法规,即伦理和法律的同步规范。众所周知,我们国家在医学可行性方面存在一定的法律滞后。面对医疗技术日新月异的变化,我们迫切需要从道德层面制定合理的规则,以面对新的医疗技术应用。这就要求我们把重点放在参与技术处理的相关人员道德教育上。因为它们不仅关乎家庭的幸福,也关乎社会的稳定。因此,国家和政府层面对机构和人员的审查更加严格并且进行了具体要求。虽然医学界的道德原则已经确立,但仍有一些地方需要改进,这项工作是通过伦理委员会的职能完成的。出于前两个问题的考虑,着眼点于生命伦理的原则,考虑到具有法律风险与责任,因此应该对相关人员采取相应措施。出于生命伦理公正的原则,目前来自科技和产业的需求,大都聚焦于基因编辑技术在医疗等方面的利用。[16]因而其应用的合法性问题现阶段应得到重视。目前我国现存的法律法规主要有《基因工程安全管理办法》、《干胞临床研究管理法(试行)》、《人类辅助生殖技术规范》和《人类辅助生殖技术和人类精子库伦理原则》、《人胚胎干胞研究伦理指导原则》、等。在国际法律范围内,联合国教科文组织成立的“国际生物伦理委员会”颁布的《人类基因组宣言》中也提到,基因研究的基本原则是“保证每个人类的尊严和平等,保护科学家的研究自由,维护人类和谐以及国际合作”。英国采取了个案许可的法律政策,而德国则刚好相反。由此可见对于法律的规范需日趋完善。我国目前对于法律措施和监管方面尚存空白,建议对人类的基因编辑技术研究应该在相关的法律和规范的监管下进行。对允许进行研究的领域做出伦理规范、技术标准和准入门槛,对不允许的领域做出法律和政策的红线。[17]基因编辑技术存在社会风险和法律风险,要求我们确立一定的标准,技术的开发运用要避免使各种冲突暴露在风险之中。应尽快设立专项监管机构,对于技术的试验落实责任追究,[18]构建立体的人类胚胎基因编辑的监管体系,为其带来的伦理风险提供有效的制度保障。合理调整公众、科学及政策的冲突,完善法律体系,找到其中的平衡点。尽管科学家在促进基因编辑技术的社会影响中占主要责任,但是能够让公众深度对话基因编辑还是极度依赖社会媒体及其记者。基因编辑技术法律的出台和政策的制定需要一定的社会条件,因此需要由科学家来主导,推进我国科学家、伦理学家、管理者和公众之间的评估沟通。2017年2月15日,美国国家科学院出台报告。报告称,基因编辑的相关应用应结合自身国情及法律,保证在一定的框架内更好地为人类服务。此外,应该更多的呼吁国际合作,建立严格的监管监督框架,提高对公众的参与决定权,并做好对基因编辑儿童的长期随访。建议设立伦理顾问、公众协商委员会,在技术明确透明化前积极征求社会各方意见,确保公众的参与权及话语权。[19]
第四,对技术研究者和从业者的相关要求和教育,需要同步进行。拿新兴的医学科研技术就基因编辑技术来说,我们可以通过正确的规章制度形式来进行约束。(1)当医学研究人员获得与技术研究相关的原材料时,他们必须确保按照国际公认的研究伦理标准获得生物材料,以审慎的态度充分尊重和保护实验参与者的自主权,知情权和隐私权,确保研究的公益性和非盈利性。(2)医学研究人员在人工操作的处理和处理过程中,如人工辅助生殖采集,在实验过程中推进相关参考标准的制定,以确保结果的有效性,安全性和比较性,积极开展合作,与国际社会交流,参与制定国际标准。(3)坚持相应的职业道德和道德规范,在严格的程序指导下,积极开展临床疗效的研究和评价,坚决杜绝不负责任的技术性滥用行为。(4)在进行临床前研究的过程中,医学研究人员必须严格规范研究过程,自觉接受独立的同行评审和管理监督,确保临床研究能够满足科研和治疗的要求和条件。(5)具有推动医学技术传播的责任,因此需要积极推广和普及相关领域的知识和科技成果,在科技风险问题上与社会公众充分沟通,使之认识到干细胞研究和应用的探索性与风险性,提升公众科学意识和鉴别能力。(6)医学科研人员应该主动承担起服务国家战略的责任,这对于公众提供的咨询意见在医学政策的制定中起着重要的作用。
总之,随着科学技术的不断进步,越来越多的科学手段被运用到实际生活中并与日常生活休戚相关,而生命科学的发展也越来越多的被得到关注。生命伦理之所以存在于科学技术的左右,是因为伦理学的立场本就是探讨人类行为的社会规范,为评价这些活动的对错所设置的伦理标准。人类基因编辑是否会熟练的运用在人类生活中我们将拭目以待,应该明确其在基础临床的应用,并允许其作出基因治疗相关的研究,在有所规范和管控的前提下发展的更加完善。但科技的宗旨是为了造福社会,人类的未来也会因为科技的相辅相成而更加美好。
参考文献
[1] 辛柳燕,刘爱飞,钟思思,等.CRISPR/Cas基因编辑技术及其在血液系统疾病中的应用[J].中国实验血液学杂志,2016,24(4):1284-1288.
[2] 赵钦军,韩忠朝.基因编辑技术的发展前景及伦理与监管问题探讨[J].科学与社会,2016,6(03):1-11.
[3] 邱仁宗.基因编辑技术的研究和应用:伦理学的视角[J].医学与哲学(A),2016,37(07):1-7.
[4] 唐寰瑶,张洪江.人类胚胎干细胞临床试验责任伦理探究[J].医学与哲学,2015,(05):29-32.
[5] 张新庆.暂缓编辑人类胚胎基因之伦理论证[J].科技导报,2015,33(09):12-12.
[6] 唐寰瑶,张洪江.人类胚胎干细胞临床试验责任伦理探究[J].医学与哲学,2015,(05):29-32.
[7] 王洪奇.利用CRISPR/Cas9介导基因编辑人类三核受精卵伦理问题探讨[J].医学与哲学,2016,37(13):14-16.
[8] 周吉银,刘丹,曾圣雅,等.CRISPR/Cas9基因编辑技术在临床研究中的伦理审查问题探讨[J].中国医学伦理学,2017,30(8):927-931.
[9] 李建军,王添.人类胚胎基因编辑研究引发的伦理争辩[J].科学与社会,2016,6(03):32-41.
[10] 刘芳,易显飞.“设计婴儿”中基因编辑技术的伦理风险及消解[J].自然辩证法研究,2017,(07):61-64.
[11] 王张生,周韵娇,唐增.人类胚胎基因编辑的伦理思考[J].医学与哲学,2016,37(01):38-40.
[12] 李建军,王添.人类胚胎基因编辑研究引发的伦理关注和规制策略[J].自然辩证法研究,2016(11):114-118.
[13] 邱仁宗.人类基因编辑:科学、伦理学和治理[J].医学与哲学,2017,38(09):91-93.
[14] 邱仁宗.基因编辑技术的研究和应用:伦理学的视角[J].医学与哲学:a,2016,37(07):1-7.
[15] 祝丹娜,宫福清.基因隐私权的伦理和法律问题探究[J].中国医学伦理学,2016,29(03):424-427.
[16] 王康.人类基因编辑多维风险的法律规制[J].求索,2017,(11):98-107.
[17] 赵钦军,韩忠朝.基因编辑技术的发展前景及伦理与监管问题探讨[J].科学与社会,2016,6(03):1-11.
[18] 周莳文,赵利文.基因编辑技术的风险及法律分析[J].中国医学伦理学,2017,30(08):932-935.
[19] 朱振.反对完美?——关于人类基因编辑的道德与法律哲学思考[J].华东政法大学学报,2018,(01):72-84.