摘 要: 目的 探究慢病毒介导分泌型糖蛋白神经生长导向因子2 (Slit2) 过表达载体转染对骨髓间充质干细胞 (BMSCs) 向神经细胞转化的作用。方法 利用基因过表达技术, 构建Slit2过表达载体;慢病毒转染BMSCs;利用流式细胞仪检测BMSCs的表面蛋白, RT-PCR和Western-blot方法检测空白对照组、空载体病毒组和过表达载体病毒组神经细胞表面蛋白胶质纤维酸性蛋白 (GFAP) 和神经元特异性烯醇化酶 (NSE) 的表达。结果 第2代BMSCs表面CD44、CD29、CD34和CD45的表达率分别为60.2%、58.3%、3.4%和2.6%, 慢病毒转染效率为90%以上。空白对照组、空载体病毒组和过表达载体病毒组的GFAP、NSE mRNA和蛋白相对表达量比较, 差异有统计学意义 (F=9.089~13.893, P<0.05) ;其中过表达载体病毒组的GFAP、NSE mRNA和蛋白相对表达量明显高于空载体病毒组 (P<0.05) , 空载体病毒组和空白对照组比较差异无显着性 (P>0.05) 。结论 Slit2过表达质粒可以提高BMSCs向神经细胞转化的效率, 为神经损伤和脊髓损伤提供种子细胞。
关键词: 神经生长因子; 骨髓; 间充质基质细胞; 神经胶质原纤维酸性蛋白质; 磷酸丙酮酸水合酶;
Abstract: Objective To explore the effect of lentivirus-mediated overexpression of Slit2 on the transformation of bone marrow mesenchymal stem cells (BMSCs) into neural cells. Methods A Slit2 overexpression vector was constructed and used to transfect BMSCs via lentivirus.Flow cytometry was used to detect surface proteins of BMSCs.RT-PCR and Western blot were used to determine the expression of glial fibrillary acidic protein (GFAP) and neuron-specific enolase (NSE) on the surface of neural cells in blank control group, empty lentiviral vector group, and overexpression lentiviral vector group. Results The expression of CD44, CD29, CD34, and CD45 was 60.2%, 58.3%, 3.4%, and 2.6%, respectively, on the surface of the second generation BMSCs.The transfection efficiency of lentivirus was over 90%.There were significant differences in relative mRNA and protein expression of GFAP and NSE between the blank control group, the empty lentiviral vector group, and the overexpression lentiviral vector group (F=9.089-13.893, P<0.05) .The overexpression lentiviral vector group had significantly higher relative mRNA and protein expression of GFAP and NSE than the blank control group and the empty lentiviral vector group (P<0.05) , while there were no significant differences between the blank control group and the empty lentiviral vector group (P>0.05) . Conclusion The Slit2 overexpression plasmid can promote the efficiency of the transformation of BMSCs into neural cells, which provide seed cells for nerve injury and spinal cord injury.
Keyword: nerve growth factor; bone marrow; mesenchymal stromal cells; glial fibrillary acidic protein; phosphopyruvate hydratase;
骨髓间充质干细胞 (BMSCs) 具有多向分化潜能, 在特定环境下, 可以分化成人体内的各种细胞, 比如软骨细胞、骨细胞以及神经细胞等[1,2,3,4]。研究结果显示, BMSCs在特定诱导条件下可以转化成神经细胞, 进而能促进神经损伤的修复;而且BMSCs来源于病人自体, 移植后可以避免排斥反应[5];另外, BMSCs能分泌多种细胞因子, 这为神经的修复提供了一个新的思路[6]。分泌型糖蛋白神经生长导向因子2 (Slit2) 是中枢神经系统发育过程中的一种轴突导向抑制因子, 可控制神经轴突分支形成以及神经细胞迁移, 能促进BMSCs向感觉神经元分化, 参与损伤神经再生和功能修复[7,8,9]。近年来, 在交通事故中发生的神经损伤和脊髓损伤比较常见, 而针对神经损伤的治疗一直是临床上的难点。本研究将Slit2过表达载体以慢病毒介导入BMSCs内, 探讨慢病毒介导Slit2过表达转染促进BMSCs向神经细胞转化的作用, 从而为临床神经损伤病人治疗提供新的思路。
1、 材料与方法
1.1、 实验材料
胎牛血清购自Gibco公司;DMEM及2.5g/L胰酶Trypsin购自美国Invitrogen公司;Trizol购自美国Invitrogen公司;氯仿、乙醇及逆转录试剂盒购自美国ABI Applied Biosystems公司;Real-time PCR仪购自美国bio-rad公司。
1.2、 实验方法
1.2.1、 人BMSCs的分离和培养
选取20名健康志愿者, 男8例, 女12例, 年龄为20~38岁, 平均 (27.48±7.83) 岁。实验方案获得了本院伦理委员会的批准, 所有志愿者均签署知情同意书。志愿者术前查体, 排除肝炎、性病、艾滋病等传染性疾病;术中取俯卧位, 暴露双侧髂后上棘, 消毒, 铺巾, 以利多卡因20mL局部麻醉, 利用骨穿刺针采集志愿者的新鲜骨髓, 按照1∶3体积比加入含0.01mol/L胎牛血清、100kU/L青霉素的DMEM细胞培养液, 充分混匀后, 移入25cm2的Hank培养瓶中, 采用差速培养法培养, 3d后去掉培养瓶中的油脂等杂质, 之后每3d换1次细胞培养液。BMSCs细胞融合率达70%~80%后进行传代培养。
1.2.2、 BMSCs的鉴定
采用流式细胞仪检测第2代BMSCs表面蛋白CD29、CD44、CD71、CD90和CD106的表达;采用倒置光学显微镜观察BMSCs的细胞形态。
1.2.3、 慢病毒Slit2过表达载体构建
慢病毒Slit2过表达载体由上海吉凯基因化学技术有限公司合成, 选择pHBLV-U6-ZsGreen-PGK-Puro作为质粒克隆载体。慢病毒Slit2过表达载体克隆切入点为XhoI/BamHI, 编号为ENST00000005893。
1.2.4、 慢病毒细胞转染和实验分组
取第3代BMSCs进行实验。将细胞接种到6孔板, 待细胞融合率为50%时进行慢病毒转染, 根据转染说明书, MOI=50, 慢病毒滴度为3×107。将BMSCs细胞分成3组。空白对照组:未转染慢病毒;空白载体慢病毒组:转染不含Slit2过表达载体慢病毒;Slit2过表达载体慢病毒组:转染Slit2过表达载体慢病毒。1.2.5实时荧光定量PCR (RFPCR) 检测神经胶质原纤维酸性蛋白质 (GFAP) 和神经元特异性烯醇化酶 (NSE) mRNA表达3组细胞融合率达80%, 用2.5g/L胰蛋白酶消化后放入15mL离心管中, 加入1mL的Trizol RNA iso (Takara, 日本) , 利用Trizol萃取法, 提取总RNA。利用逆转录试剂盒逆转录目的RNA, 将得到的cDNA保存在-80℃冰箱中。根据荧光定量PCR试剂盒说明书要求, 反应体系为25μL, 内含:SYBR Premix Ex TaqTMⅡ (2×) 12.5μL, PCR Forward Primer (10μmol/L) 1.0μL, PCR Reverse Primer (10μmol/L) 1.0μL, cDNA模板2.0μL, ddH2O 8.5μL。应用FS 2000系统PCR仪器对25μL的反应体系进行分析, 采用两步法PCR反应程序, 反应时间选择120 min;其中预变性:95℃、30s;Circle 1:95℃、30s;Circle 2:60℃、30s;溶解曲线:95℃、5s, 60℃1 min;降温:50℃、30s。记录各样本的CT值。内参基因引物由上海生工公司合成。见表1。用2-△△CT法计算GAPDH、GFAP和NSE的相对表达量。
1.2.5、实时荧光定量PCR (RFPCR) 检测神经胶质原纤维酸性蛋白质 (GFAP) 和神经元特异性烯醇化酶 (NSE) mRNA表达
3组细胞融合率达80%, 用2.5g/L胰蛋白酶消化后放入15mL离心管中, 加入1mL的Trizol RNA iso (Takara, 日本) , 利用Trizol萃取法, 提取总RNA。利用逆转录试剂盒逆转录目的RNA, 将得到的cDNA保存在-80℃冰箱中。根据荧光定量PCR试剂盒说明书要求, 反应体系为25μL, 内含:SYBR Premix Ex TaqTMⅡ (2×) 12.5μL, PCR Forward Primer (10μmol/L) 1.0μL, PCR Reverse Primer (10μmol/L) 1.0μL, cDNA模板2.0μL, ddH2O 8.5μL。应用FS 2000系统PCR仪器对25μL的反应体系进行分析, 采用两步法PCR反应程序, 反应时间选择120 min;其中预变性:95℃、30s;Circle 1:95℃、30s;Circle 2:60℃、30s;溶解曲线:95℃、5s, 60℃1 min;降温:50℃、30s。记录各样本的CT值。内参基因引物由上海生工公司合成。见表1。用2-△△CT法计算GAPDH、GFAP和NSE的相对表达量。
表1 目的基因的引物序列

1.2.6、 Western-blot检测GFAP和NSE的相对蛋白表达水平
3组细胞处理后, 分别加入RIPA细胞裂解液1mL, 在冰上裂解30min, 收集入1.5mL的离心管中, 在4℃预冷的离心机中离心 (5 000r/min, 5min) , 提取上清, 经95℃煮沸后, 收集蛋白备用。制备浓缩胶10mL, 分离胶20mL。上样后电泳分离, 转膜后在4℃冰箱中避光孵育过夜 (>12h) 。GFAP和NSE小鼠抗人一抗 (Abcam公司) 1∶10 000稀释后加入样本离子膜;第2天用PBST稀释液洗膜, 重复3次, 用山羊抗小鼠IgG二抗 (碧云天公司) 1∶1 000稀释后孵育1.5h, 使用PBST稀释液洗膜, 重复3次, 然后用DAB显影液进行显影。应用Image J软件分析蛋白条带。
1.3 、统计学方法
应用SPSS 16.0软件进行统计学分析, 计量资料结果以形式表示。多组数据间比较采用单因素方差分析, 组间两两比较采用q检验。
2 、结果
2.1、 人BMSCs的培养和鉴定
接种48h后, 原代BMSCs开始贴壁, 细胞呈梭形或者多角形;培养至第2代细胞呈旋涡状或者辐射状生长, 细胞增殖迅速。流式细胞仪检测显示, 第2代BMSCs表面蛋白CD44和CD29表达率分别为60.2%和58.3%, CD34和CD45表达率分别为3.4%和2.6%。
2.2、 慢病毒介导Slit2过表达质粒转染BMSCs
结果显示, 慢病毒的转染效率较高, 为90%以上, 可以在最大程度上发挥Slit2的过表达作用。
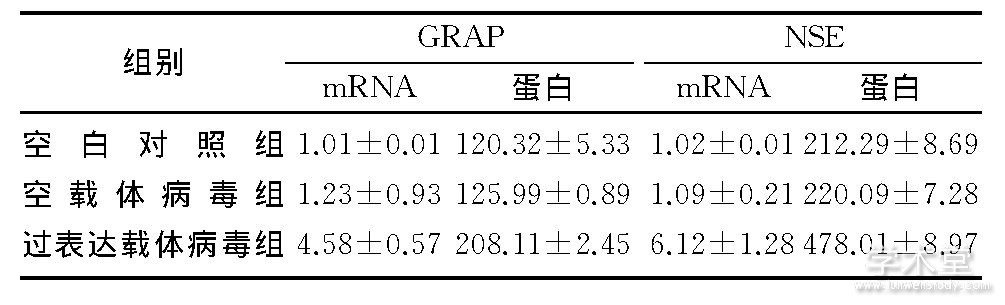
2.3、 各组GFAP、NSE mRNA和蛋白表达比较
空白对照组、空载体病毒组和过表达载体病毒组的GRAP、NSE mRNA水平和蛋白表达量比较差异有统计学意义 (F=9.089~13.893, P<0.05) , 其中空载体病毒组和空白对照组比较差异无显着性 (P>0.05) ;过表达载体病毒组和空载体病毒组相比较, 差异均有统计学意义 (q=2.001~3.897, P<0.05) 。见表2。
表2 各组GRAP、NSE mRNA和蛋白表达
3 、讨论
近年来, 随着交通事故的多发, 在交通事故中发生的神经损伤和脊髓损伤比较常见[10,11,12], 而针对神经损伤的治疗一直是临床上的难点[13]。BMSCs具有多分化潜能, 最近有研究表明, BMSCs可以分化成神经细胞[14,15,16,17,18]。在神经导向因子Slit2的刺激下, BMSCs可转化成神经细胞, 但是效率不高[19,20]。本研究利用基因过表达技术, 构建Slit2的过表达载体, 再利用高转染效率的慢病毒转染BMSCs, 探讨BMSCs向神经细胞高效率转化的实验方法, 为临床上神经损伤和脊髓损伤提供种子细胞。
Slit2是神经发育过程中引起神经细胞生长的神经导向因子[21]。有研究结果表明, Slit2通过浓度梯度来介导神经细胞的迁移和生长, 对神经细胞的生长起排斥性导向作用, 同时还可促进感觉神经细胞的神经纤维分支形成[22,23,24]。提示神经生长因子可以促进神经元谱系细胞的分化[25]。本研究应用基因过表达技术构建Slit2过表达载体, 应用慢病毒转染BMSCs, 结果显示, 慢病毒的转染效率较高, 为90%以上, 可以最大程度发挥Slit2的过表达作用。
GFAP和NSE均是神经细胞的标识蛋白, 其中GFAP是星形胶质细胞活化的标志物, 主要分布于中枢神经系统的星形胶质细胞, 参与细胞骨架的构成并维持其张力强度[26,27]。血清NSE是神经元和神经内分泌细胞所特有的一种酸性蛋白酶[28]。本研究选用以上两种神经细胞的特异性标志物, 采用RT-PCR和Western-blot的实验方法, 从基因和蛋白两个层面上检测空白对照组、空载体病毒组和过表达载体病毒组的GRAP和NSE的表达水平, 结果显示, 过表达载体病毒组GRAP和NSE基因和蛋白的表达水平均明显高于空载体病毒组和空白对照组, 差异有统计学意义。从而可以证明从基因水平上将Slit2的过表达载体通过慢病毒介导的方法转染BMSCs, 可以提高BMSCs向神经细胞的转化效率, 故而神经细胞的标记物GFAP和NES的表达量明显增高。
综上所述, Slit2过表达质粒可以提高BMSCs向神经细胞转化的效率, 为临床上神经损伤和脊髓损伤治疗提供种子细胞。
参考文献
[1]吴刚, 童培建.补肾活血汤含药血清干预体外培养大鼠骨髓间充质干细胞成软骨分化及补肾活血汤联合骨髓间充质干细胞治疗大鼠膝骨关节炎的实验研究[J].中医正骨, 2018, 30 (1) :6-11.
[2]亓俊华, 吴梅, 徐祥, 等.TNF-α对小鼠骨髓间充质干细胞免疫抑制作用影响[J].青岛大学医学院学报, 2015, 51 (2) :169-171, 174.
[3]赵芳英, 高秀秋, 刘姊凤.Wnt3a对人骨髓间充质干细胞成骨分化的影响及机制研究[J].中国医科大学学报, 2018, 47 (7) :617-621.
[4]卢志伟, 王磊, 张利英, 等.黄芪多糖对电离辐射骨髓间充质干细胞向神经分化潜能的影响[J].中国药理学通报, 2017, 33 (7) :950-955.
[5]杜佳蕾, 张曦元, 万娜, 等.体外诱导大鼠骨髓间充质干细胞向神经干细胞分化的研究进展[J].中西医结合心血管病电子杂志, 2017, 5 (27) :32-33.
[6]彭韬, 高水超, 周媛, 等.骨髓间充质干细胞治疗感音神经性耳聋相关实验技术体系建设概要[J].中华耳科学杂志, 2017, 15 (3) :350-356.
[7]周玉云, 王晓鹤, 黄晓慧, 等.缺氧、缺血诱导培养骨髓间充质干细胞及对Slit2表达的影响[J].生物医学工程与临床, 2017, 21 (2) :189-194.
[8]蒋莱, 张津宁, 柴源, 等.神经迁移蛋白Slit2与骨髓间充质干细胞及血管再生的关系[J].中国组织工程研究, 2014, 18 (37) :6034-6039.
[9]柴源, 蒋莱, 周玉云, 等.神经导向因子Slit2修饰骨髓间充质干细胞的表达研究[J].中风与神经疾病杂志, 2015, 32 (12) :1084-1088.
[10]李华南, 张海明, 顾兵, 等.针刺促进脊髓损伤后神经功能恢复的机制及相关信号通路的作用[J].中国康复理论与实践, 2017, 23 (6) :641-644.
[11]李晓宁, 梁雪松, 迟蕾, 等.夹脊电针联合甲基强的松龙对大鼠急性脊髓损伤后神经细胞凋亡表达的实验研究[J].中医药信息, 2017, 34 (1) :92-95.
[12]郝丽霞, 张琰, 刘帅, 等.低频电刺激结合康复训练治疗脊髓损伤神经源性膀胱患者疗效观察[J].中国临床研究, 2017, 30 (1) :116-119.
[13]张朋, 陈勇忠, 王金星, 等.盐酸氨溴索联合大剂量甲基强的松龙冲击治疗促进胸腰椎骨折合并脊髓损伤术后神经功能恢复作用的初步探讨[J].中国临床药理学与治疗学, 2017, 22 (8) :937-942.
[14]刘嘉婧, 曹宁, 翟晶磊, 等.骨髓间充质干细胞对冈田酸致神经细胞损伤的修复作用[J].解放军医学杂志, 2017, 42 (5) :377-382.
[15] 卢志伟, 王磊, 张利英, 等.黄芪多糖对电离辐射骨髓间充质干细胞向神经分化潜能的影响[J].中国药理学通报, 2017, 33 (7) :950-955.
[16]张广宇, 贾延劼, 王军, 等.氯化锂通过调节自噬通路促进大鼠骨髓间充质干细胞向神经细胞分化[J].中国病理生理杂志, 2017, 33 (12) :2128-2133.
[17]毕佳佳, 王磊, 李静, 等.神经细胞黏附分子对小鼠骨髓间充质干细胞黏附、迁移及细胞形态的影响[J].基础医学与临床, 2017, 37 (8) :1082-1087.
[18]黄鑫, 刘宇, 卢宏.化学方法体外诱导大鼠骨髓间充质干细胞成神经样细胞分化[J].生物技术通讯, 2017, 28 (6) :793-797.
[19]冯烨军, 陈明.骨髓间充质干细胞在神经修复中的研究进展[J].神经损伤与功能重建, 2016, 11 (5) :426-428.
[20]王静, 赵绍云, 李明哲, 等.Let-7c慢病毒载体对骨髓间充质干细胞体外诱导分化为神经细胞的影响[J].中国组织工程研究, 2016, 20 (1) :20-25.
[21]葛士坤, 王晴楠, 张凯照, 等.BALB/c小鼠SLIT2和ROBO4基因组织特异性表达与分布的研究[J].中国兽医科学, 2018 (1) :87-92.
[22]孙文波, 张立民, 康立娜, 等.HIF-1α在七氟醚预处理减轻大鼠皮质神经元凋亡中的作用:与Slit2?Robo信号通路的关系[J].中华麻醉学杂志, 2015, 35 (5) :550-554.
[23]肖卫东, 易成腊, 陈安民, 等.神经生长导向因子Slit2在成年大鼠急性脊髓损伤后的表达[J].中华实验外科杂志, 2006, 23 (8) :987-989.
[24]黄素素, 张云云, 孙波, 等.大鼠皮质星形胶质细胞氧糖剥夺后Slit2、Robo1的表达研究[J].中风与神经疾病杂志, 2012, 29 (1) :4-8.
[25]葛晓娜, 王锐, 付锦.Slit2在部分神经系统疾病中的研究[J].脑与神经疾病杂志, 2017, 25 (5) :317-319.
[26]王健萍.不同病程糖尿病大鼠视网膜神经细胞凋亡及其GFAP和VEGF的动态表达[J].疾病监测与控制, 2017, 11 (7) :522-523.
[27]陈京, 余伟华, 李付贵.神经干细胞神经分化示踪中GFAP启动子驱动荧光报告系统的价值[J].中国组织工程研究, 2017, 21 (21) :3370-3375.
[28]罗辉, 李东金, 肖喻, 等.带状疱疹病人血清NSE水平及与疼痛的相关性研究[J].中国疼痛医学杂志, 2017, 23 (7) :538-540.
生长因子是一类由机体自身产生并具有促进细胞生长、增殖和分化等多种生物学功能的活性物质。迄今已鉴定出百余种生长因子,而第一个生长因子神经生长因子则于1950年代发现。做出这项成就的是意大利-美国双重国籍的女科学家蒙塔尔奇尼(RitaLe-vi-Montalcini)...
神经生长因子(Nervegrowthfactor,NGF)是神经系统非常重要的生物活性分子之一,对调节神经元的生长、发育、分化、存活及损伤神经的再生修复具有重要作用和临床意义[1-2].目前的基础研究表明NGF可应用于神经中毒、周围神经损伤、糖尿病性周围神经病变、老年...