中文摘要
目的:观察青藤碱(Sinomenine,SIN)对完全弗氏佐剂(Complete freund'sadjuvant,CFA)诱导的慢性炎性疼痛和福尔马林诱导的急性炎性疼痛的镇痛作用,探讨其作用机制,旨在为炎性疼痛的治疗和青藤碱的开发利用提供新的靶点和思路。
方法:(1)建立 CFA 诱导的炎性疼痛模型,考察青藤碱的镇痛效应及机制。
健康雄性 SD 大鼠随机分为 5 组,分别为对照组、CFA 模型组、CFA+SIN 10 mg/kg组、CFA+SIN 20 mg/kg 组、CFA+SIN 40 mg/kg 组。采用大鼠左后足足底皮下注射50% CFA 150 μL 的方法制备炎性疼痛模型,SIN 各剂量组大鼠分别腹腔注射 SIN10 、20 和 40mg/kg 7 天(2 次/天)。实验期间观察大鼠注射足形态变化,并测定大鼠的体重、足厚度、机械痛阈(Mechanical withdrawal threshold,MWT)和热痛阈(Thermal withdrawal latency,TWL)等指标。行为学实验结束后取大鼠 L4-6 腰椎间的背根神经节(Dorsal root ganglion,DRG)和脊髓组织,采用 Western blot 方法检测 NLRP3、ASIC3、CaMK2α 等蛋白表达变化。(2)建立福尔马林诱导的炎性疼痛模型,考察青藤碱的镇痛效应及机制。健康雄性小鼠随机分为 4 组,分别为空白对照组、福尔马林模型组、福尔马林+SIN 40 mg/kg 组、福尔马林+SIN 80 mg/kg组。SIN 各剂量组分别腹腔注射 SIN 40 和 80 mg/kg,对照组和模型组给予相同体积的生理盐水。30 min 后,福尔马林模型组和 SIN 各剂量组分别于小鼠左后足足底皮下注射 5%的福尔马林(20 μL/20 g)造模。然后将小鼠立即放入观察室中观察 1 h,记录小鼠舔/摩擦注射部位或抬爪的时间(痛反应指标)。实验结束后取小鼠 L4-6腰椎间的 DRG 和脊髓,采用 Western blot 方法测定 NLRP3、ASIC3、CaMK2α 等蛋白表达变化。
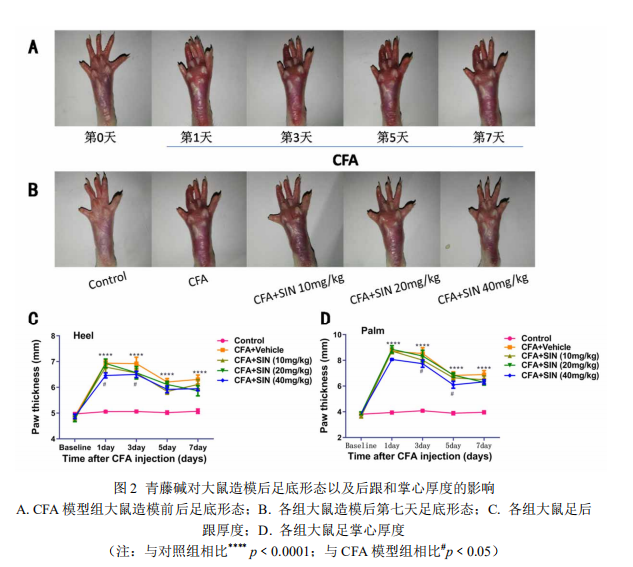
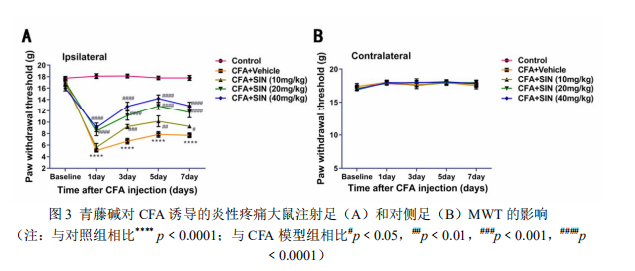
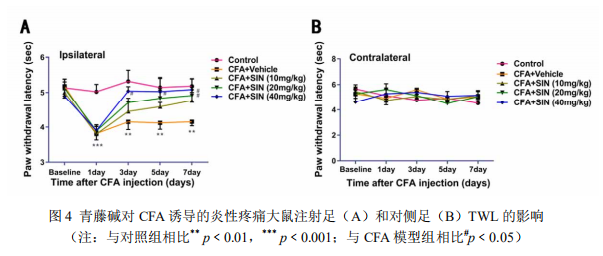
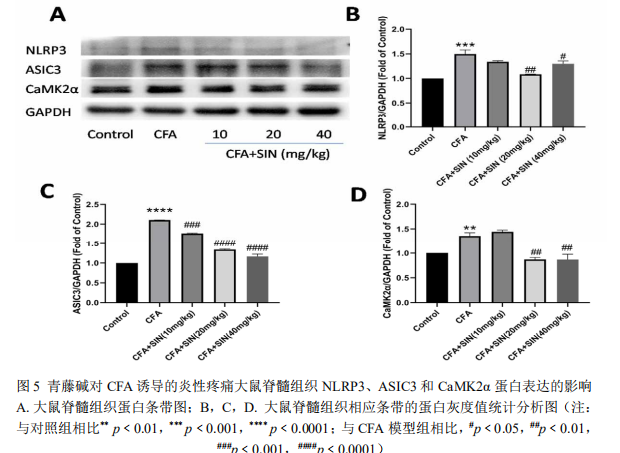
结果:(1)青藤碱对 CFA 诱导的慢性炎性疼痛的研究结果显示:与对照组相比,模型组大鼠足底出现红肿现象,足后跟和掌心的厚度均显著增厚(p﹤0.01),MWT 和 TWL 均显著降低(p﹤0.01),脊髓中 NLRP3、ASIC3、CaMK2α 的表达均显著增加(p﹤0.01);与模型组相比,SIN 各剂量组大鼠足底红肿现象不同程度地减轻,足后跟和掌心的厚度均明显减少(p﹤0.05),MWT 和 TWL 均显著升高(p﹤0.05 或 0.01),且呈现剂量依赖性。SIN 20 和 40 mg/kg 组大鼠脊髓中 NLRP3、ASIC3、CaMK2α 的表达均显著减少(p﹤0.05 或 0.01),CFA+SIN 10 mg/kg 组大鼠脊髓中 ASIC3 的表达明显减少(p﹤0.01),而 NLRP3 和 CaMK2α 的表达无明显变化。(2)青藤碱对福尔马林诱导的炎性疼痛的研究结果显示:与对照组相比,模型组小鼠痛反应显著增加(p﹤0.01),呈现双相疼痛反应特征,小鼠脊髓组织中NLRP3、ASIC3、CaMK2α 的表达显著增加(p﹤0.05 或 0.01),DRG 组织中 ASIC3、CaMK2α 的表达显著增加(p﹤0.05 或 0.01);与模型组相比,SIN 40 mg/kg 组小鼠仅一相痛反应明显减少(p﹤0.01),SIN 80 mg/kg 组小鼠的一相和二相痛反应均明显减少(p﹤0.05 或 0.01),SIN 各剂量组小鼠 DRG 中 ASIC3、CaMK2α 的表达明显降低(p﹤0.05 或 0.01),脊髓中 NLRP3、ASIC3、CaMK2α 的表达均明显降低(p﹤0.05 或 0.01)。
结论:青藤碱可有效缓解 CFA 诱导的慢性炎性疼痛和福尔马林诱导的急性炎性疼痛,且作用呈剂量依赖性,其镇痛作用机制可能与调节 CaMK2α-ASIC3-NLRP3信号通路有关。
关键词:青藤碱,炎性疼痛,CaMK2α,ASIC3,NLRP3

abstract
Objective: To observe the analgesic effect of sinomenine (SIN) on chronic inflammatory pain induced by complete Freund's adjuvant (CFA) and acute inflammatory pain induced by formalin, and explore its mechanism, so as to provide new targets and ideas for the treatment of inflammatory pain and the development and utilization of sinomenine.
Methods: (1) the inflammatory pain model induced by CFA was established to investigate the analgesic effect and mechanism of sinomenine.
Healthy male SD rats were randomly divided into 5 groups: control group, CFA model group, CFA + sin 10 mg / kg group, CFA + sin 20 mg / kg group, CFA + sin 40 mg / kg group. The inflammatory pain model was established by subcutaneous injection of 50% CFA 150 μ l into the left hind foot of rats. Rats in each dose group of sin were intraperitoneally injected with sin 10, 20 and 40 mg / kg for 7 days (twice a day)。 During the experiment, the morphological changes of the injected feet were observed, and the body weight, foot thickness, mechanical pain threshold (MWT) and thermal pain threshold (TWL) were measured. After the behavioral experiment, the dorsal root ganglion (DRG) and spinal cord tissues of L4-6 lumbar intervertebral disc were taken, and the expression of NLRP3, ASIC3 and camk2 α were detected by Western blot. (2) Objective to establish formalin induced inflammatory pain model and investigate the analgesic effect and mechanism of sinomenine. Healthy male mice were randomly divided into four groups: blank control group, formalin model group, formalin + sin 40 mg / kg group, formalin + sin 80 mg / kg group. Sin 40 mg / kg and 80 mg / kg were injected intraperitoneally in each dose group of sin. The control group and model group were given the same volume of normal saline. 30 minutes later, the mice in formalin model group and sin groups were injected subcutaneously with 5% formalin (20 μ L / 20 g) subcutaneously into the left hind foot of mice. Then the mice were immediately put into the observation room and observed for 1 h. The time of licking / rubbing the injection site or lifting claw (pain response index) was recorded. At the end of the experiment, the DRG and spinal cord of L4-6 lumbar vertebrae were taken, and the expression of NLRP3, ASIC3 and camk2 α were detected by Western blot.
Results: (1) the results of sinomenine on chronic inflammatory pain induced by CFA showed that: compared with the control group, the plantar swelling phenomenon appeared in the model group, the thickness of heel and palm were significantly increased (P < 0.01), MWT and TWL were significantly decreased (P < 0.01), the expression of NLRP3, ASIC3, camk2 α in spinal cord were significantly increased (P < 0.01); compared with the model group, sin increased significantly The results showed that the swelling of the plantar was alleviated, the thickness of heel and palm was significantly reduced (P < 0.05), MWT and TWL were significantly increased (P < 0.05 or 0.01) in a dose-dependent manner. The expression of NLRP3, ASIC3 and camk2 α in the spinal cord of rats in sin 20 and 40 mg / kg groups were significantly decreased (P < 0.05 or 0.01)。 The expression of ASIC3 in CFA + sin 10 mg / kg group was significantly decreased (P < 0.01), but the expression of NLRP3 and camk2 α had no significant change. (2) Compared with the model group, the expression of DRG was significantly increased (P < 0.01) Compared with the model group, the first phase pain response of sin 40 mg / kg group was significantly reduced (P < 0.01), the first phase and second phase pain response of sin 80 mg / kg group were significantly reduced (P < 0.05 or 0.01), the expression of ASIC3 and camk2 α in DRG of sin groups were significantly decreased (P < 0.05 or 0.01), and NLRP3, ASIC3 and camk2 α in spinal cord were significantly decreased in sin groups 05 or 0. 01)。
Conclusion: sinomenine can effectively relieve chronic inflammatory pain induced by CFA and acute inflammatory pain induced by formalin in a dose-dependent manner. Its analgesic mechanism may be related to the regulation of camk2 α - asic3-nlrp3 signaling pathway.
Key words: sinomenine, inflammatory pain, camk2 α, ASIC3, NLRP3
前言
疼痛通常是身体对潜在有害刺激的保护性反应,但它也是大量病理条件下的主要症状,如炎症、癌症等[1].疼痛是临床最为常见的症状之一,而炎症性疼痛则是其中最重要的类型[2].组织损伤引起的慢性炎症和伤害性刺激引起的继发性炎症均可导致炎症性疼痛。炎症性疼痛以触诱发痛、痛觉过敏和持续性疼痛为特征,被认为是最常见和最难以治愈的慢性疼痛,有些甚至可持续数月或数年[3-5].严重的疼痛或是长期慢性疼痛会损害患者的生活质量,严重时甚至会使人产生心理疾病[3, 6].目前临床上广泛使用的镇痛药主要有非甾体抗炎药和吗啡等,这些药物通常有着疗效有限和安全性问题。因此,当前我们亟需阐明炎性疼痛的发生机制、寻找和开发新的有效的镇痛药物。
大量的研究证实,Ca2+介导的细胞信号通路对疼痛至关重要,前列腺素、P 物质、缓激肽等一些神经递质和炎症介质的释放通常需要 Ca2+的参与。在慢性疼痛状态下,胞内 Ca2+会显著增加,激活 CaM,然后 Ca2+/CaM 激活 CaMKII[7-9].有研究发现,干扰小鼠脊髓背角 CaMKII 信号可能是抑制 CFA 引起的炎症性疼痛的重要机制,提示 CaMKII 是神经可塑性和痛觉过敏的关键分子,也是治疗疼痛的重要靶点之一[10].此外,由于炎症时的细胞损伤和代谢异常,炎症局部 pH 可以降低至 6.0以下,形成酸性环境,从而激活外周伤害性感受器,而酸敏感离子通道(ASICs)就是其中之一。有研究发现,大鼠 ASIC1a 和 ASIC3 选择性抑制剂 NS383 能够有效逆转大鼠炎性和神经病理性痛觉过敏[11],在外周阻断 ASIC3 可抑制轻度皮肤酸化引起的自发性疼痛[12],这些研究表明 ASICs 在疼痛的发生中发挥重要作用。还有研究报道, Ca2+和 H+均能有效地激活 NLRP3 炎症小体[13, 14],NLRP3 炎症小体信号作为一种早期分子反应参与三叉神经损伤引起的小鼠神经性疼痛[15],抑制 NLRP3 炎症小体可以减轻神经损伤小鼠的机械痛觉过敏[16],这些研究表明 NLRP3 炎症小体也参与疼痛的发生。因此,调节 CaMKII、ASIC3 和 NLRP3 等信号可能是治疗炎性疼痛的有效靶点和路径。
青藤碱(Sinomenine,SIN)是从传统中药青风藤中提取分离的一种生物碱,具有广泛的药理作用,如免疫抑制[17]、抗炎[18]、抗肿瘤[19]、神经保护[20]、抗抑郁[21]、抗焦虑[22]、抗惊厥[23]等。青藤碱在临床上被广泛用于类风湿性关节炎的治疗,其治疗效果好,同时副作用小,价格低廉。近年来,青藤碱被证实在多有镇痛作用,虽然其结构与吗啡相似,但其镇痛作用机制与阿片受体无关[24, 25].有报道发现,青藤碱通过抑制小神经胶质细胞 JAK2/STAT3 和神经元 CAMKII/CREB级联减轻癌症引起的骨痛[26];青藤碱通过抑制疼痛中枢内 Glu 的释放发挥镇痛作用[27];青藤碱连续多次给药逆转完全弗氏佐剂(CFA)诱导的小鼠前扣带皮层(ACC)GluN2B 和 CaMKII 等蛋白表达上调[28];青藤碱抑制脑缺血大鼠的 ASIC1a 和 L-型钙通道保护脑缺血损伤[29, 30];青藤碱抑制 NLRP1 炎症小体发挥抗惊厥和神经保护作用[23].此外,有研究显示,青藤碱可通过调节 NMDAR1/CAMKII/CREB 通路在体内和体外对吗啡依赖均表现出保护作用[31].重要的是,反复使用青藤碱并不会诱导镇痛耐受性的产生[32].这些证据显示青藤碱具有镇痛的潜力和调节 CaMKII、ASICs 和 NLRP 等信号的作用,但是青藤碱是否对急、慢性炎性疼痛都有镇痛作用还需要进一步研究,其镇痛机制是否与调节 CaMKII、ASICs 和 NLRP 炎症小体等的表达水平有关也尚不清楚。
因此,本实验以完全弗氏佐剂(Complete Freund's Adjuvant,CFA)诱导的慢性炎性疼痛模型和福尔马林(Formalin)诱导的急性炎性疼痛模型为研究对象,综合运用行为学、分子生物学等方法,研究青藤碱在不同炎性疼痛模型中的作用,以及青藤碱对炎性疼痛模型动物脊髓(Spinal cord,SC)和背根神经节(Dorsal rootganglion,DRG)组织中 CaMK2α、ASIC3 和 NLRP3 等蛋白表达水平的调节作用,旨在阐明青藤碱的对不同炎性疼痛的镇痛作用及其作用机制,为炎性疼痛的治疗和青藤碱的开发利用提供新的靶点和思路。
材料与方法
1 实验动物雄性
SD 大鼠(200±20 g)30 只和雄性小鼠(20±2 g)24 只购于湖北省实验动物研究中心,动物许可证号分别为:SCXK(辽)2015-0001 和 SCXK(鄂)2015-0018.所有动物均饲养于室温 22±2℃,湿度 50%-60%的动物房中,给予充足的饲料和水,12h 光暗交替。
2 试剂
3 仪器和设备
4 主要试剂的配制
4.1 青藤碱溶液
青藤碱粉末临用前用生理盐水配制成一定浓度的青藤碱溶液,溶解时进行涡旋和超声,使粉末充分溶解。注:称量和溶解过程中注意避光,超声时注意温度不能过高。
4.2 CFA 溶液
(50% in saline)抽取 CFA 原液(用前充分摇匀)适量体积,加入等体积的生理盐水稀释为 50%CFA 溶液,用前需充分涡旋使溶液乳化(避免水油分离)。
4.3 5%的福尔马林溶液
将 37%-40%的甲醛溶液(即 100%福尔马林溶液)按体积比加入生理盐水稀释为的 5%福尔马林溶液,最好临用现配,甲醛易挥发失效。
4.4 PBS 溶液
取一袋 PBS 干粉,置于烧杯中,向烧杯中加入 1600 mL UP H2O,搅拌溶解后,滴加浓盐酸将溶液 pH 值调节至 7.4,然后加入 UP H2O 将溶液定容至 2 L,室温保存。
4.5 10×电泳液
精密称量 Tris-Base 30.3 g,甘氨酸 144 g,SDS 10 g 置于 1 L 烧杯中,加入约700 mL 的 UP H2O,充分搅拌溶解,加 UP H2O 将溶液定容至 1 L,4 ℃冰箱保存。
4.6 10×转膜液
精密称量 Tris-Base 32.5 g,甘氨酸 145 g 置于 1 L 烧杯中,加入约 700 mL 的UP H2O,充分搅拌溶解,加 UP H2O 将溶液定容至 1 L,4 ℃冰箱保存。
4.7 10×TBST
精密称量 Tris-Base 12.1 g,NaCl 87.6 g,Tween 20 10 ml 置于 1L 烧杯中,加入约 800 mL 的 UP H2O,充分搅拌溶解,滴加浓盐酸将 pH 值调节至 7.4,加 UP H2O将溶液定容至 1 L,4 ℃冰箱保存。
4.8 0.5M Tris-HCl(pH=6.8)
精密称量 Tris-Base 6 g,SDS 0.4 g 置于烧杯中,加入约 80 mL 的 UP H2O,充分搅拌溶解,冷却至室温后滴加浓盐酸将 pH 值调节至 6.8,加 UP H2O 将溶液定容至 100 mL,室温保存。
4.9 1.5M Tris-HCl(pH=8.8)
精密称量 Tris-Base 18.2 g,SDS 0.4 g 置于烧杯中,加入约 80 mL 的 UP H2O,充分搅拌溶解,冷却至室温后滴加浓盐酸将 pH 值调节至 8.8,加 UP H2O 将溶液定容至 100 mL,室温保存。
4.10 10% APS
0.1 g APS 溶于 1.0 mL UP H2O,4 ℃避光保存。
4.11 5%脱脂奶粉
取 1.5 g 脱脂奶粉溶于 30 mL TBST 中充分溶解,4 ℃保存备用。
5 动物分组与给药
5.1 CFA 诱导的大鼠足底炎性疼痛
实验将 30 只健康雄性 SD 大鼠随机分为 5 组,分别为空白对照组、CFA 模型组、CFA+SIN(10 mg/kg)组、CFA+SIN(20 mg/kg)组、CFA+SIN(40 mg/kg)组,每组 6 只。CFA 模型组和 CFA+SIN 各剂量组大鼠分别于左后足足底皮下注射 50%CFA 150 μL 造模,对照组大鼠于左后足足底皮下注射 150 μL 生理盐水作为对照。
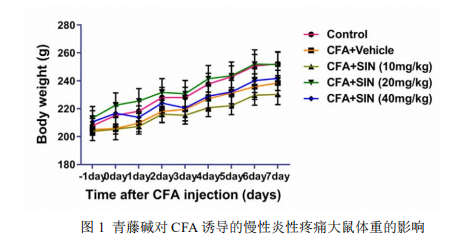
造模后青藤碱各剂量组每天腹腔注射相应剂量的青藤碱 2 次,连续 7 天。分别于造模前 1 天和造模后的第 1 d、3 d、5 d、7 d 测量大鼠的 MWT、TWL 和爪厚度,并拍摄各组大鼠注射足脚掌外观,给药期间每日称重。行为学实验结束后取大鼠的L4-6 腰椎间 DRG 和脊髓,采用 Western blot 方法检测其蛋白表达情况。
5.2 福尔马林诱导的小鼠足底炎性疼痛
实验将 24 只健康雄性小鼠随机分为 4 组,分别为空白对照组、福尔马林模型组、福尔马林+SIN(40 mg/kg)组、福尔马林+SIN(80 mg/kg)组,每组 6 只。福尔马林+SIN(40 mg/kg)组、福尔马林+SIN(80 mg/kg)组分别给予小鼠腹腔注射 40 mg/kg、80 mg/kg 的青藤碱溶液(10 mL/kg),对照组和福尔马林模型组腹腔注射相同体积的生理盐水。青藤碱给药后 30 min,福尔马林模型组、福尔马林+SIN(40 mg/kg)组、福尔马林+SIN(80 mg/kg)组于小鼠左后足足底皮下注射 5%的福尔马林(20μL/20 g)造模,对照组于相同位置注射等体积生理盐水。造模后小鼠被立即放入一个透明的观察室中观察 1 h(录像),福尔马林注射后小鼠舔/摩擦注射部位或抬爪被视为伤害性反应。录像结束后,取小鼠 L4-6 腰椎间 DRG 和脊髓,采用 Western blot方法测定相关蛋白的表达情况。
6 实验方法
6.1 足底皮下注射给药方法注射
前 15 min 将 CFA 从冰箱取出,平衡至室温,注射前即刻,摇晃混匀 CFA溶液,消毒足底皮肤,用 1 mL 注射器抽取 CFA, 于大鼠左后足足底皮下注射,从脚掌第 2 和第 3 个趾垫之间插入针头至皮下,将针头推进至足底中心(几个趾垫中间),注入药液。给药后稍微按压针孔一会,以防止药物流出并促进药物扩散。福尔马林足底皮下注射方式与上述方法类似。
6.2 福尔马林测试
福尔马林测试[33]:将需要测试的小鼠放入一个透明的观察室中,观察室底部放置摄像头记录小鼠实验过程中爪子的反应。适应性静置 30 min 后,用微量进样针在小鼠左后足足底皮下注射福尔马林,随即小鼠被立即放入观察室中观察(录像)。
小鼠造模后舔/摩擦注射部位或抬爪被视为伤害性反应,统计每 5 min 内疼痛反应的总时间。福尔马林足底皮下注射后的 0-10 min 的痛反应记为一相反应,10-60 min的痛反应记为二相反应,分析青藤碱对小鼠一相和二相伤害性反应的干预作用。
6.3 机械缩足反射阈值(MWT)的测定
采用生物信号采集系统和足底刺激系统测大鼠的 MWT 值,实验前对仪器进行调零和校准,用传感器上的刺激针垂直刺激大鼠的后足足底掌心部位,记录动物抬爪时软件上所显示的力值,重复刺激 5 次,去掉一个最大值和一个最小值,取平均值为大鼠的 MWT 值。
6.4 热缩足反射潜伏期(TWL)的测定[34]
实验前将大鼠置于行为笼内静置 30 min.调试仪器,光照强度全程保持一致,热辐射截断时间定为 15 s.使用光源照射大鼠后足,当大鼠出现缩足、舔咬等伤害性反应时,迅速关闭光源并记下每次光源照射的时长。每只爪子测定 3 次,两只脚测量时间间隔时间 3 min 以上,同只脚间隔 5 min 以上,取 3 次平均值为大鼠的 TWL值。
6.5 爪水肿的测量[35]
采用游标卡尺测大鼠患足的掌心和爪后跟的厚度,游标卡尺读数精确到 0.02mm.
6.6 蛋白免疫印迹实验
(1)蛋白样本提取制备:称取腰段 DRG 和腰段脊髓组织,参照试剂盒,每 20mg 组织加 200 μL 裂解液,用电子匀浆器匀浆 2 min(55 Hz),冰上裂解 30 min(裂解期间每 10 min 涡旋一次),充分裂解后,于低温高速离心机中 12000 g,4 ℃离心 15 min,取上清,测定蛋白浓度后充分变性,即制得上样样品。
(2)电泳:配制 SDS-PAGE 凝胶(5%浓缩胶和 8%分离胶)。每孔样品上样50 μg.上样后,先用 80 V 电压电泳至 Marker 红色条带下第 2 条条带出来,然后切换 110 V 跑至溴酚蓝接近凝胶底部。
(3)转膜:PVDF 膜用前用甲醇提前活化 2 min,然后将电泳后的凝胶从电泳槽取出、和滤纸和 PVDF 膜一起在转膜液中浸泡 15 min 后,用湿转法转膜,转膜电流为 250 mA,时间为 120 min 左右。
(4)封闭及抗体孵育:转膜后取出带有目的蛋白的 PVDF 膜,用 TBST 洗膜 5min,然后用 5%脱脂牛奶室温封闭 1.5 h,封闭结束后用 TBST 洗膜 5 min,然后置于摇床上一抗 4 ℃孵育过夜。次日用 TBST 洗膜 3 次,每次 7 min 后,于二抗中室温孵育 1 h.
(5)显影及数据处理:二抗孵育结束后用 TBST 洗膜 3 次,每次 7 min,然后采用 ECL 显影液和 Bio-Rad 凝胶成像系统进行显影,蛋白条带用 Image Lab 进行分析。
7 统计学方法
所有实验数据采用均数+标准误(mean±SEM)表示,采用 Graphpad Prism8.0软件进行作图,用 SPSS17.0 软件进行数据处理,组间均数的比较视不同数据类型采用单因素方差分析或重复测量方差分析,p﹤0.05 表示差异具有统计学意义。
【由于本篇文章为硕士论文,如需全文请点击底部下载全文链接】
6 结语
青藤碱已证实在多种动物疼痛模型中具有镇痛作用,其作用机制也涉及多种相关分子,如细胞因子(TNF-α、IL-1β、和 IL-6)、前列腺素和环氧合酶(PGE2 和COX-2)、嘌呤受体(P2X3)、谷氨酸受体(GluN2B)、核因子(NF-κB)、γ-氨基丁酸受体(GABAa 受体)、阿片受体(μ 阿片受体)、电压门控钠通道、细胞内信使(c-Fos)等。但其确切的镇痛机制还有待进一步研究和证实
参考文献
[1] Zhuo M. Glutamate receptors and persistent pain: targeting forebrain NR2B subunits[Z]. England:Elsevier Ltd, 2002,7: 259-267.
[2] O'Connor A B. Neuropathic pain: quality-of-life impact, costs and cost effectiveness of therapy[J].Pharmacoeconomics, 2009,27(2):95-112.
[3] Li J. Pain and depression comorbidity: A preclinical perspective[J]. Behavioural Brain Research,2015,276:92-98.
[4] Cheng Y, Zhang J, Hou W, et al. Immunoregulatory effects of sinomenine on the T-bet/GATA-3 ratioand Th1/Th2 cytokine balance in the treatment of mesangial proliferative nephritis[J]. InternationalImmunopharmacology, 2009,9(7-8):894-899.
[5] Kim T W, Han J M, Han Y K, et al. Anti-inflammatory Effects of Sinomenium Acutum Extract OnEndotoxin-induced Uveitis in Lewis Rats.[J]. International journal of medical sciences,2018,15(8):758-764.
[6] Lu X L, Zeng J, Chen Y L, et al. Sinomenine hydrochloride inhibits human hepatocellular carcinomacell growth in vitro and in vivo: involvement of cell cycle arrest and apoptosis induction[J]. Int J Oncol,2013,42(1):229-238.
[7] Yang Y, Wang H, Li L, et al. Sinomenine Provides Neuroprotection in Model of Traumatic Brain Injuryvia the Nrf2-ARE Pathway.[J]. Frontiers in neuroscience, 2016,10:580.
[8] Li X, Liu C, Jiang B, et al. The antidepressant-like effects of sinomenine in mice: a behavioral andneurobiological characterization.[J]. Behavioural pharmacology, 2018,29(4):306-315.
[9] Chen S W, Mi X J, Wang R, et al. Behavioral effects of sinomenine in murine models of anxiety.[J]. Lifesciences, 2005,78(3):232-238.
[10] Bannon A W, Malmberg A B. Models of nociception: hot-plate, tail-flick, and formalin tests inrodents[J]. Current protocols in neuroscience, 2007,Chapter 8:8-9.
[11] Gao T, Hao J, Wiesenfeld-Hallin Z, et al. Analgesic effect of sinomenine in rodents after inflammationand nerve injury[J]. European Journal of Pharmacology, 2013,721(1-3):5-11.
[12] Navarro-Alvarez N, Gon?alves B M M, Andrews A R, et al. A CFA-Induced Model of InflammatorySkin Disease in Miniature Swine[J]. International Journal of Inflammation, 2018,2018:1-8.
[13] Li S, Han J, Wang D, et al. Sinomenine attenuates chronic inflammatory pain in mice[J]. MetabolicBrain Disease, 2017,32(1):211-219.
[14] Yuan Y, Zhang Y, He X, et al. Protective Effects of Sinomenine on CFA-Induced Inflammatory Pain inRats[J]. Medical Science Monitor, 2018,24:2018-2024.
[15] Ji R R. Peripheral and central mechanisms of inflammatory pain, with emphasis on MAP kinases[J].Curr Drug Targets Inflamm Allergy, 2004,3(3):299-303.
[16] Muley M M, Krustev E, McDougall J J. Preclinical Assessment of Inflammatory Pain[J]. CNSNeuroscience & Therapeutics, 2016,22(2):88-101.
[17] Lee J, Yoon S, Won J, et al. Sinomenine produces peripheral analgesic effects via inhibition ofvoltage-gated sodium currents[J]. Neuroscience, 2017,358:28-36.
[18] Komatsu T, Katsuyama S, Takano F, et al. Possible involvement of the μ opioid receptor in theantinociception induced by sinomenine on formalin-induced nociceptive behavior in mice[J].Neuroscience Letters, 2019,699:103-108.
[19] Wang M H, Chang C, Cheng J, et al. Activation of opioid μ-receptor by sinomenine in cell and mice[J].Neuroscience Letters, 2008,443(3):209-212.
[20] Ou J, Zhou Y, Li C, et al. Sinomenine Protects Against Morphine Dependence through theNMDAR1/CAMKII/CREB Pathway: A Possible Role of Astrocyte-Derived Exosomes[J]. Molecules,2018,23(9):2370.
[21] Zhu Q, Sun Y, Zhu J, et al. Antinociceptive effects of sinomenine in a rat model of neuropathic pain[J].Scientific Reports, 2015,4(1)。
[22] Gao T, Shi T, Wiesenfeld-Hallin Z, et al. Sinomenine alleviates mechanical hypersensitivity in micewith experimentally induced rheumatoid arthritis[J]. Scandinavian Journal of Pain, 2015,7(1):9-14.
[23] Gao T, Shi T, Wang D, et al. Repeated sinomenine administration alleviates chronic neuropathicpain-like behaviours in rodents without producing tolerance[J]. Scandinavian Journal of Pain,2014,5(4):249-255.
[24] Rao S, Liu S, Zou L, et al. The effect of sinomenine in diabetic neuropathic pain mediated by the P2X3receptor in dorsal root ganglia[J]. Purinergic Signalling, 2017,13(2):227-235.
[25] Zhang A, Gao Y, Zhong X, et al. Effect of sodium ferulate on the hyperalgesia mediated by P2X3receptor in the neuropathic pain rats[J]. Brain Res, 2010,1313:215-221.
[26] Oh Y C, Kang O H, Kim S B, et al. Anti-inflammatory effect of sinomenine by inhibition ofpro-inflammatory mediators in PMA plus A23187-stimulated HMC-1 Cells[J]. European review formedical and pharmacological sciences, 2012,16(9):1184.
[27] Chen S, Sun J, Zhou Y, et al. Sinomenine attenuates cancer-induced bone pain via suppressingmicroglial JAK2/STAT3 and neuronal CAMKII/CREB cascades in rat models.[J]. Molecular pain,2018,14:2070370288.
[28] Zhu Q, Sun Y, Mao L, et al. Antinociceptive effects of sinomenine in a rat model of postoperativepain[J]. British Journal of Pharmacology, 2016,173(10):1693-1702.
[29] Ou Y, Su M, Ling Y, et al. Anti-allodynic effects of N -demethylsinomenine, an active metabolite ofsinomenine, in a mouse model of postoperative pain[J]. European Journal of Pharmacology,2018,823:105-109.
致谢
光阴似箭,岁月如歌,三年的研究生生活转眼已经到了尾声。回首这三年,对那些引导我、帮助我、鼓励我、支持我的人,我的内心充满了感激。
衷心的感谢我的导师李炎坤副教授,作为我科研路上的领路人,您严谨的学术作风和勤奋的工作态度都深深的影响着我。从初入实验室的耐心叮嘱,到论文的选题和试验方案的设计,再到英文文献的阅读和学术论文的书写,您都给予了我非常耐心的指导和极大的鼓励与包容。在您的精心栽培下,我不仅学到了科研思维,也学到了一些为人处世的道理。在这三年硕士生涯即将结束之际,再次向您致以最崇高的敬意!
感谢我的第二导师甘方良主任药师在校外实践方面给予我的指导和帮助,在您的指导下,我增长了许多临床和药学知识,开阔了自己的视野,提高了自己的临床药学实践水平,为日后的工作打下了一个良好的基础,非常感谢您的指导!
感谢药学院给我们提供了一个科研的平台和科研经费,感谢研究生处的老师为我们的学习和生活提供的帮助,感谢医药研究院给我们提供实验仪器和试剂,感谢各位老师给予我们的热情而无私的帮助,也感谢在实验中给予我热心帮助的同学们,这段共同学习的经历将成为我人生中的一笔宝贵财富。
感谢三年来朝夕相处而友爱的室友,常敬娟和杨珍,感谢在实验中给予我帮助的任平教授、蔡飞教授、胡旺平教授和邱春玉老师,感谢师姐樊真真、刘晓燕,师兄潘海华、胡少阳,同窗刘欢、崔婷,师弟荆潇宽、雷欢、邱鹏,师妹杨可、梁瑞华、吴娜,你们使我三年的科研生活变得多姿多彩,充满乐趣。
最后感谢我的家人,感谢您们对我的付出,您们的爱与支持是我前行的不懈动力,养育之恩,无以言表!