摘 要: 随着基因工程技术、免疫学和分子生物学技术的飞速发展,疫苗的种类不断增多、生产方式不断建立和优化。利用转基因技术将植物作为生物反应器,生产出转基因植物疫苗已成为研究热点之一。转基因植物疫苗的制备主要通过目标抗原的确定、受体植物的选择、植物表达载体的构建、转化、表达及检测等步骤组成。目前,转基因植物疫苗按照功能可大体分为细菌疫苗、病毒疫苗、寄生虫疫苗、避孕疫苗及糖尿病疫苗等,并已成功在植物中陆续表达了抗原基因。经一系列生物或临床试验后,在机体中均产生了明显的免疫应答,在试验范围内分别起到了抵抗病原微生物、防治寄生虫、避孕、预防治疗糖尿病等作用。通过优化启动子、选取高表达量受体植物、采用外源蛋白叶绿体表达、敲除转基因植物抗性基因等手段,将不断弥补转基因植物疫苗应用方面的不足。本文主要综述了转基因植物疫苗创制的基本流程、研究进展等,以期为今后转基因植物疫苗的开发和应用提供参考与思路。
关键词: 基因工程; 转基因技术; 抗原基因表达; 免疫应答;
Abstract: With the rapid development of genetic engineering, immunology and molecular biology technologies, the types of vaccines are increasing, and the methods are being continuously established and optimized. Using transgenic plants as bioreactors to produce transgenic plant vaccines has become one of hot topics today. The preparation of transgenic plant vaccines mainly comprises of determining the target antigen, selecting the recipient plant, constructing the plant expression vector, transforming, expressing, detecting and so on. Nowadays, genetically modified plant vaccines can be broadly classified into bacterial vaccines, viral vaccines, parasitic vaccines, contraceptive vaccines and diabetes vaccines by function, the corresponding antigens have been successfully expressed in plants. After a series of biological or clinical trials, obvious immune responses were produced in the bodies, which played a role in resisting pathogenic microorganisms, preventing and controlling parasites, contraception, and preventing and treating diabetes respectively during the experiment. The shortcomings of transgenic plant vaccines will be continuously overcome by optimizing the promoter, selecting high expression receptor plants, using exogenous protein chloroplast expression, knocking out resistance genes in transgenic plant and other new methods. This paper mainly reviews the basic procedures and research progress of transgenic plant vaccines, so as to provide references and ideas for the development and application of transgenic plant vaccine in the future.
Keyword: genetic engineering; transgenic technology; antigen gene expression; immune response
转基因植物疫苗是利用分子生物学与基因工程技术将抗原编码基因通过构建植物表达载体导入受体植物,利用植物的全能性使其在体内表达出具有免疫活性的蛋白质,得到能使机体具有免疫原性的基因重组疫苗,机体通过注射或食用含目标抗原的转基因植物蛋白,激发免疫系统产生免疫应答,从而产生特异性的抗病能力[1]。1987年第38届组织培养协会(The Tissue Cutural Association)年会提到了转基因植物的研究,Curtiss等[2]于1990年率先获得含链球菌变异株(Streptococcus mutants)表面抗原A(spaA)的转基因烟草。
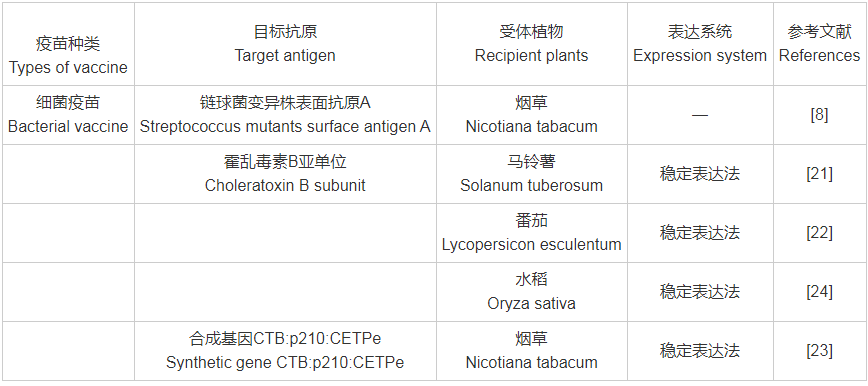
转基因植物疫苗以植物作为生物反应器,可以在植物内对抗原进行表达,同时对蛋白进行准确的加工修饰,相较于传统疫苗,具有生产成本低、生产周期短、成功率高,易形成规模化生产等优势。尽管转基因植物疫苗的研究还处于起步阶段,但已报道的转基因植物生物试验取得了很大进展。截止目前,常见转基因植物疫苗的目标抗原(附表1)包含细菌类[如霍乱毒素B亚单位(Choleratoxin B subunit,CTB)、大肠杆菌不耐热肠毒素B亚单位(Escherichia coli heat-labile toxin B subunit,LTB)、结核杆菌素(Mycobacterium tuberculosis)、幽门螺旋杆菌细胞毒素相关蛋白(Helicobacter pylori Cytotoxin associated protein)等]、病毒类[如乙型肝炎病毒(Hepatitis B virus)、口蹄疫病毒(Foot and Mouth Disease Virus,FMDV)、轮状病毒(Rotavirus,RV)、诺沃克病毒(Norwalk Virus,NV)等]、寄生虫类[如疟原虫(Plasmodium)、吸血虫(Schistosoma)、肝片吸虫(Fasciola hepatica)等]、避孕类[如透明带(Zona Pellucida,ZP)]及糖尿病类[如胰岛素原(Proinsulin,PROIN)、GAD65抗原表位等],受体植物从较为简单的模式植物烟草、拟南芥,逐渐扩展为表达量相对较高的番茄、莴苣、白菜(Brassica pekineniss)、大豆、羽扇豆、玉米、马铃薯等。
美国最先批准Tacket等[3]将转入LTB的马铃薯进行了临床试验:14名志愿者中,11名食用转基因马铃薯,3名食用非转基因马铃薯,其中11名志愿者中有10名检测到血液中含有抗体。随后,Kapusta等[4]也进行了含乙肝病毒表面抗原(hepatits B surface an tigne, HBsAg)莴苣的临床试验,结果显示,3名志愿者在2个月内进行2次免疫,两周后检测体内的抗体滴度最高可达100 IU·L-1。随着生物技术的不断发展和优化,转基因植物疫苗可能开创疫苗生产及应用的新途径,其产生的经济及社会效益将极大地推动疫苗研制、病原防治、机体免疫方面的发展。
1、 转基因植物疫苗创制的基本流程
常规转基因植物疫苗的获取途径有两种:1)稳定性遗传表达:通过抗原的结构基因构建植物表达载体,再借助一系列方法将外源基因整合至植物基因组,获得能够稳定遗传的目标植株;2)瞬时性高效表达:瞬时表达系统中外源DNA与受体植物基因组并不发生整合,而是在导入细胞一定时间后进行表达。植物中建立该系统的方法包括聚乙二醇法、电激法、基因枪法、病毒感染法和农杆菌介导法等。以最常用的病毒感染法为例(图1)[5],将目标抗原与作为载体的植物病毒进行融合表达,感染植株或植物细胞后,使之瞬时表达。常规需对表达的目标蛋白进行分离及纯化以确定其表达准确性,最后进行生物检测,获取转基因植物疫苗。
图1 转基因植物疫苗的基本操作流程[5]
![图1 转基因植物疫苗的基本操作流程[5]](http://www.xueshut.com/uploads/allimg/201208/36-20120Q152129C.jpg)
Fig.1 Basic operational procedures for transgenic plant vaccines[5]
1.1 、目的抗原的选择
转基因植物疫苗生产的是亚单位疫苗,其中仅含具有免疫原性的抗原结构基因,不含其他遗传信息。通过使用这种疫苗,可以使机体诱导产生免疫应答从而起到抵抗病原微生物、防治寄生虫、避孕、预防治疗糖尿病等作用[6]。在选择抗原时,首先要选取病原体具有免疫活性的抗原DNA,一般为病原体表面编码糖蛋白的基因。而对于易变异的病毒,则选取各亚型共有的核心蛋白为主要保护性抗原基因序列[7]。目前,已成功将细菌、病毒、寄生虫等部分结构基因作为外源基因导入受体植物并得到有效地表达,并检测到良好的免疫原性。
1.2、 受体植物的选择
转基因受体植物的选择对于抗原编码基因的表达量及口服疫苗的应用前景有着十分重要的意义。受体植物应具备易遗传操作、表达量高、基因序列已知、易再生、种植区域广泛、易于储存及运输和适宜口服等特点[8]。在选择受体植物的过程中,要根据各种植物的优势与不足,所表达的疫苗类型以及免疫对象来选择合适的受体植物。烟草作为最早的模式植物生物反应器,因其无法直接食用等缺点,不易于大规模推广生产。随着转基因技术的日趋成熟,能够利用的转基因植物种类越来越多,目前常用于表达转基因疫苗的植物有芥菜、芒果(Mangilera indica)、莴苣、菠菜、番茄、胡萝卜、苹果、豇豆、苜蓿及一系列农作物等(附表1)。
1.3 、表达载体的构建
载体的构建是通过酶切等手段将目的基因与选取的质粒进行连接,验证并提纯后转化至感受态细胞,从而用于植物的外源蛋白表达。构建植物表达载体的主要目的是将目的基因进行修饰改造,使其转入受体植物后表达符合需求,常用稳定遗传表达载体包括Gateway、pBI系列、pCAMBIA系列、pRTL系列、pPZP系列等(附表2),而瞬时表达系统通常选用花椰菜花叶病毒(Cauliflower mosaic virus,CMV)、烟草花叶病毒(Tobacco mosaic virus,TMV)等作为载体。
1.4 、载体的表达与转化
1.4.1、 稳定性表达系统
稳定表达系统是将外源抗原基因序列连接至载体上,并通过一系列方法将免疫原基因导入植物细胞中,使其在植物基因组中稳定地整合,在一定条件下将含有外源基因的植物细胞诱导长成新的植株,并在生长过程中表达目标抗原基因,将此性状传给子代,成为表达疫苗的品系[9]。目前广泛运用的基因整合方式有两种:一是整合到核基因组;二是整合到叶绿体基因组。该表达系统可以通过使用种子、块茎、根和叶组织来积累重组抗原。稳定表达系统的优点在于整合稳定、无需纯化、安全性好,可同时将多个外源基因进行表达,且较易获得大量转基因株系,但同时也存在目标蛋白表达量低、表达效率低、外源基因易失活、植株再生和纯合周期长、基因插入而造成的位置效应等弊端[10]。
1.4.2 、瞬时性表达系统
瞬时表达系统是将编码疫苗抗原决定簇基因序列插入病毒基因组中,基于植物病毒对植物的感染,以病毒作为载体将重组病毒接种至植物叶片上,使得抗原基因随病毒在植物体内进行复制、转录、翻译和装配,在转基因植物或细胞中产生多拷贝重组蛋白基因[11]。该体系具有用时较短、简单易操作、表达速度快、拷贝数高、不存在染色体上的位置效应等优点,而缺点是工作量较大、不能稳定遗传以及外源基因易丢失等。
1.5、 转基因植株的检测
根据自身试验需要,转化成功的植株要进行检测,以验证其表达出的疫苗抗原蛋白的真实性,一般分为三个阶段:一是针对导入的目标抗原核酸的检测;二是针对外源基因编码表达的目标蛋白的检测;三是进行生物试验,检测表达的目标蛋白是否具有生物活性(图2)。
关于核酸的检测分为DNA与RNA的检测。目前常用的检测DNA的技术有聚合酶链式反应(polymerase chain reaction, PCR),包括常规PCR[12]、竞争性定量PCR、实时荧光定量PCR、多重PCR、数字PCR[13]、巢式和半巢式PCR[14]等,Southern blot,核酸等温扩增技术[15],包括环介导等温扩增、依赖核酸序列的等温扩增、链替代扩增和滚环扩增等,此外还有DNA芯片、表面等离子共振传感器[16]等方法。
现有常用的蛋白质检测技术有Western blot[17]、ELISA、测流免疫测定[18]、磁免疫电化学传感器、二维凝胶电泳[19]、质谱法、蛋白芯片等。除此之外,还应进行一系列生物试验,包括环境抗性试验、生物饲喂试验、生物注射试验及临床试验等。
2 、基因植物疫苗的研究现状
转基因植物疫苗的研究按受体植物可分为烟草、拟南芥、番茄、苜蓿、苹果、马铃薯等,按功能大致可分为五类,分别为细菌疫苗、病毒疫苗、避孕疫苗、糖尿病疫苗和寄生虫疫苗。目前,数十种转基因植物疫苗已进入动物试验,并检测出良好的免疫原性。一些转化编码基因的植物疫苗,如HbsAg、LTB、诺沃克病毒等,也已进入临床试验,用于预防和治疗乙型肝炎及细菌性腹泻,并在人体中产生免疫应答,显示出良好的免疫效果。
2.1 、细菌疫苗
2.1.1、 霍乱肠毒素B亚单位
CTB能与肠道粘膜细胞表面特异性的神经节苷脂结合而引起腹泻。最早由Arakawa等[20]将该基因导入马铃薯中,并获得稳定遗传的植株,小鼠经静脉注射后,其腹泻累积减少60%;随后Kim等[21]也成功将该基因通过农杆菌转化至马铃薯植株;Jiang等[22]借助农杆菌介导法将CTB基因转入番茄植株,获得较高纯度可溶性蛋白,将表达抗原基因的番茄饲喂小鼠一段时间后,在小鼠的血清和黏膜中检测出了霍乱毒素抗体。尽管CTB已在胡萝卜[23]等可食植物中成功表达,但Soh等[24]认为水稻更适合应用于口服疫苗,且获得了谷类作物中CTB含量较高的转基因植物,水稻种子中目标蛋白表达量在可溶性总蛋白中可达到21.3 ng·μg-1。CTB的研究相对较早,转化体系也相对较为成熟,现多与其他抗原进行融合表达。
图2 转基因植物的常规检测方法
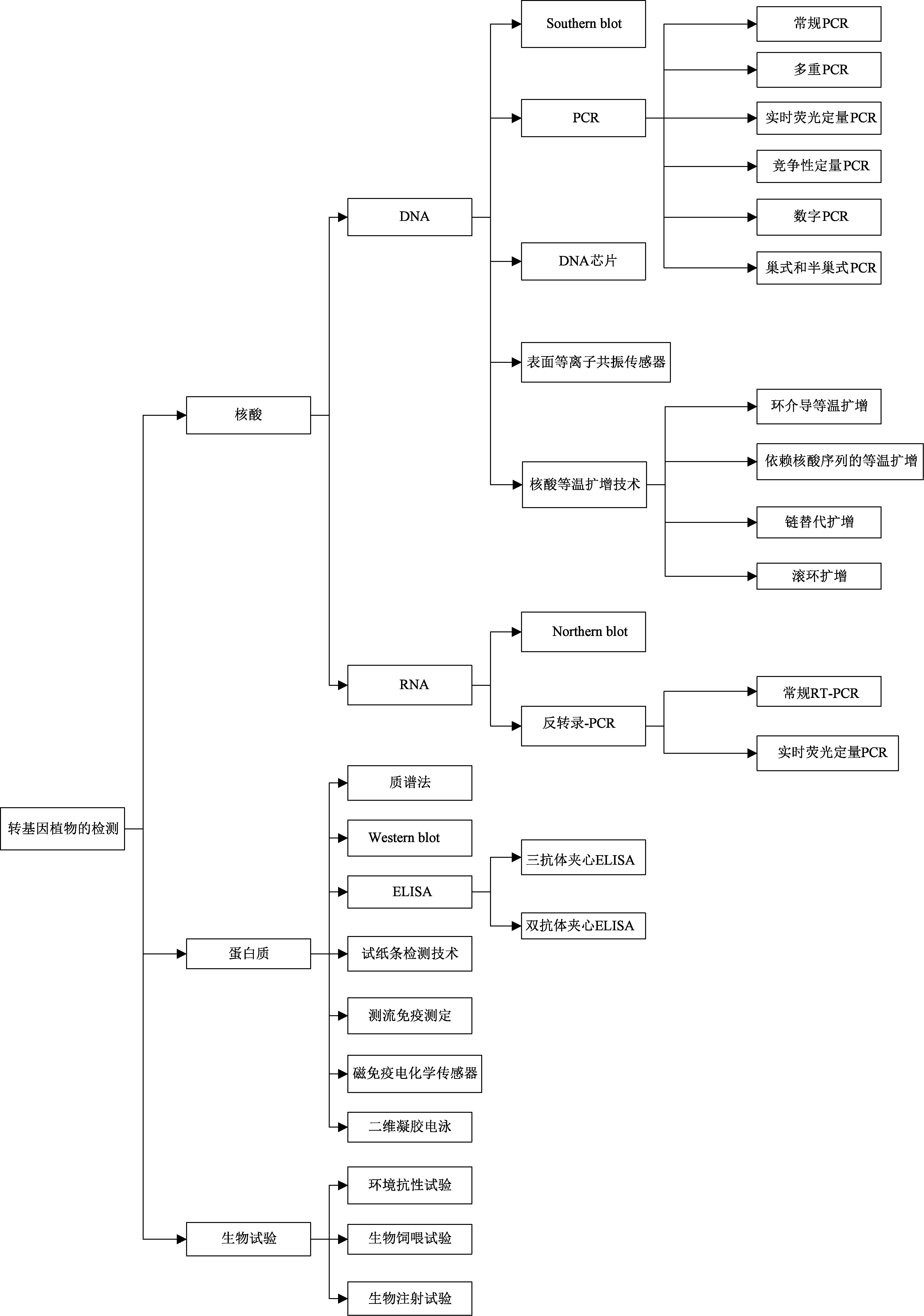
Fig.2 Conventional detection methods for transgenic plants
2.1.2、 大肠杆菌不耐热肠毒素B亚单位
大肠杆菌不耐热肠毒素(heat-labile toxin,LT)是由1个A亚单位(LTA)和5个B亚单位(LTB)组成,其中B亚单位具有与真核细胞表面的GM1-神经节苷脂受体特异性结合的能力。LTB不仅是强烈的免疫原,也是一种强有力的黏膜免疫佐剂。LTB基因最早由Haq等[25]于1995年在烟草和马铃薯中得到表达,通过管饲法免疫的小鼠产生了肠粘膜抗LTB免疫球蛋白,并且喂养小鼠新鲜转基因马铃薯块茎也引起口服免疫。而后Mason等[26]和Lauterslager等[27]也分别以农杆菌转化法将LTB基因导入马铃薯,并检测到小鼠产生了粘膜免疫反应。目前无毒性的LTB表达蛋白已在玉米[28]等植株中得到表达,且Soh等[24]在水稻球蛋白(Glb)启动子的控制下获得更高表达的外源蛋白,应用于口服疫苗以预防腹泻。由于人们习惯土豆和水稻熟食,但高温可能导致外源蛋白变性失活,从而影响免疫效果,故提高可直接食用植物的表达效率将有助于该类疫苗在人类临床上的发展。
2.1.3 、幽门螺旋杆菌
幽门螺杆菌病是一种螺旋形、微厌氧、对生长条件要求十分苛刻的细菌,已确认为是慢性胃炎和化性溃疡的主要致病因子。幽门螺旋杆菌细胞毒素相关蛋白(cytotoxin-associated gene A, CagA)已成功转入烟草和番茄[29]。Zhang等[30]利用农杆菌转化法获得转尿素酶B亚单位(urease B, UreB)胡萝卜植株,转化和再生的胡萝卜根中表达的UreB蛋白为25 μg· g-1,并且有效诱导了小鼠的免疫反应,此外,UreB抗原还在拟南芥[31]、烟草和水稻等植物中进行了表达。而Yang等[32]通过构建包含花生种子特异性启动子Oleosin的二元载体,获得高产UreB蛋白的转基因花生植株;Kalbina等[33]也于2010年成功构建3种不同幽门螺旋杆菌TonB蛋白载体,其表达量差异并不大,植物中的表达蛋白质浓度占总可溶性蛋白质的至少0.05%。近年来,幽门螺杆菌的相关基因的研究主要集中在细胞毒素相关蛋白(CagA)和尿素酶及其亚单位(Urease)上,但鲜有研究者对表达的上述3种外源蛋白的免疫效果进行比较。考虑到该类转基因植物疫苗的未来发展,研究者还应进一步探究其不同抗原基因表达产物的免疫活性。
2.1.4、 其他细菌疫苗
结核分枝杆菌是引起结核病的病原菌,可侵犯全身各器官,以肺结核最多见。目前已有结核杆菌ESAT-6在番木瓜[13]以及结核杆菌MPT64在胡萝卜[34]中分别进行了表达。Módolo等[35]在2018年获得了结核杆菌糖蛋白APA转基因拟南芥植株;Hajibehzad等[36]将志贺氏痢疾杆菌IpaD在烟草中获得瞬时表达,烟草叶片和毛状根中均检测到IpaD,且烟草毛状根中可溶性总蛋白最高表达量为0.94 ng·μg-1。Tregoning等[37]于2003年将破伤风毒素C片段(tetanus C segment, TetC)通过叶绿体转化烟草,烟草叶绿体中积累的TetC占可溶性细胞总蛋白的10%,质体所表达的TetC抗体使小鼠产生了粘膜免疫应答。从以上研究结果来看,细菌疫苗的研究还处于初级阶段,由于研究范围的限制,大多细菌疫苗以模式植物为主,且未能进入临床研究和试验,日后该类疫苗临床试验的开展将为人类抵御各类细菌病原体提供新的方向。
2.2 、病毒疫苗
2.2.1 、乙型肝炎病毒疫苗
乙型肝炎病毒携带者最终会因肝硬化或肝癌而死亡。乙肝表面抗原(hepatitis B sarface antigen, HBsAg)现已有表面S、M、L、HBc等蛋白获得表达。Mason等[38]最早将HbsAg导入烟草中,获得转基因植株。动物实验证明,将抗性植株叶片的蛋白提取物注入接种乙型肝炎病毒的小鼠中后,产生的免疫反应与酵母表达的HbsAg相当。随后也成功获得了含编码基因的番茄[39]、香蕉[40]、胡萝卜[41]、花生[42]、人参[43]、大豆[44]、苹果[45]、豇豆[46]、烟草[47]等植株。Deineko等[48]发现将preS2-S抗原定向转运至内质网腔的信号肽序列,可明显增强目标蛋白在转基因胡萝卜中的积累,这为转基因植物疫苗的研制提供了新的思路。Thanavala等[49]将HBsAg抗原含量为8.5±2.1 μg·g-1的转基因马铃薯对42名志愿者进行了试验,随机分为3组,结果显示,食用HBsAg马铃薯的志愿者均表现出滴度明显增强的效果,且食用次数越多滴度越高。乙型肝炎病毒易产生变异,可使机体免疫应答低下,增加了肝炎发病率及患者死亡率,转基因植物疫苗在乙型肝炎病毒方面的研究将为临床上治疗由该病毒引发的疾病提供新的方法。
2.2.2 、口蹄疫病毒疫苗
口蹄疫(foot-and-mouth disease virus,FMDV)是由口蹄疫病毒引起的一种感染偶蹄动物的急性、热性、高度接触性传染病。其结构蛋白基因 VP1为主要抗原位点,可产生中和抗体、诱导免疫反应,是重点研究对象[50]。1993年,Usha等[51]率先将VP1基因插入豇豆花叶病毒 (Cowpea Mosaic Virus,CPMV)外壳蛋白基因组中,将利用杂合病毒粒子制备的成疫苗免疫豚鼠,结果在机体中检测到抗体蛋白。随后,将该编码基因陆续导入了拟南芥、苜蓿、烟草、马铃薯、番茄等植物中并成功表达,获得了具有免疫原性的抗体蛋白。此外,Dus Santos等[52]利用农杆菌转化法将口蹄疫病毒(FMDV)衣壳蛋白前体P1及蛋白酶3C导入苜蓿,将转基因植物提取物3次免疫小鼠,10 d后在小鼠血样中检测到特异性FMDV抗体。FMDV表位疫苗的研究一直广受关注,O型FMDV合成肽疫苗现已被应用于猪的免疫,具有明确的免疫保护效果。针对抗原结构差异较大的A型FMDV表位疫苗的免疫效果是广受关注的研究内容,将为未来A型FMDV的防控提供新的方法。
2.2.3、 轮状病毒
轮状病毒属于呼肠孤病毒科,是病毒性腹泻最主要的病原物。研究证实,轮状病毒表面抗原VP7、VP4具有中和抗原活性,VP6具有保护抗原活性,具有较高的免疫原性和反应原性[53,54]。已报道将轮状病毒VP7导入马铃薯和胡萝卜中,结果均反映在植株中产生了具有活性的抗原蛋白。Kim等[55]将轮状病毒VP6导入番茄细胞,在悬浮培养体系中,借助丁酸钠的诱导获得最高重组VP6 0.73 mg·L-1;而Dong等[56]利用农杆菌转化法获得了转基因轮状病毒VP6苜蓿植株,苜蓿中VP6蛋白表达量占总可溶性蛋白的0.28%,强饲小鼠后,小鼠的腹泻症状明显减轻。轮状病毒是引起婴儿及幼龄动物胃肠炎和腹泻的主要病因,从研究结果上看,VP6蛋白可能具有更好的免疫效果且具有更广泛的应用前景。
2.2.4 、其他人类致病病毒
人类免疫缺陷病毒(human immunodeficiency virus,abbr: HIV),是于1981年首次在美国发现的造成人类免疫系统缺陷的一种病毒。它是一种感染人类免疫系统细胞的慢病毒(Lentivirus),属逆转录病毒。2002年Zhang等[57]报道了将人类免疫缺陷病毒(HIV-1)P4蛋白导入烟草。随后Karasev等[58]运用基因枪法获得转HIV-1 Tat蛋白基因菠菜,对小鼠进行时隔一周的3次口服免疫,发现小鼠体内Tat抗体滴度升高,并在接种4周后达到峰值。截至目前,HIV-1的gap及gp120在番茄中得到表达,Vafaee等[59]于2018年在转基因莴苣中获得较高的重组蛋白,表达量高达8.942 μg·100 mg-1。
人乳头瘤病毒(Human papilloma virus,HPV)是一种属于乳多空病毒科的乳头瘤空泡病毒,是球形DNA病毒,可引起人类良性的肿瘤和疣。现已成功将HPV-16 L1转入马铃薯[60]、烟草[61]和番茄[62,63]。此类疫苗还有诺沃克病毒疫苗[64]、结肠直肠癌(Carcinoma of colon and rectum)疫苗[65]、非霍奇金淋巴瘤(Non-hodgkin’s lymphoma,NHL)疫苗[66]、麻疹病毒(Measles virus,MV)疫苗[67]、扎伊尔埃博拉病毒(Zaire ebolavirus)疫苗[68,69]、登革热病毒(Dengue virus,DV)疫苗[70]、人巨细胞病毒(Human cytomegalovirus)疫苗[71]、花粉过敏疫苗[72]、狂犬病病毒(Rabies virus,RV)[73,74]等。这些致病病毒主要集中于瞬时表达,未来在上述病毒的稳定遗传表达方面的发展,将推动各病毒类疾病在临床上的预防和治疗。
2.2.5 、其他动物致病病毒
动物致病病毒通常会对牲畜、家禽类动物的饲养过程带来巨大损失,为有效防止病害带来的灾难性后果,现已成功获得一批转基因植物疫苗。Tien等[75]将猪流行性腹泻病毒(Porcine Epidemic Diarrhea Virus, PEDV)S1D抗原通过叶绿体转化法导入烟草,植株可溶性S1D蛋白单独表达量约为总量的0.07%,融合蛋白S1D-CTB表达水平达到1.4%;An等[76]获得了表达猪生殖和呼吸综合征病毒(Porcine Reproductive and Respiratory Syndrome Virus,PRRSV)GP4D和GP5D蛋白的拟南芥植株,在转化的拟南芥中获得1.66%目标蛋白,并在生物试验的猪体内检测到特异性抗体。2015年,Mbewana等[77]在烟草中瞬时表达了甲型H5NI禽流感病毒M2e蛋白,并将植物产生的重组蛋白纯化后注射到小鼠中,Western印迹分析证实在免疫的小鼠血清中存在M2e特异性抗体。动物与人类的生活息息相关,对畜禽类动物的病原微生物密切关注并及时采取预防措施不仅有利于保护动物,减少饲养损失,还可间接地对人的生命健康产生积极影响。
2.3、 寄生虫疫苗
疟疾是世界性的严重寄生虫病。寄生虫病严重危害养殖业,在生产实践中,因化学药物的大量使用,导致许多寄生虫已产生抗药性,传统的化学药物防治方法受到了严重挑战,而转基因植物疫苗开辟了有效控制寄生虫病的途径。Turpen等[78]将编码疟原虫抗原决定簇基因插入烟草花叶病毒,以构建植物病毒载体,然后转染烟草, 在叶片中获取到0.4~1.2 mg·g-1 湿重重组蛋白。李霞等[79]将疟原虫多表位抗原基因与CTB基因融合构建植物表达载体,随后转化至烟草,经PCR检验证实整合成功。目前,已有弓形虫SAG1基因[80]、肝片吸虫主要保护性抗原基因FH3、日本血吸虫铁蛋白[81]基因转入到番茄、紫花苜蓿和油菜植株中,并成功获得了表达抗原的转化植株。
2.4 、避孕疫苗
哺乳动物卵透明带是由卵母细胞及颗粒细胞分泌并覆盖于卵母细胞及着床前受精卵外的一层基质,ZP蛋白在精卵结合及精子穿透卵透明带中起着非常重要的作用,影响受精过程的成败。Fitchen等[82]将小鼠ZP3蛋白的抗原决定簇插入TMV的衣壳蛋白中,转染植物并获得高水平的融合蛋白,用这些提取病毒样颗粒作为抗原进行肠胃外免疫,使得小鼠血清抗体识别了体内的ZP3表位,且发现透明带聚集有抗ZP3抗体,从而达到了避孕的效果。截至目前,转基因避孕疫苗的报道相对较少,若转基因避孕疫苗开发成功,则将极大地便利相关人群。
2.5、 糖尿病疫苗
人类Ⅰ型糖尿病是一种器官特异性自身免疫疾病,目前主要通过注射胰岛素来控制高血糖。陈丽[83]将胰岛素原和胰岛素B链(insulin B chain,INSB)导入马铃薯,获得转基因植株;而侯宇清[84]利用基因枪法,将多Ⅰ型糖尿病发生的一种自身抗原—肽P277与CTB融合基因转入小麦,获得转基因糖尿病疫苗。Ruhlman等[85]通过叶绿体转化法将CTB与人胰岛素原(Pins)导入烟草,与阴性对照的胰岛中剩余的少量β细胞相比,CTB-Pins处理的小鼠的胰岛中产生胰岛素的β细胞显着增加,具有较低的血液或尿液葡萄糖水平;Kwon等[86]在烟草中使CTB与艾塞那肽(exenatide)进行融合表达,其表达水平达到总叶蛋白的14.3%; Choi等[87]使用瞬时转化法,在普通烟草叶片中检测到艾塞那肽-4与人转铁蛋白融合蛋白产量高达37 μg·g-1,并且在本塞姆氏烟草的瞬时转化叶中获得137 μg·g-1的表达量。糖尿病作为人体的一种代谢障碍疾病,若不进行有效地控制,将为人体带来一系列致命的影响,而糖尿病疫苗在各类可食用植物方面的研制,将为各类型糖尿病人的治疗提供新的手段,这在糖尿病防治历程中具有里程碑式的意义。
3 、总结与展望
相较于传统疫苗转基因植物疫苗有极大的优势,但还存在一些问题:1)抗原表达效率低:这也是目前转基因植物疫苗所面临的最大问题之一,外源蛋白表达含量低,在使用过程中易失去生物活性,限制了其开发与应用。2)生物安全性:转基因植物的基因渗入[11],一方面转基因植物的抗生筛选可能对应用机体产生不可预测的危害,另一方面若进行大规模的种植也可能会对周围环境中其他生物造成一定影响。3)免疫效果差:转基因植物作为一种口服疫苗使用时,其外源蛋白会经消化系统被不同程度地降解,从而降低抗原性[88]。4)耐受性:机体的免疫耐受性是免疫剂量、免疫程序、抗原特异性等多因素综合作用的结果,当机体对该疫苗产生免疫耐受性,会导致免疫效果变差。
针对上述问题,目前对于转基因植物疫苗的优化可采取以下措施:1)不同的启动子在不同的转基因植物中表达效率差异大,且不同植物对目标抗原的表达量也不同,因此,采取优化启动子或优选受体植物的方法提高目标蛋白的表达量。此外,将抗原DNA整合至叶绿体基因组或核基因组也有利于提高表达效率。2)利用叶绿体的母系遗传使外源蛋白靶向于叶绿体也可以解决基因渗入的不良影响。此外,也可在种子特异性或花粉特异性启动子的控制下,使用可逆抑制基因以产生不育植物或利用基因工程技术对转基因植物的抗性基因进行敲除。3)尝试使用沙门氏菌和弧状霍乱杆菌作为载体菌株[89]或利用包衣对口服疫苗进行保护性包被从而提高其在消化道内的稳定性,提高免疫效果。4)可减少服用或使用次数,加大单次摄入量等方式以避免耐受性问题。
综上所述,因植物疫苗能提供相对廉价的蛋白质源,故利用转基因植物开发新型疫苗是一种较经济有效的途径,且具有广阔的发展前景。相信随着植物学、免疫学、分子生物学等各个学科领域的迅速发展,对转基因植物的编码基因表达、产物植株的免疫原性和临床评价的深入研究,转基因植物疫苗能够不断优化,得到广泛应用并造福人类。
附表1 目标抗原与受体植物、表达系统对照表
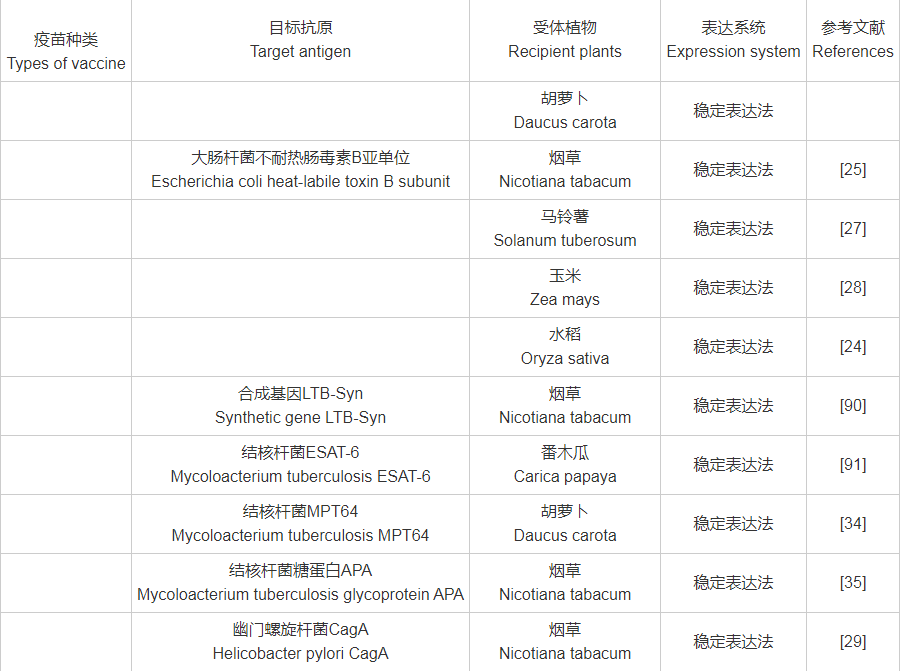
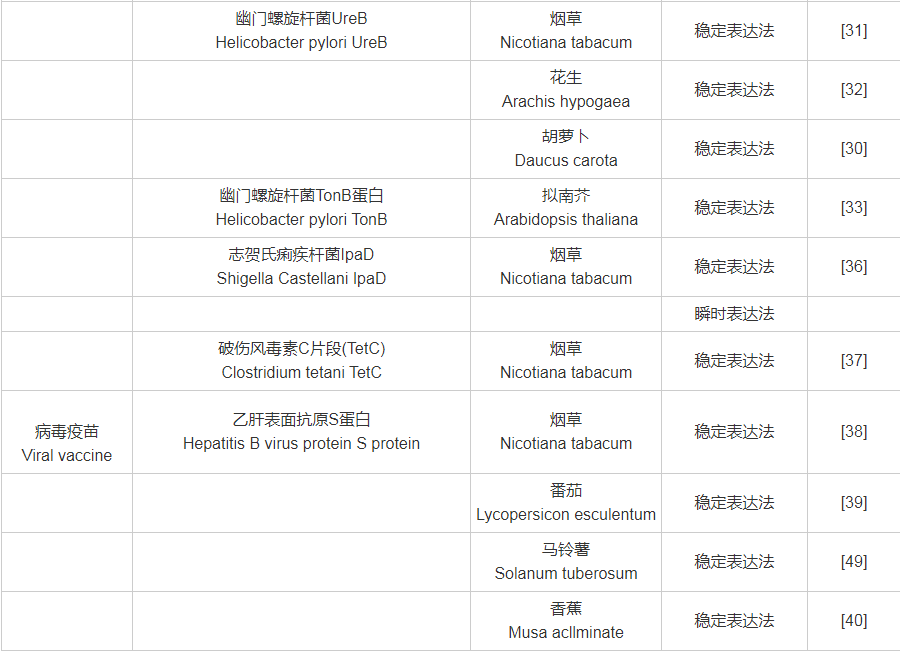
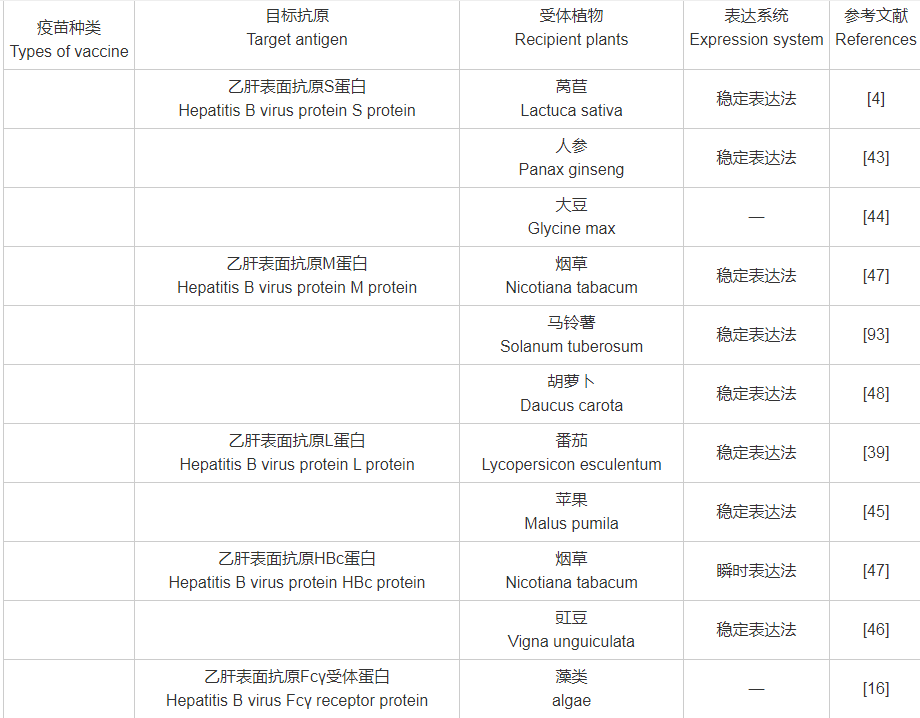
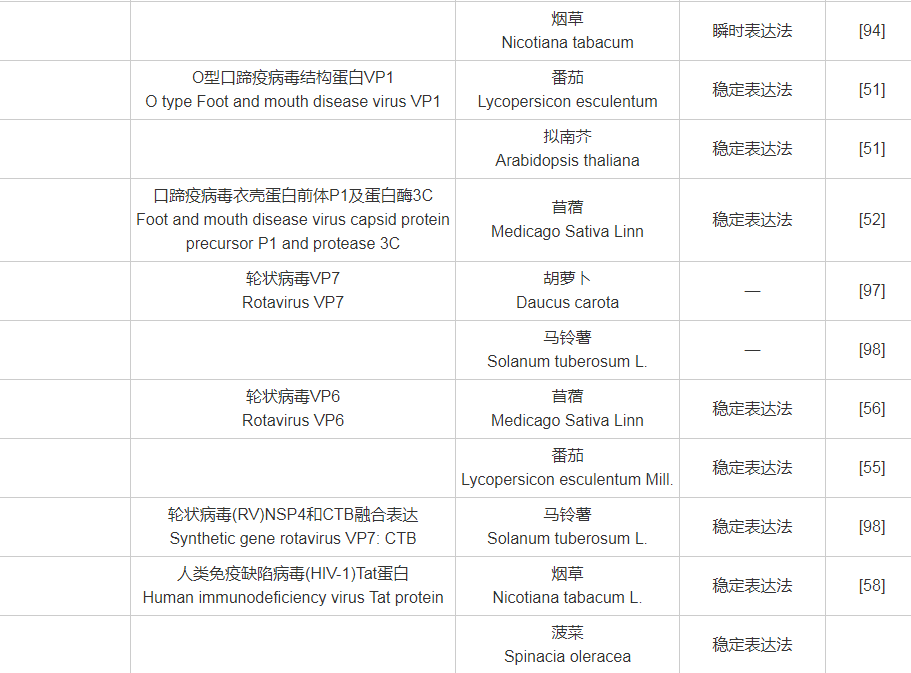
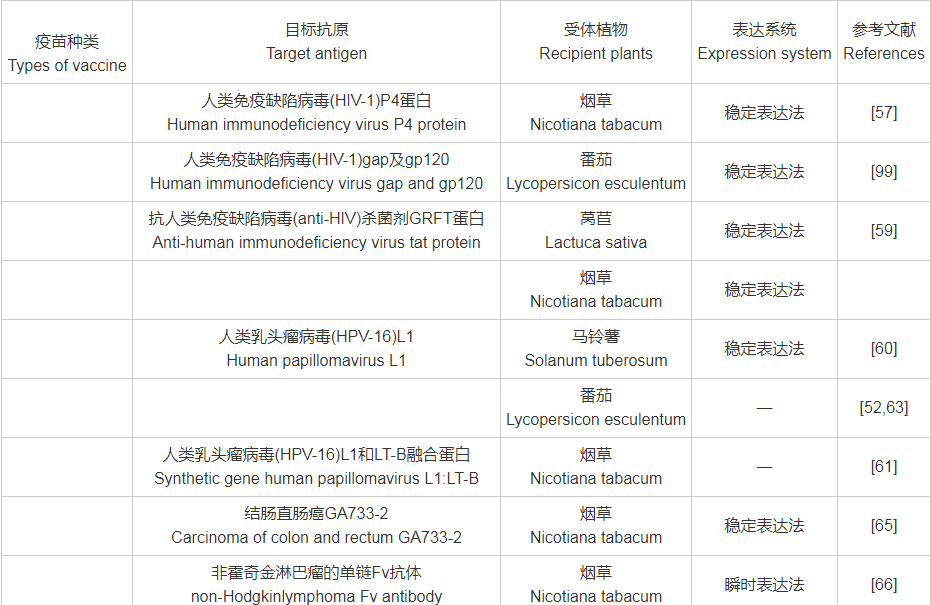
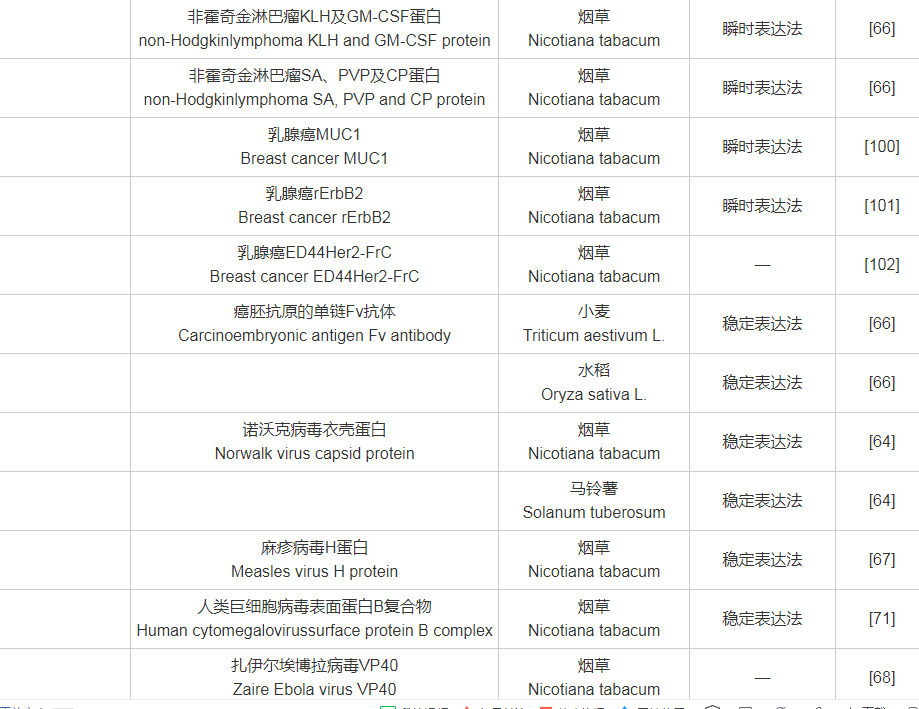
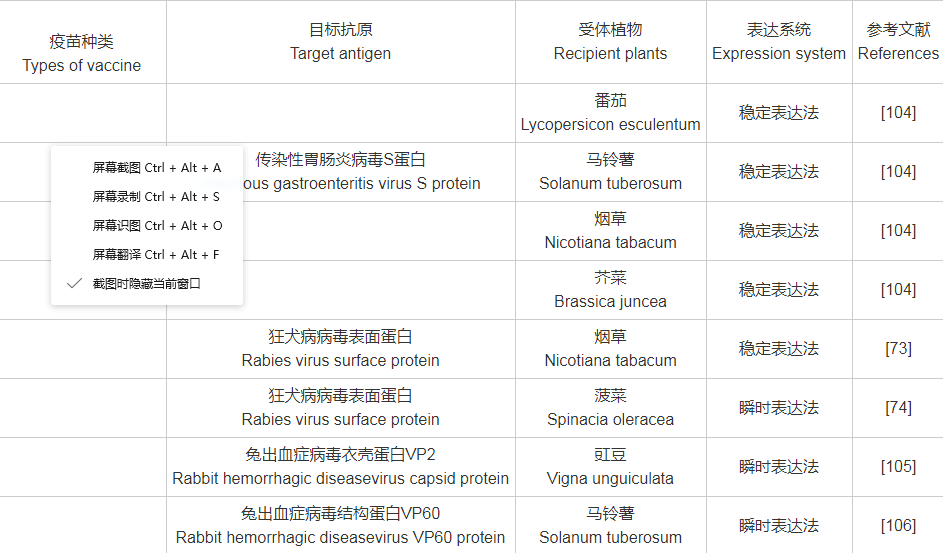
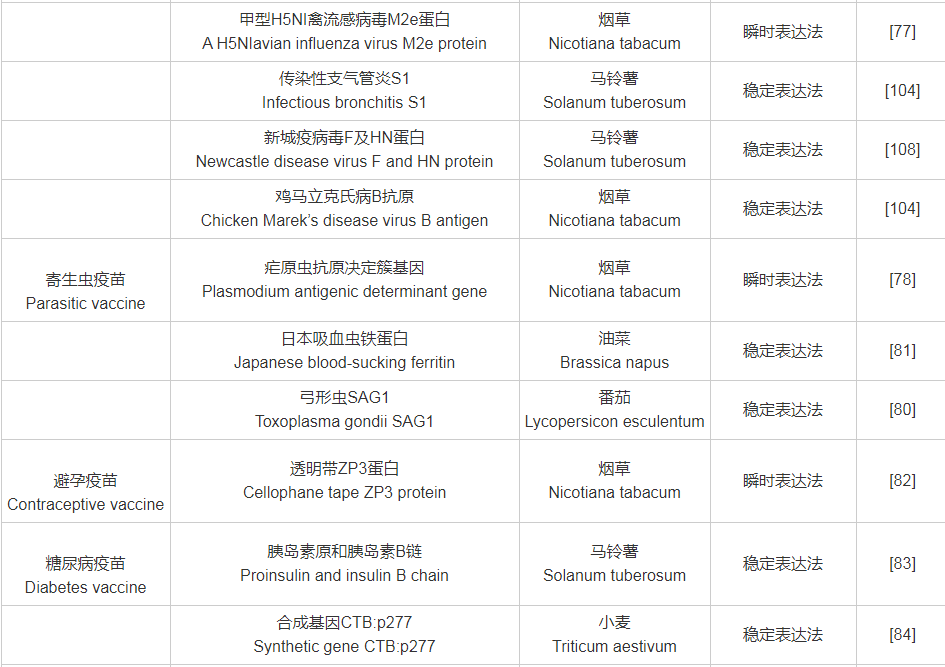
附表1(续)
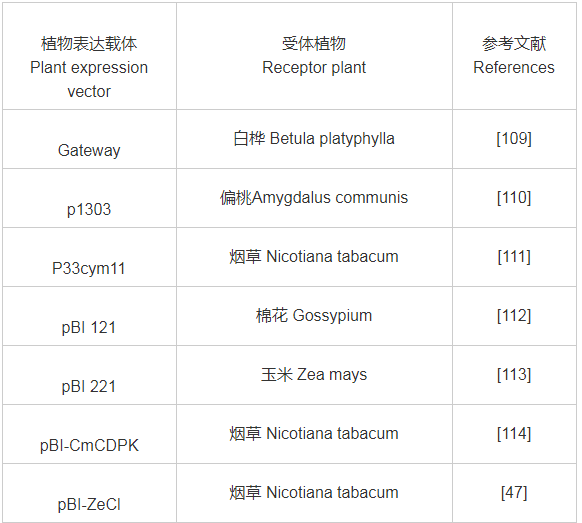
附表2 近年常用植物表达载体与受体植物一览表

参考文献
[1]Mason H S,Warzecha H,Mor T,Arntzen C J.Edible plant vaccines:Applications for prophylactic and therapeutic molecular medicine[J].Trends Molecular Med,2002,8(7):324-329
[2]Curtiss R I,Cardineau C A.Oral immunization by transgenic plants[J].World Plant Application,1990,90:107-111
[3]Tacket C O,Mason H S,Losonsky G,Clements J D,Levine M M,Arntzen C J.Immunogenicity in humans of a recombinant bacterial antigen delivered in a transgenic potato[J].Nature Medicine,1998,4(5):607-609
[4]Kapusta J,Modelska A,Figlerowicz M.A plant-derived edible vaccine against hepatitis B.virus[J].The FASEB Journal,1999,13(13):1796-1799
[5]Mason H S,Arntzen C J.Transgenic plants as vaccine production systems[J].Trends in Biotechnology,1995,13(9):388-392
[6]李杨,李志勇,柳纪省.转基因植物疫苗研究进展[J].生物技术通报,2010(4):28-32
[7]Tae-Geum K,Moon-Sik Y.Current trends inedible vaccine development using transgenic plants[J].Biotechnology and Bioprocess Engineering,2012,15(1):61-65
[8]董伟,易自力,蒋建雄,钟军.转基因植物口服疫苗研究进展[J].动物医学进展,2005,26(6):6-8
[9]张立军.转基因植物疫苗研究现状[J].内蒙古中医药,2014,33(5):117-119
[10]Wong-Arce A,González-Ortega O,Rosales-Mendoza R.Plant-made vaccines in the fight against cancer[J].Trends in Biotechnology,2017,35(3):241-256
[11]Kumar G,Karthik L,Rao K V B.Plant vaccines:An overview[J].Microbial Bioprospecting for Sustainable Development,2018,35(3):249-263
[12]魏兵,李云,杜宁霞,刘欣.毛白杨杂种外源基因稳定性及对土壤微生物的影响[J].核农学报,2009,23(6):1054-1059
[13]Fu W,Zhu P Y,Wang C G,Huang K L,Du Z X,Tian W Y,Wang Q,Wang H Y,Xu W T,Zhu S F.A highly sensitive and specific method for the screening detection of genetically modified organisms based on based on digital PCR without pretreatment[J].Scientific Reports,2015,5(1):1-10
[14] Huang Z,Dry I,Webster D,Strugnell R,Wesselingh S.Plantderived measles virus hemagglutinin protein induces neutralizing antibodies in mice[J].Vaccine,2001,19(15/16):2163-2171
[15]叶璟,朱慧.核酸等温扩增产物检测方法的研究进展[J].科技通报,2019,35(3):215-218
[16]Vanier G,Stelter S,Vanier J,Hempel F,Maier U G,Lerouge P,Ma J L,Bardor M.Alga-made anti-Hepatitis B antibody binds to human Fcγreceptors[J].Biotechnology Journal,2017,13(4):e1700496
[17]仪登霞.转Bt双价基因甘蓝的抗虫性及遗传稳定性研究[D].北京:中国农业大学,2014:23
[18]Holst-Jensen A,Ronning S B,Lovseth A,Berdal K G.PCRtechnology for screening and quantification of genetically modified organisms (GMOs)[J].Analytical and Bioanalytical Chemistry,2003,375(8):985-993
[19]张超,郭斌,祁洋,孙杰,薛柯,戴佳锟,关正君,尉亚辉.转HBs Ag基因樱桃番茄组培苗叶片总蛋白双向电泳体系的建立[J].核农学报,2012,26(8):1111-1117
[20]Arakawa T,Chong D K X,Langridge W H R.Efficacy of a food plant based oral choleratoxin B subunit vaceine[J].Nature Biotechnology,1998(16):292-297
[21]Kim T G,Gruber A,Langridge W H R.HIV-1 gp120 V3 cholera toxin B subunit fusion gene expression in transgenic potato[J].Protein Expression and Purification,2004,37:196-20
[22]Jiang X L,He Z M,Peng Z Q,Qi Y,Chen Q,Yu S Y.Choleratoxin B protein in transgenic tomato fruit induces systemic immune response in mice[J].Transgenic Research,2007,16(2):169-175
[23]Govea-Alonso D O,Tello-Olea M A,Beltrán-López J,MonrealEscalante E,Salazar-Gonzalez J A,Banuelos Hernandez B,RosalesMendoza S.Assessment of carrot callus as biofactories of an atherosclerosis oral Vaccine prototype[J].Molecular Biotechnology,2017,59(11/12):482-489
[24]Soh H S,Chung H Y,Lee H H,Ajjappala H,Jang K,Park J H,Sim J S,Lee G Y,Lee H J,Han Y H,Lim J W,Choi I,Chung I S,Hahn B S.Expression and functional validation of heat-labile enterotoxin B (LTB) and cholera toxin B (CTB) subunits in transgenic rice (Oryza sativa)[J].Springer Plus,2015,4 (148):148-162
[25]Haq T A,Masson H S,Clements J D,Arntzen C.Immunization with a recombinant bacrerial antigen produced in transgenic plants[J].Science,1995,268(5211):714-716
[26]Mason H S,Haq T A,Clements J D,Arntzen C J.Edible vaccine protects mice against Escherichia coil heat-labile enterotoxin (LT):Potatoes espressing asynthetid LT-B gene[J].Vaccine,1998,16(13):1336-1343
[27]Lauterslager T G M,Florack D E A,van der Wal T J,Molthoff J W,Langeveld J P M,Bosch D,Boersma W J A,Hilgers L A T.Oral immunization of naive and primed animals with transgenic potato tubers espressing LT-B[J].Vaccine,2001,19(17/19):3661-3670
[28]Chikwamba R K,Cunnick J,Hathaway D,Mc Murray J,Mason H,Wang K.A functional antigen in a pratical crop:LT-B producing maize protests mice against Escherichia coli heat labile enterotoxin(LT) and cholera toxin(CT)[J].Transgenic Research,2002,11(5):479-493
[29]姜云水,方平楚,付亚萍,朱诚.幽门螺杆菌Cag A蛋白与CTB融合基因的克隆及其植物表达载体的构建[J].科技通报,2004,20(3):189-193
[30]Zhang H X,Liu M,Li Y J,Zhao Y H,He H,Yang G D,Zheng CC.Oral immunogenicity and protective efficacy in mice of a carrot derived vaccine candidate expressing Ure B subunit against Helicobacter pylori[J].Protein Express and Purification,2010,69(2):127-131
[31]Gu Q,Han N,Liu J Y,Zhu M Y.Expression of Helicobacter pylori urease subunit B gene in transgenic rice[J].Biotechnology Letters,2006,28(20):1661-1666
[32]Yang C Y,Chen S Y,Duan G C.Transgenic peanut (Arachis hypogaea L.) expressing the urease subunit B gene of Helicobacter pylori[J].Current Microbiology,2011,63(4):387-391
[33]Kalbina I,Engstrand L,Andersson S,Strid A.Expression of Helicobacter pylori Ton B protein in transgenic Arabidopsis thaliana:Toward production of vaccine antigens in plants[J].Helicobacter,2010,15(5):430-437
[34]王凌建,倪迪安,陈永宁,李忠明.利用转基因胡萝卜表达肺结核疫苗[J].植物学报,2001,43(2):132-137
[35]Módolo D G,Horn C S,Soares J S M.,Yunes J A,Lima L M,de Sousa S M,Menossi M.Transgenic Nicotiana tabacum seeds expressing the Mycobacterium tuberculosis Alanine-and Proline-rich antigen[J].AMB Express,2018,12(8):178-188
[36]Hajibehzad S S,Mehrizi F A,Honari H,Alizadeh H.Hijacking tobacco hairy roots and leaves in order to produce Ipa D antigen by means of different signal peptides[J].Journal of Crop Science and Biotechnology,2017,20(5):359-368
[37]Tregoning J S,Nixon P,Kuroda H,Svab Z,Clare S,Bowe F,Fairweather N,Ytterberg J,van Wijk K J,Dougan G,Maliga P.Expression of tetanus toxin Fragment C in tobacco chloroplasts[J].Nucleic Acids Research,2003,31(4):1174-1179
[38]Mason H S,Lam M K,Arntzen C J.Expression of Hepatitis B surface antigen in transgenic plants[J].Proceedings of the National Academy of Sciences of the United States of America,1992,89 (24):11745-11749
[39]Salyaev R K,Rekoslavskaya N I,Stolbikov A S,Hammond R W,Shchelkunov S N.Synthesis of hepatitis B virus surface antigen in tomato plants transgenic for the pre S2-S gene[J].Doklady Biochemistry and Biophysics,2007,416(1):290-293
[40]Sunil-Kumar G B,Ganapathi T R,Revathi C J,Srinivas L,Bopat VA.Expression of hepatitis B surface antigen in transgenic banana plants[J].Planta,2005,222(3):484-493
[41]赵秀英,张晓东,张霆,黄德庄,阎惠平,罗朝霞,杨凤平.乙肝病毒表面抗原基因在胡萝卜中的克隆及表达[J].微生物学免疫学进展,2002,30(1):1-4
[42]陈红岩,张军,高毅,杜海莲,马英,郑文竹,夏宁邵.乙肝病毒表面抗原基因在花生中的遗传转化及免疫原性检测[J].生物技术通讯,2002,13(4):245-250
[43]高正伦,盛军,刘丹,刘晓宇,李娟,郝淑美,吉海滨,刘建华.乙型肝炎病毒表面抗原基因在人参细胞中的高效表达[J].中国生物制品学杂志,2008,21(2):119-122,130
[44]Smith M L,Keegan M E,Mason H S,Shuler M L.Factors important in the extraction,stability and in vitro assembly of the hepatitis Bsurface antigen derived from recombinant plant systems[J].Biotechnology Progress,2002,18(3):538-550
[45]娄晓鸣,章镇,姚泉洪,熊爱生,王化坤,彭日荷,李贤.乙肝表面抗原大蛋白(S1S2S)基因在转基因苹果中表达[J].果树学报,2005,22(6):5-9
[46]Mechtcheriakova I A,Eldarov M A,Nicholson L,Shanks M,Skryabin K G,Lomonossoff G P.The use of viral vectors to produce hepatitis B virus core particles in plants[J].Journal of Virology Methods,2006,131(1):10-15
[47]Huang Z,Santi L,Le Pore K,Kilbourne J,Arntzen C J,Mason H S.Rapid,high-level production of hepatitis B core antigen in plant leaf and its immunogenicity in mice[J].Vaccine,2006,24(14):2506-2513
[48]Deineko E V,Zagorskaya A A,Pozdnyakov S G,Filipenko E A,Permyakova N V,Sidorchuk Y V,Uvarovac E A,Pozdnyakovac L D,Shumnya V K,Vlasovb V V,Hammond R V,Shchelkunov S N.Comparative analysis of HBV M-antigen production in leaves of inpidual transgenic carrot plants[J].Doklady Biochemistry and Biophysics,2009,425(1):76-79
[49]Thanavala Y,Mahoney M,Pal S,Scott A,Richter L,Natarajan N,Goodwin P,Arntzen C J,Mason H S.Immunogenicity in humans of an edible vaccine for Hepatitis B[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(9):3378-3382
[50]付薇,陈磊,熊毅,潘琼,王常伟,陈进喜,胡晓静,刘棋.O型口蹄疫病毒结构蛋白基因VP1的克隆与原核表达[J].安徽农业科学,2008,36(35):15386-15388
[51]Usha R,Rohll J B,Spall V E,Shanks M,Maule A J,Johnson J E,Lomonossoff G P.Expression of an animal virus antigenic site on the surface of a plant virus particle[J].Virology,1993,197(1):366-374
[52]Dus Santos M J,Carrillo C,Ardila F,Ros R D,Franzone P,Piccone M E,Wigdorovitz A,Borca M V.Development of transgenic alfalfa plants containing the foot and mouth disease virus structural polyprotein gene pland its utilization as an experimental immunogen[J].Vaccine,2005,23(15):1838-1843
[53]金奇,曾力宇,Jing H,Glass R I,Gentsch J R.世界范围内A组轮状病毒G1型毒株VP7基因及VP4基因高变区的分析[J].中华实验和临床病毒学杂志,1997(1):3-7
[54]李司,钟云平,张海花,应慧慧,于威,张耀洲.A组轮状病毒结构蛋白vp6在家蚕杆状病毒表达系统中的表达[J].蚕业科学,2012,38(6):1024-1028
[55]Kim C H,Kim K I,Hong S H,Lee Y H,Chung I S.Improved production of recombinant rotavirus VP6 in sodium butyrate supplemented suspension culture of transgenic tomato (Lycopersion esculentum Mill.) cells[J].Biotechnology Letters,2001,7 (13):1061-1066
[56]Dong J L,Liang B G,Jin Y S,Zhang W J,Wang T.Oral immunization with p Bs VP6-transgenic alfalfa protects mice against rotavirus infection[J].Virology,2005,339(2):153-163
[57]Zhang G G,Rodrigues L,Rovinski B,White K A.Production of HIV-1 p24 protein in transgenic tobacco plants[J].Molecular Biotechnology,2002,20(2):131-136
[58]Karasev A V,Foulke S,Wellens C,Rich A,Shon K J,Zwierzynski I,Hone D,Koprowski H,Reitz M.Plant based HIV-1 vaccine candidate:Tat protein produced in spinach[J].Vaccine,2005,23(15):1875-1880
[59]Vafaee Y,Alizadeh H.Heterologous production of recombinant antiHIV microbicide griffithsin in transgenic lettuce and tobacco lines[J].Plant Cell Tissue and Organ Culture,2018,135(1):85-97
[60]Warzecha H,Mason H S,Lane C,Tryggvesson A,Rybicki E,Williamson A L,Clements J D,Rose R C.Oral immunogenicity of human papillomavirus-like particles expressed in potato[J].Journal of Virology,2003,77(16):8702-8711
[61]Liu H L,Li X K,Lei T,Li W S,Lusheng S,Jin Z.Transgenic tobacco expressed HPV16-L1 and LT-B combined immunization induces strong mucosal and systemic immune responses in mice[J].Human Vaccine Immunotherapeutics,2013,9(1):83-89
[62]Monroy-García A,Go’mez-Lim M A,Weiss-Steider B,Herna’ndezMontes J,Huerta-Yepez S,Rangel-Santiago J F,Santiago-Osorio E,Mora Garc’a M de L.Immunization with an HPV-16 L1-based chimeric virus-like particle containing HPV-16 E6 and E7 epitopes elicits long-lasting prophylactic and therapeutic efficacy in an HPV-16 tumor mice model[J].Archives of Virology,2014,159(2):291-305
[63]Salyaey R K,Rekoslavskaya N I,Stolbikov A S.The new plant expression system for the development of vaccines against papillomaviruses[J].Dokl Biochem Biophys,2019,484(1):52-54
[64]Cortes-Penfield N W,Ramani S,Estes M K,Atmar R L.Prospects and challenges in the development of a norovirus vaccine[J].Clinical Therapeutics,2017,39(8):1537-1549
[65]Lu Z,Lee K J,Shao Y,Lee J H,So Y K,Choo Y K,Oh D B,Hwang K A,Oh S H,Han Y S,Ko K.Expression of GA733-Fc fusion protein as a vaccine candidate for colorectal cancer in transgenic plants[J].Journal of Biomedicine and Biotechnology,2012,2012:1-11
[66]Jobsri J,Allen A,Rajagopal D,Shipton M,Shipton M,Kanyuka K,Lomonossoff G P,Ottensmeier C,Diebold S S,Stevenson F K,Savelyeva N.Plant virus particles carrying tumour antigen activate TLR7 and induce high levels of protective antibody[J].PLo S One,2015,10(2):e0118096
[67]Huang Z,Dry I,Webster D.Plant-derived measles virus hemagglutinin protein induces neutralizing antibodies in mice[J].Vaccine,2001,19(15/16):2163-2171
[68]Monreal-Escalante E,Ramos-Vega A A,Salazar-Gonza’lez J A,Banuelos-Herna’ndez B,Angulo C,Rosales-Mendoza S.Expression of the VP40 antigen from the Zaire ebolavirus in tobacco plants[J].Planta,2017,246(1):123-132
[69]Ríos-Huerta R,Monreal-Escalante E,Govea-Alonso D O,Angulo C,Rosales-Mendoza S.Expression of an immunogenic LTB-based chimeric protein targeting Zaire ebolavirus epitopes from GP1 in plant cells[J].Plant Cell Report,2017,36(2):355-365
[70]Gottschamel J,Lossl A,Ruf S,Wang Y L,Skaugen M,Bock R,Clarke J L.Production of dengue virus envelope protein domainⅢ-based antigens in tobacco chloroplasts using inducible and constitutive expression systems[J].Plant Molecular Biology,2016,91 (4/5):497-512
[71]Tackaberry E S,Dudani A K,Prior F,Tocchi M,Sardana R,Altosaar I,Ganz P R.Development of biopharmaceuticals in plant expression systems:Cloning,expression and immunological reactivity of human cytomegalovirus glycoprotein B (UL55) in seeds of transgenic tobacco[J].Vaccine,1999,17(23/24):3020-3029
[72]Entesari M,Wakasa Y,Zanjani B M,Takaiwa F.Change in subcellular localization of overexpressed vaccine peptide in rice endosperm cell that is caused by suppression of endogenous seed storage proteins[J].Plant Cell Tissue and Organ Culture,2018,133(2):275-287
[73]Tiwari S,Mishra D K,Roy S,Singh A,Singh P K,Tuli R.High level expression of a functionally active cholera toxin B:Rabies glycoprotein fusion protein in tobacco seeds[J].Plant Cell Reports,2009,28(12):1827-1836
[74]Hu R,Zhang S,Fooks A R,Yuan H J,Liu Y,Li H T,Tu C C,Xia X Z,Xiao Y Q.Prevention of rabies virus infection in dogs by a recombinant canine adenovirus type-2 encoding the rabies virus glycoprotein[J].Microbes Infection,2006,8(4):1090-1097
[75]Tien N Q D,Huy N X,Kim M Y.Improved expression of porcine epidemic diarrhea antigen by fusion with cholera toxin B subunit and chloroplast transformation in Nicotiana tabacum[J].Plant Cell Tissue and Organ Culture,2019,137(2):213-223
[76]An C H,Nazki S,Park S C,Jeong Y J,Lee J H,Park S J,Khatun A,Kim W,Park Y,Jeong J C,Kim C Y.Plant synthetic GP4 and GP5 proteins from porcine reproductive and respiratory syndrome virus elicit immune responses in pigs[J].Planta,2018,247 (4):973-985
[77]Mbewana S,Mortimer E,Pêra F F P G,Hitzeroth I I,Rybicki E P.Production of h5n1 influenza virus matrix protein 2 ectodomain protein bodies in tobacco plants and in insect cells as a candidate universal influenza vaccine[J].Frontiers in Bioengineering and Biotechnology,2015,12(3):1-8
[78]Turpen T H,Reinl S J,Charoenvit Y,Hoffman S L,Fallarme V,Grill L K.Malarial epitopes expressed on the surface of recombinant tobacco mosaic virus[J].Nature Biotechnology,1995,13 (1):53-57
[79]李霞,陈杭,李晓东,钟辉,曹诚,马清钧.疟疾多抗原表位基因表达载体的构建及其在烟草中的表达[J].生物工程进展,1999,19(4):39-44
[80]周晓红,陈晓光,卢丽琴,李林,吴优,咸鹏,言慧,吴琨.弓形虫SAG1基因截短片段植物表达载体的构建[J].中国人兽共患病杂志,2004,20(8):662-665
[81]袁鑫.日本血吸虫铁蛋白基因的克隆及其在油菜中的表达和活性检测[D].长沙:湖南农业大学,2007:12
[82]Fitchen J,Beachy R N,Hein M B.Plants virus expressing hybrid coat protein with added murine epitope elicits autoantibody response[J].Vaccine,1995,13(12):1051-1057
[83]陈丽.CTB-PROIN和CTB-INSB融合基因构建及其在大肠杆菌和植物中的表达[D].银川:宁夏大学,2005:27
[84]侯宇清.转AGD2和CTB基因小麦的研究[D].武汉:华中农业大学,2011:18
[85]Ruhlman T,Ahangari R,Devine A,Samsam M,Daniell H.Expression of cholera toxin B-proinsulin fusion protein in lettuce and tobacco chloroplasts oral administration protects against development of insulitis in non-obese diabetic mice[J].Plant Biotechnology Journal,2007,5(4):495-510
[86]Kwon K C,Nityanandam R,New J S,Daniell H.Oral delivery of bioencapsulated exendin-4 expressed in chloroplasts lowers blood glucose level in mice and stimulates insulin secretion in beta-TC6 cells[J].Plant Biotechnology Journal,2012,11(1):77-86
[87]Choi J,Diao H,Feng Z C,Lau A,Wang R,Jevnikar A M,Ma S W.A fusion protein derived from plants holds promising potential as a new oral therapy for type 2 diabetes[J].Plant Biotechnology Journal,2013,12(4):425-435
[88]包慧芳,陈创夫,陈福双,任雪艳,王彦芹.转基因植物生产疫苗的研究现状及前景[J].动物科学与动物医学,2004,21(11):61-63
[89]Ryan E T,Butterton J R,Smith R N,Carroll A A,Crean T I,Calderwood S B.Protective Immunity against Clostridium difcile toxin a induced by oral immunization with a live,attenuated Vibrio cholerae vector strain[J].Infection And Immunity,1997,65(7):2941-2949
[90]Arevalo-Villalobos J I,Govea-Alonso D O,Monreal-Escalante E,Zarazua S,Rosales-Mendoza S.LTB-Syn:A recombinant immunogen for the development of plant-made vaccines against synucleinopathies[J].Planta,2017,245(6):1231-1239
[91]张更林,周鹏,郭平安,沈文涛,黎小瑛.转基因番木瓜作为抗结核杆植物口服疫苗的初步研究[J].云南植物研究,2003,25(2):223-229
[92]Marcondes J,Hansen E.Transgenic lettuce seedlings carrying hepatitis B virus antigen HBs Ag[J].The Brazilian Journal of Infectious Diseases,2008,12(6):469-471
[93]Joung Y H,Youm J W,Jeon J H,Lee B C,Ryu C J,Hong H J,Kim H C,Joung H,Kim H S.Expression of the hepatitis B surface Sand pre S2 antigens in tubers of Solanum tuberosum[J].Plant Cell Report,2004,22(12):925-930
[94]Carrillo C,Wigdorovitz A,Oliveros J C,Zamorano P I,Sadir A M,Gomez N,Salinas J,Escribano J M,Borca M V.Protective immune response to foot and mouth disease virus with VP1 expressed in transgenic plants[J].Journal of Virology,1998,72 (2):1688-1690
[95]Wigdorovitz A,Carrillo C,Dus Santos M J,Peralta A,Trono K,Gomez M C,Rios R D,Franzone P M,Sadir A M,Escribano J M,Borca M V.Induction of a protective antibody response to foot and mouth disease virus in mice following oral or parenteral immunization with alfalfa transgenic plants expressing the viral structural protein VP1[J].Virology,1999,255(2):347-35
[96]宋东光,张辉松,聂呈荣,黄林旋,王惠珍,张英慧,何丽烂,邓日烈.口蹄疫病毒VP1基因转化马铃薯及其块茎专一性表达[J].生物技术通报,2011(2):107-109,173
[97]刘满杏,李霞,刘荣堂,杨慧,赵丽,李鹏.轮状病毒VP7-U基因在胡萝卜中表达的免疫原性分析[J].草业科学,2012,29(12):1827-1831
[98]Wu Y Z,Li J T,Mou Z R,Fei L,Ni B,Geng M,Jia Z C,Zhou W,Zou L Y,Tang Y.Oral immunization with rotavirus VP7 expressed in transgenic potatoes induced high titers of mucosal neutralizing Ig A[J].Virology,2003,313(2):337-342
[99]余云舟,金宁一,王罡,季静,王萍,李昌.HIV-1 gag基因和gp120基因转化番茄及转基因植株再生[J].中国生物工程杂志,2004,24(2):37-40
[100]Pinkhasov J,Alvarez M L,Rigano M M,Piensook K,Larios D,Pabst M,Grass J,Mukherjee P,Gendler S J,Walmsley A M,Mason H S.Recombinant plant-expressed tumor-associated MUC1 peptide is immunogenic and capable of breaking tolerance in MUC1.Tg mice[J].Plant Biotechnology Journal,2011,9(9):991-1001
[101]Matic'S,Quaglino E,Arata L,Riccardo F,Pegoraro M,Vallino M,Cavallo F.The rat Erb B2 tyrosine kinase receptor produced in plants is immunogenic in mice and confers protective immunity against Erb B2+mammary cancer[J].Plant Biotechnology Journal,2016,14 (1):153-159
[102]Chotprakaikiat W,Allen A,Bui-Minh D,Harden E,Jobsri J,Cavallo F,Gleba Y,Stevenson F K,Ottensmeier C,Klimyuk V,Savelyeva N.A plant-expressed conjugate vaccine breaks CD4+tolerance and induces potent immunity against metastatic Her2+breast cancer[J].Onco Immunology,2016,5(6):e1166323
[103]Kalbina I,Lagerqvist N,Moiane B,Ahlm C,Andersson S,Strid,Falk K I.Arabidopsis thaliana plants expressing Rift Valley fever virus antigens:Mice exhibit systemic immune responses as the result of oral administration of the transgenic plants[J].Protein Expression and Purification,2016,127:61-67
[104]Yusibov V,Rabindran S.Recent progress in the development of plant derived vaccines[J].Expert Review of Vaccines,2008,7(8):1173-1183
[105]Dalsgaard K,Uttenthal,Jones T D,Xu F,Merryweather A,Hamilton W D O,Langeveld J P M,Boshuizen R S,Kamstrup S,Lomonossoff G P,Porta C,Vela C,Casal J I,Meloen R H,Rodgers P B.Plant-derived vaccine protects target animals against a viral disease[J].Nature Biotechnology,1997,15(3):248-252
[106]Martín-Alonso J M,Casta1ón S,Alonso P,Parra F,Ordás R.Oral immunization using tuber extracts from transgenic potato plants expressing rabbit hemorrhagic disease virus capsid protein[J].Transgenic Research,2003,12(1):127-130
[107]Sohn E J,Lee Y,Park N,Park M,Kim N H,Park S,Min K,Gu S,Park Y,Song J,An D,Hwang I.Development of plant-produced E2 protein for use as a green vaccine against classical swine fever virus[J].Journal of Plant Biology,2018,61(4):241-252
[108]Berinstein A,Vazquez-Rovere C,Asurmendi S,Gómez E,Zanetti F,Zabal O,Tozzini A,Grand D C,Taboga O,Calamante G,Barrios H,Hopp E,Carrillo E.Mucosal and systemic immunization elicited by Newcastle disease virus (NDV) transgenic plants as antigens[J].Vaccine,2005,23(48/49):5583-5589
[109]颜斌,武丹阳,李慧玉.白桦Bp BEE2基因的遗传转化及抗逆性分析[J].植物研究,2019,39(2):287-293
[110]王敏,李疆,代培红,罗淑萍,李鹏,陈婷婷,郭淑朋.扁桃Ac AGL15基因的克隆及植物表达载体构建[J].分子植物育种,2017,14(10):2665-2670
[111]Wei Z Y,Zhang Y Y,Wang Y P,Fan M X,Zhong F X,Xu N,Lin F,Xing X C.Production of bioactive recombinant bovine chymosin in tobacco plants[J].International Journal of Molecular Sciences,2016,17(5):1-9
[112]Li X,Ouyang X F,Zhang Z S,He L,Wang Y,Li Y H,Zhao J,Chen Z,Wang C N,Ding L L,Peng Y,Xiao Y H.Over-expression of the red plant gene R1 enhances anthocyanin production and resistance to bollworm and spider mite in cotton[J].Molecular Genetics and Genomics,2019,294(2):469-478
[113]Zheng L J,Zhang X G,Zhang H J,Gu Y,Huang X R,Huang H H,Liu H M,Zhang J J,Hu Y F,Li Y P,Yu G W,Liu Y H,Lawson S S,Haung Y B.The miR164-dependent regulatory pathway in developing maize seed[J].Molecular Genetics and Genomics,2019,294(2):501-517
[114]付亚娟,侯荟玲,乔洁,耿晓进,王聪艳,侯晓强.大花杓兰钙依赖蛋白激酶基因克隆及植物表达载体构建[J].植物遗传资源学报,2019,20(6):1613-1620
[115]Giap D V,Jung J W,Kim N S.Production of functional recombinant cyclic citrullinated peptide monoclonal antibody in transgenic rice cell suspension culture[J].Transgenic Research,2019,28 (5):177-188
[116]王静,彭双,胡圣,卓维,陈倩,李立芹.烟草质膜ATPase4基因的克隆、表达载体构建及表达分析[J].浙江农业学报,2019,31(2):173-181
[117]Zhou M Q,Tang W.MicroRNA156 amplifies transcription factorassociated cold stress tolerance in plant cells[J].Molecular Genetics and Genomics,2019,294(2):379-393
[118]Queiroz L N,Maldaner F R,Mendes E A,Sousa A R,D’Allastta RC,Mendonca G,Mendonca D B S,Aragao F J L.Evaluation of lettuce chloroplast and soybean cotyledon as platforms for production of functional bone morphogenetic protein 2[J].Transgenic Research,2019,28(2):213-224
[119]Al-Dallee Z T,Al-Hajaj M A.Expression of recombinant human glucocerebrosidase protein in sunflowers[J].Baghdad Science Journal,2019,16(1):18-33
[120]Niu L,Yang J,Zhang J H,He H L,Xing G J,Zhao Q Q,Guo D Q,Sui L,Zhong X F,Yang X D.Introduction of the harpin Xoocencoding gene hrf2 in soybean enhances resistance against the oomycete pathogen Phytophthora sojae[J].Transgenic Research,2019,28(2):257-266
[121]Camas Reyes A,LagunaRamírez R,Jofre Garfias A E,CardosoMartínez F,Hernández-Orihuela A L,Molina-Torres J,MartínezAntonio A.E.coli cultures expressing a synthetic sequence of ptz gene(stz) promoted in vitro direct organogenesis in Nicotiana tabacum L.[J].Plant Cell,Tissue and Organ Culture,2019,137(1):87-100
[122]卢昊,杨奕琦,秦玉芝,熊兴耀,周倩.马铃薯晚疫病菌应答WRKY基因的结构功能预测与植物表达载体构建[J].分子植物育种,2019,17(10):3253-3258
[123]Zhang Y J,Gao W Y,Lv Y W,Bai Q Q,Wang Y J.Enhanced melatonin production via aralkylamine N-acetyltransferase overexpression enhances Na Cl resistance in transgenic Chlamydomonas reinhardtii (Volvocales,Chlorophyceae)[J].Phycologia,2019,58(2):154-162
[124]Zhang L,Rylott E L,Bruce N C,Strand S E.Genetic modifcation of western wheatgrass (Pascopyrum smithii) for the phytoremediation of RDX and TNT[J].Planta,2019,249(4):1007-1015
[125]Mardanova E S,Blokhina E A,Tsybalova L M,Peyret H,Lomonossoff G P,Ravin N V.Efficient transient expression of recombinant proteins in plants by the novel p Eff vector based on the genome of potato virus X[J].Plant Science,2017,8(247):1-8
[126]白蓓蓓,荆永琳,蔡秉宇,蓝丽,王佳,赵志常.芒果无机焦磷酸酶基因的克隆及其表达载体构建[J].热带作物学报,2019,40(2):308-313
[127]Ma J W,Fu X Q,Zhang T T,Qian H M,Zhao J Y.Cloning and analyzing of chalcone isomerase gene (Aa CHI) from Artemisia annua[J].Plant Cell,Tissue and Organ Culture,2019,137(1):45-54
[128]Posgai A L,Wasserfall C H,Kwon K C,Daniell H,Schatz D A,Atkinson M A.Plant-based vaccines for oral delivery of type 1diabetes-related autoantigens:Evaluating oral tolerance mechanisms and disease prevention in NOD mice[J].Scientific Reports,2017,7(1):1-15
[129]刘晓柱,李银凤.荠菜生长素极性运输基因1(Cb PIN1)的克隆与表达分析[J].华北农学报,2019,34(1):26-32
[130]Swartwood K,Joyce Van Eck.Development of plant regeneration and Agrobacterium tumefaciens mediated transformation methodology for Physalis pruinosa[J].Plant Cell Tiss Organ Cult,2019,137 (3):465-472
[131]许永华,邹季,周新芳,李俊,惠建成,赵露.人参BZR1基因克隆及植物表达载体构建[J].植物分子育种,2019,17(23):7744-7749
[132]Han P L,Dong Y H,Gu K D,Yu J Q,Hu D G,Hao Y J.The apple Ubox E3 ubiquitin ligase Md PUB29 contributes to activate plant immune response to the fungal pathogen Botryosphaeria dothidea[J].Planta,2019,249(4):1177-1188
脂肪酶(EC3.1.1.3)又称为三酰基甘油酯水解酶,可以催化三酰甘油酯及其他一些水不溶性酯类的水解、醇解、酯化、转酯化及酯类的逆向合成反应,除此之外,还表现出如磷脂酶、溶血磷脂酶、胆固醇酯酶和酰肽水解酶活性等(Tong等,2007).脂肪酶催化反...
1转基因技术的发展1.1我国转基因技术的现状我国转基因技术研发和应用在以下3个方面取得了积极进展:(1)生物育种产业蓄势待发。转基因抗虫棉花品种培育和产业化取得巨大成效;转基因抗虫水稻、转植酸酶基因玉米获得安全证书,具备产业化条件;抗旱、...