摘 要: 目的 筛选碳酸司维拉姆分散片的最优处方,制备成分散片,解决该药品普通片造成患者吞咽困难以及食道异常等方面的问题。方法 根据辅料特性选择交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP)为崩解剂,微晶纤维素为赋形剂,聚维酮K-30为黏合剂,硬脂酸镁为润滑剂,阿斯巴甜和柠檬香精为矫味剂的分散片处方;通过DOE设计对处方进行筛选,以分散均匀性和溶出度作为指标考察。结果 筛选得到原料粒径(D90)为15.0μm,PVPP占比45.0%,硬脂酸镁占比0.6%组成最优处方。结论 研制的碳酸司维拉姆分散片处方合理、工艺可行,药品符合质量标准要求。
关键词: 碳酸司维拉姆; 分散片; DOE设计; 处方工艺;
Abstract: OBJECTIVE To prepare sevelamer carbonate into dispersible tablets and to screen its optimal prescription to solve the problems of dysphagia and abnormal esophagus caused by conventional tablets in patients. METHODS According to the characteristics of excipients, the dispersible tablets were prepared with crosslinked polyvinylpyrrolidone(PVPP) as disintegrating agent, microcrystalline cellulose as excipient, povidone K-30 as adhesive, magnesium stearate as lubricant and aspartame and lemon essence as flavoring agents. The prescription was screened through DOE design with the dispersion uniformity and dissolution as indicators. RESULTS The optimal prescription was screened as the active pharmaceutical ingredient particle size of(D90) was 15.0 μm, the proportions of PVPP and magnesium stearate were 45.0% and 0.6% respectively. CONCLUSION For the prepared sevelamer carbonate dispersible tablets, the formulation is reasonable, the process is feasible and the quality meets the requirement of the specification.
Keyword: sevelamer carbonate; dispersible tablets; DOE design; prescription technology;
碳酸司维拉姆是一种适用于正在接受透析治疗的慢性肾脏病[1,2]成人患者高磷血症的新型药物。目前该药物在市场上主要为普通片,规格为每片0.8 g,根据说明书中记载因其单片规格大和药物本身吸附作用的特性,易造成患者吞咽困难、吞咽障碍、重度胃肠功能紊乱,以及对胃轻瘫、胃内容物滞留或肠道运动异常的患者造成不良影响。为解决原有剂型给患者造成的不良反应,并结合碳酸司维拉姆几乎不溶于水、不溶于酸碱和有机溶剂[3]的特点,特将其设计制成分散片[4],利用分散片服用前遇水形成混悬液方便患者服用,可解决患者吞咽困难、食道药片滞留的问题,而且混悬液更易通过胃肠道,可解决普通片在胃中膨胀滞留、造成肠梗阻等方面的问题。
1 、仪器与试剂
1.1 、仪器
HLSG50湿法混合制粒机(明天机械);Pilotlab L Bosch流化床[博世包装技术(杭州)有限公司];SYH120L三维混合机(南京健牌干燥设备厂);ZPT-26旋转式压片机(北京翰林科技有限公司);FM-29-01电子天平(上海精科天平厂);CJY-300B片剂脆碎度测定仪(上海黄海药检仪器有限公司);SNTR-8400A型智能药物溶出仪(岛津科技);TBH125型片剂硬度测试仪(德国ERWEKA);Agilent1260高效液相色谱仪(美国Agilent)。
1.2 、药品与试剂
碳酸司维拉姆(浙江金华康恩贝生物制药有限公司,批号:180604);碳酸司维拉姆对照品[高拓耀业(北京)科技有限公司,批号:1803002;纯度:98.6%];聚维酮K30(湖州展望药业有限公司,批号:20180101);交联聚乙烯吡咯烷酮(crosslinked polyvinylpyrrolidone,PVPP,美国国际特品公司肯塔基州工厂,批号:0002127497);微晶纤维素(microcrystalline cellulose,MCC,湖州展望药业有限公司,批号:20180346);阿斯巴甜(湖南尔康制药股份有限公司,批号:103420180701);柠檬香精(上海德欣香料有限公司,批号:20180912-1);硬脂酸镁(湖州展望药业有限公司,批号:20180514)。
2 、碳酸司维拉姆分散片工艺
本次处方工艺筛选遵循Qb D理念[5,6],试验分散片的制备规格与市售碳酸司维拉姆普通片规格(每片0.8 g)一致,药品制成片重为每片1.7~1.9 g。处方暂定为碳酸司维拉姆、MCC、PVPP、阿斯巴甜、柠檬香精、硬脂酸镁和聚维酮K30乙醇溶液。
2.1 、辅料选择
2.1.1 、赋形剂的选择
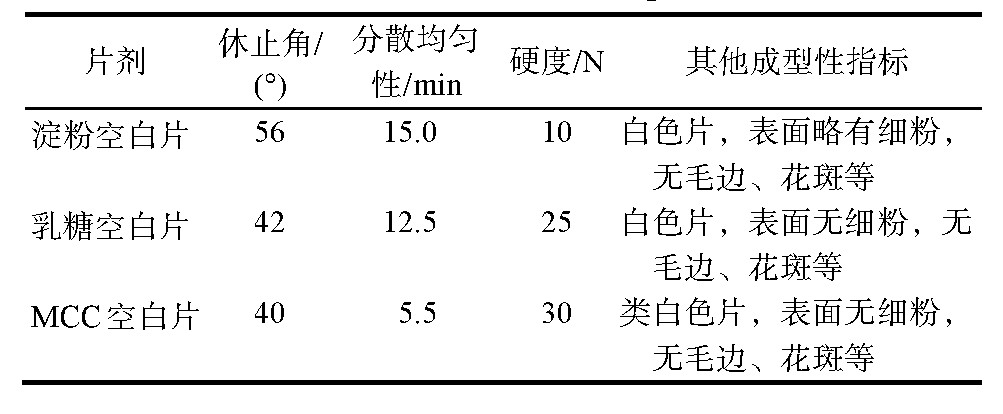
片剂常用的赋形剂有乳糖、淀粉及MCC。选用10%聚维酮做黏合剂,试制上述辅料的空白片,控制片重统一为1.8 g左右,考察各辅料空白片的成型性指标,最终结合碳酸司维拉姆原料的性质,选用MCC作为赋形剂,检测结果见表1。
表1 不同辅料空白对比
2.1.2 、黏合剂浓度的选择
分散片常采用聚维酮作为黏合剂,采用聚维酮制成的颗粒,表面具亲水性,压片后水分易润湿、渗入,片剂易崩解,有利于药物的溶出。黏合剂浓度选择10%,15%,20%,按“2.1.1”项下MCC空白片处方进行制粒,对制得颗粒以及片剂的硬度进行休止角和分散均匀性检测,结果见表2。10%浓度制得的颗粒与后两者制得的颗粒休止角、硬度差异较大,15%与20%浓度制得的颗粒差异不大;在分散均匀性方面3个浓度制得的颗粒差异不大,因此采用15%聚维酮乙醇溶液作为黏合剂。
表2 黏合剂浓度选择对比

2.1.3、 崩解剂的选择
分散片常用崩解剂[7]有羧甲基淀粉钠(carboxymethyl starch sodium,CMS-Na)、低取代羟丙纤维素(low-substituted hydroxypropyl cellulose,L-HPC)、PVPP等。CMS-Na推荐用量为3%~6%,L-HPC推荐用量为2%~10%,PVPP推荐用量5%~50%。按“2.1.1”项下MCC空白片处方试验,采用15%聚维酮乙醇溶液作黏合剂,选用上述崩解剂进行制粒压片,控制片重为1.8 g左右。崩解剂用量为各自适宜的最大用量:CMS-Na 6%,L-HPC 10%,PVPP 50%,测得相关指标结果见表3,从处方选择确定选用PVPP作为崩解剂。
表3 不同崩解剂处方质量考察

2.1.4 、润滑剂的选择
常用润滑剂为滑石粉[8]和硬脂酸镁,滑石粉为一种亲水性润滑剂,比重大、不易黏附、易分层。硬脂酸镁[9]黏附性能强、润滑性好,在片剂中应用比较广泛,常用量为0.5%~2%,本试验处方选用硬脂酸镁作为润滑剂。
2.1.5 、矫味剂的选择
分散片口感不良,为使得水中分散后服用时口感好,考虑添加适当的矫味剂。试验选用甜度大、口味清爽、稳定性好的甜味剂阿斯巴甜,同时添加香味较能被大众接受的柠檬香精作为矫味剂。
2.2 、DOE设计
经过上述辅料确定以及结合分散片的特点,确定3因子:原料粒径(A)、PVPP占比(B)以及硬脂酸镁占比(C)对产品溶出度、分散均匀性影响较大。通过Minitab软件中“DOE设计”对“3因子3个中心点重复方法”进行选择,3因子水平见表4,11组试验结果见表5。
表4 3因子水平表
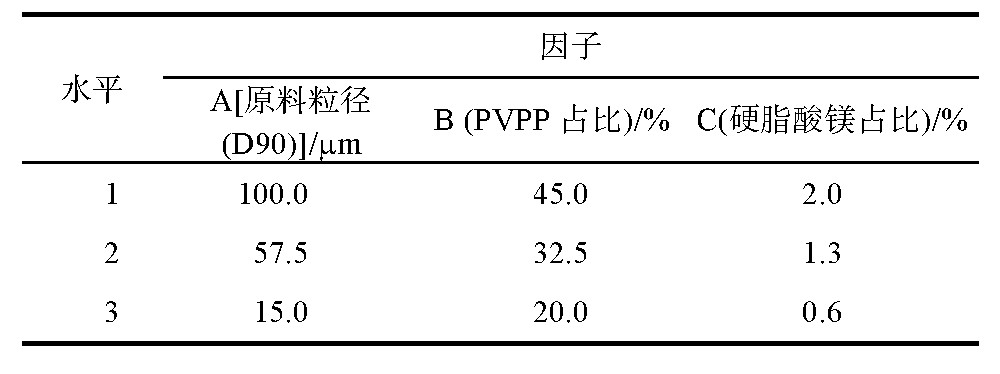
表5 3因子试验对应溶出度与分散均匀性结果
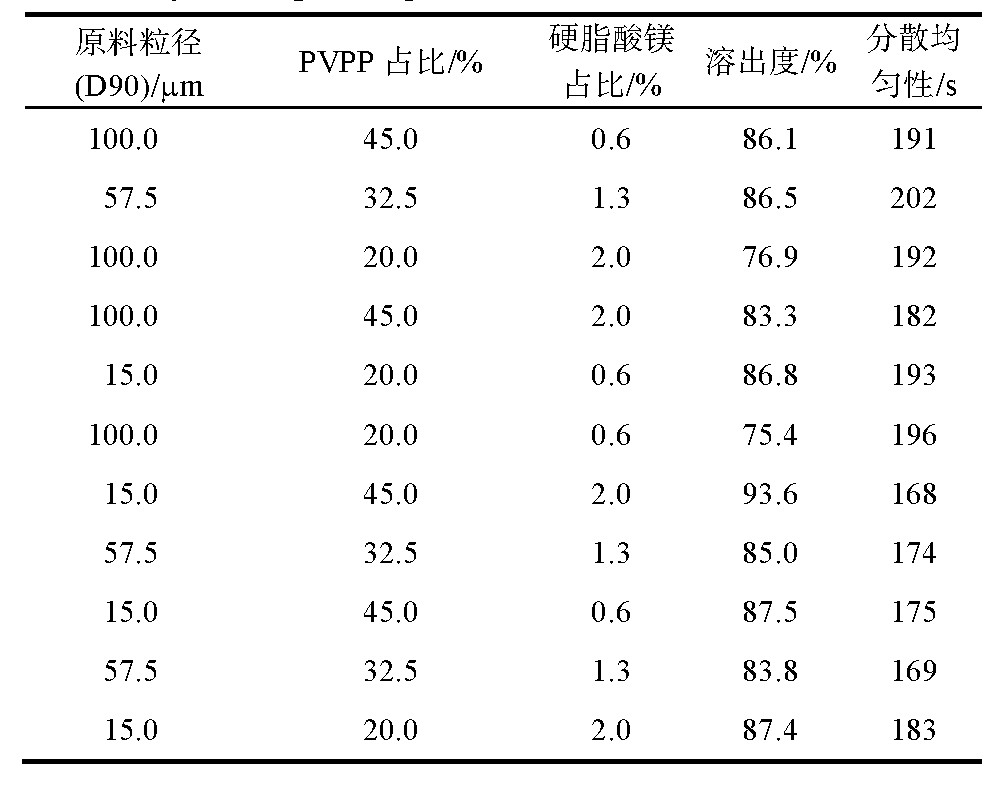
通过软件进行分析,得出原料粒径(D90)15.0μm、PVPP占比45.0%与产品的溶出度关系显着,与硬脂酸镁占比关系不显着;且所有产品分散均匀性结果在168~202 s,无显着差异;经评估硬脂酸镁用量选择占比0.6%。根据Minitab软件中“响应优化器”功能得到三因子在原料粒径(D90)15μm、PVPP占比45%、硬脂酸镁占比0.6%水平条件下,溶出度拟合值91%,95%置信区间在88.91%~95.00%,表明该处方组合为最优。
2.3、 最优处方验证
根据“2.2”项下得到的组合进行平行试验3次,测得溶出度分别为92%,93%,91%,平均值为92%;分散均匀性分别为162,168,163 s,基本与DOE试验持平,表明该处方组合为最优处方组合。
3 、碳酸司维拉姆分散片工艺研究
经最优处方确认分散均匀性结果在3 min边缘,接近标准规定:3 min内应全部崩解并通过筛网。需对原处方工艺进行优化,缩短分散均匀性。
3.1 、崩解剂内外加比例的选择
PVPP作为强效崩解剂,内加、外加比例影响分散均匀性时间。取原处方PVPP 20%和40%外加分别进行试验,测得分散均匀性结果:20%外加分散均匀性为126,119,124 s;40%外加分散均匀性为117,121,120 s。取部分PVPP外加后,分散均匀性明显缩短,但20%和40%差异不显着,选择20%作为外加比例。
3.2 、最优处方工艺验证
根据“3.1”项下得到最优处方工艺平行试验3次,分散均匀性分别为123,127,116 s,平均值为122 s,基本与“3.1”项试验持平,表明该比例适用。
4 、碳酸司维拉姆分散片的制备
4.1、 分散片处方
通过上述试验得该分散片最优处方每片含:碳酸司维拉姆800 mg、MCC 154 mg、阿斯巴甜9.8 mg、柠檬香精11 mg、PVPP 833 mg、聚维酮K-30 30.2 mg、硬脂酸镁11 mg。
4.2 、分散片制备
按“4.1”项下处方制备3批碳酸司维拉姆分散片,将处方量的碳酸司维拉姆、MCC、阿司巴甜、PVPP(内加),混合均匀,加入15%聚维酮K-30乙醇溶液,制软材,过12目筛,设定干燥温度85℃,干燥30 min,过16目筛整粒。将制好的颗粒与柠檬香精、PVPP(外加)以及处方量的润滑剂硬脂酸镁混合后压片,控制片子的硬度在40~70 N。
5 、碳酸司维拉姆分散片的质量评价
5.1、 溶出度检测方法
本品溶出度检测方法采用中国药典第二法浆法,转速为75 r×min?1、以p H 6.8磷酸盐缓冲液(取0.5 g十二烷基硫酸钠、2.4 g磷酸二氢钠和0.3 g氢氧化钠,加1 L水溶解)1 L为溶出介质、溶出液温度37℃。经30 min时取样;取碳酸司维拉姆对照品用缓冲液溶解,进行HPLC检测,按外标法以峰面积计算每片的溶出量。检测条件:色谱柱十八烷基硅烷键合硅胶(55 mm×4.0 mm,3μm);流动相乙腈∶水=40∶60;流速1.0 m L·m L?1;等度洗脱;进样量10μL;检测波长250 nm;柱温40℃;样品温度N/A;运行时间10 min。
5.2 、检测结果
3批样品检测结果分别为溶出度95%,93%,96%,硬度47,63,59 N,分散均匀性120,127,116 s,结果符合质量标准。
6 、讨论
由于碳酸司维拉姆几乎不溶于水,将其制成分散片原料粒径对溶出度影响极为重要,本试验重点对粒径选择进行研究,须将粒径控制在合理范围内,才能保证产品的溶出度>90%。黏合剂制备宜选用乙醇而非水作为溶剂,乙醇作为溶剂制得的颗粒较为松散,能达到快速崩解的目的,符合分散片的要求。矫味剂选用阿斯巴甜,因其口感好、其甜度比蔗糖高150~200倍,且无后苦味,不易导致龋齿,还可有效降低热量,较适用于糖尿病和肥胖症患者[10]。本试验制得的产品服用方便,并能有效解决碳酸司维拉姆普通片造成的患者吞咽困难以及胃肠道等方面问题,具有良好的市场开发前景。
参考文献
[1] 赵袆,程海,李绍莉,等.碳酸司维拉姆对终末期肾脏病患者血清C反应蛋白、胎球蛋白A和成纤维细胞生长因子23水平的影响[J].中国中西医结合肾病杂志, 2014, 15(9):808-811.
[2] SI Y B, XU B. Clinical application of sevelamer carbonate, a new phosphate binder[J]. Drug Eval(药品评价), 2013(24):36-37, 46.
[3] Pharmeuropa. Sevelamer Carbonate[S]. 2016:197.
[4] 李平.分散片处方及制备工艺[J].科技创新导报, 2008, 5(3):186-187.
[5] ZHA N, ZHA N. Application of Qb D idea in improving scientific research ability of pharmaceutics postgraduate[J].China Med Her(中国医药导报), 2015(25):57-60.
[6] CHEN B, WEI M C, YUE S X. The concept of “quality by design” in the processes of drug industrialization and the discussion on the related problems[J]. Shanghai Med Pharm J(上海医药), 2010, 31(7):320-321.
[7] WANG Y L. The disintegrating agents of dispersible tablets[J]. Food Drug(食品与药品), 2005, 7(3):51-52.
[8] 孙永子.片剂润滑剂硬脂酸镁与滑石粉的比较[J].中国药学杂志, 1954, 2(7):288.
[9] 秦玉楠.药用硬脂酸镁及其工艺改进[J].现代应用药学1991, 8(3):18-19.
[10] 张伊莎,张蒂根,王小玉.二肽甜味剂——阿司帕坦[J].江西科学, 1995, 13(4):249-254.
考虑到平皿法比薄膜过滤法操作方便、简捷, 因此本试验菌落计数方法采用稀释法和中和法联用, 控制菌检查采用稀释的方法进行。本研究可为不同来源的地拉罗司类产品微生物限度检查提供参考。...