摘 要: 以甘肃传统发酵浆水为材料,采用平板划线法分离纯化其中的乳酸菌,并对纯化后的菌株进行形态学观察及生物学特性分析,筛选出其中具有抑菌活性的菌株,分别研究它们的抑菌能力以及抑菌物质的成分。结果表明:6株乳酸杆菌中,菌株SJ-1、SJ-2的发酵代谢产物对指示菌具有较高的抑菌活性。排除酸抑制作用和过氧化氢抑制作用后代谢产物仍具抑菌活性,且显示出良好的热稳定性。使用不同的蛋白酶对代谢产物进行处理后,其抑菌能力产生了程度不等的降低,表明抑菌物质具蛋白酶敏感性,因此判断抑菌物质中含有蛋白类抑菌成分。经鉴定发现菌株SJ-1为发酵乳杆菌(Lactobacillus fermentum),SJ-2为植物乳杆菌(Lactobacillus plantarum)。
关键词: 浆水; 乳酸菌; 代谢产物; 抑菌活性; 细菌素;
Abstract: A total of 6 strains were separated and purified from Jiangshui celery. Their morphological and biological characteristics were observed and analyzed. We screened strains with antibacterial activity from these 6 strains. Then the antibacterial ability and the characteristics of its antibacterial substances were studied. The results showed that the fermentation metabolites of strains SJ-1 and SJ-2 had high antibacterial activity against indicator bacterias. The metabolites still had antibacterial activity after excluding the interference of acid and hydrogen peroxide,and showed high thermal stability. After treated with different proteases,the bacteriostatic ability was reduced to varying degrees. Which indicated it is sensitive to proteases,so it was judged that there are protein bacteriocins in the antibacterial substances. The strains SJ-1 was identified as Lactobacillus fermentum and the SJ-2 was identified as Lactobacillus plantarum.
Keyword: Jiangshui celery; lactic acid bacteria; metabolites; antibacterial activity; bacteriocin;
浆水菜是我国陕西、甘肃、山西、河南等地的一种传统发酵蔬菜[1]。传统做法一般采用面粉和蔬菜为原料,加入浆水引子后,经其中的多种微生物菌群发酵而成。其气味清香、口味酸醇,且含有丰富的营养成分,具有诸多的益生功效[2],如:调理肠胃、提高食欲、消暑止渴等。一般情况下,浆水发酵过程需要经过初、中、后期3个阶段,每个阶段均包含着复杂的微生物群系,但其中最主要的发酵菌群为乳酸菌[1]。张勇等[3]对陕西传统发酵浆水中的微生物群系进行探究并从中分离鉴定出18株乳酸菌。李雪萍[4]从西北不同的5个地区的浆水样品中共分离纯化得到107株菌,并对所分离菌种进行鉴定、分析其多样性。张晓辉等[5]对3个不同地方采集的浆水中的细菌多样性进行研究,得知乳杆菌在3种浆水中为优势菌,且3种浆水中的细菌多样性存在差异。
随着对乳酸菌研究的不断深入,许多学者发现其不仅具有调整胃肠道菌群平衡、提高食物消化率的功效[6],还能够有效降低肠道的胆固醇含量、改善肠道环境[7,8],因此被广泛用于发酵食品的加工过程,来抑制食品中腐败菌的生长、延长货架期、提高食品的品质及风味[6]。且乳酸菌大多可以产生抑菌物质,具有抗菌活性,因此被广泛用于发酵食品的加工过程,抑制食品中腐败菌的生长,延长货架期,并对食品的品质及风味进行改善[9,10]。虽然近年来我国科研人员对浆水这一传统发酵食品的研究逐渐深入,但主要集中于对其菌群情况的研究,对浆水中乳酸菌抑菌性能的研究并不多见。

本研究以甘肃天水周边为采样地点,从传统发酵浆水中提取具有抑菌活性的乳酸菌株,并筛选出产蛋白质类细菌素的乳酸菌,观察并研究其形态、生长特性,进行乳酸菌的分子生物学鉴定。为之后提纯抑菌成分、开发新型抑菌制剂及发酵食品提供借鉴和基础。
1、 材料与方法
1.1、 材料与试剂
浆水来自农家自制及市售;MRS肉汤培养基、MRS琼脂培养基、普通肉汤培养基、营养琼脂培养基:青岛海博生物技术有限公司;大肠杆菌(Escherichia coli)、蜡状芽孢杆菌(Bacillus cereus)、金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis)标准菌株由江南大学谷物与淀粉研究中心实验室保存;木瓜蛋白酶(酶活力600 U/mg)、蛋白酶K(酶活力30 U/mg)、胰蛋白酶(酶活力10 U/mg)、胃蛋白酶(酶活力3 U/mg)、过氧化氢酶(酶活力200 U/mg):TaKaRa公司;草酸铵结晶紫染色液、卢氏碘液、番红复染液:江南大学谷物与淀粉研究中心实验室自配。
1.2、 仪器与设备
BCD-208BSC冰箱:青岛海尔股份有限公司;YXJ-2台式离心机:湘仪离心机仪器有限公司;ZA100R3电子天平:上海赞维衡器有限公司;SW-CJ-1F超净工作台:苏州尚田洁净技术有限公司;HZQ-X100A电热恒温培养箱:上海一恒科技有限公司;U-3010紫外分光光度计:Hitachi公司;Zeiss AxioVert.A1荧光倒置显微镜:蔡司中国;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3、 方法
1.3.1、 乳酸菌富集培养
向MRS液体培养基中加入适量浆水样品,于37℃恒温培养箱中厌氧培养48 h。
1.3.2、 乳酸菌的分离纯化
用无菌生理盐水对富集培养后的菌液进行稀释,稀释度为10-1~10-7。采用稀释混匀平板法,分别吸取0.1 mL稀释度为10-4、10-5、10-6、10-7的菌悬液注入培养皿,将50℃左右的碳酸钙MRS琼脂培养基倒入皿中,待培养基冷却凝固后,将其转移至37℃恒温培养箱内培养24 h。筛选钙溶圈较大的菌落,在MRS固体培养基上反复划线纯化、镜检,得到纯菌落。将纯化菌株接种于MRS斜面培养基中,继续于37℃恒温培养24 h后保存于4℃低温冰箱中。
1.3.3 、乳酸菌的形态学观察
菌落形态:采用平板划线法,将纯化的乳酸菌划线于MRS固体培养基上,37℃恒温培养24 h,观察并记录菌落颜色和外形特征。
菌体形态:取培养24 h的乳酸菌体进行革兰氏染色、制片,在显微镜下观察染色结果及乳酸菌形态。
1.3.4、 生长曲线测定
按2%的接种量将预先活化好的乳酸菌液加入MRS培养液中,37℃静置培养48 h。每隔2 h取发酵液,以未接菌的MRS液体培养基作对照,在600 nm波长处测定其吸光值(OD600 nm),平行测定3次,绘制各菌株生长曲线。
1.3.5 、pH值的测定
采用pH计测定。将预先活化好的乳酸菌按2%的接种量接种于MRS液体培养基中,每隔2 h测定发酵液的pH值,平行测定3次。
1.3.6、 耐酸试验
参考王俊国[11]的方法,制备人工胃液:取稀盐酸16.4 mL,加800 mL水、10 g胃蛋白酶,摇匀后加水至1 000 mL,用0.23μm的无菌滤头在无菌操作台中除菌过滤待用,于无菌试剂瓶中低温保藏备用。取活化好的菌株培养液5 mL,4 000 r/min离心10 min后弃上清,向菌体中加入5 mL无菌生理盐水,混匀制成菌悬液,取1.0 mL菌悬液与9.0 mL pH3.0的人工胃液混合后,置37℃培养,于0 h、3 h取样,采用平板计数法,用MRS固体培养基倾注,于37℃培养48 h后计活菌数,按公式(1)计算存活率。
式中:A为3 h的活菌数,CFU/mL;B为0 h的活菌数,CFU/mL。
1.3.7、 耐胆盐试验
选取在耐酸试验中存活率大于10%的乳酸菌进行胆盐耐受性试验[11]。在含0.10%牛胆盐、0.30%牛胆盐)的MRS-THIO培养基中添加2%的活化好的乳酸菌液,置37℃培养,于0、3 h取样,采用和耐酸性试验相同的方法,按公式(1)计算存活率(%)。
1.3.8 、抑菌试验
1.3.8. 1、 指示菌菌悬液的制备
将指示菌金黄色葡萄球菌接种到MRS液体培养基中,将枯草芽孢杆菌、蜡状芽孢杆菌、大肠杆菌接种到普通肉汤培养基,于37℃培养24 h,离心,配制菌悬液。采用平板计数法计量菌悬液的菌含量,取菌液浓度105CFU/mL的菌液作为指示菌悬液。
1.3.8. 2、 乳酸菌代谢产物的制备
将半固体保存的菌株接种到MRS液体培养基内传两代培养。取第3代培养液,4 000 r/min离心15 min,收集上清液,经细菌过滤器过滤制成无菌滤液,所得无菌滤液即为乳酸菌的代谢产物。
1.3.8. 3、 乳酸菌代谢产物抑菌试验
使用牛津杯法测定抑菌圈大小[12],指示菌分别为蜡状芽孢杆菌、大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌(105CFU/mL)。
1.3.8. 4、 代谢产物酸碱处理后的抑菌效果
用1 mol/L的NaOH、HCl将代谢产物的pH值分别调至2.0、3.0、4.0、5.0、6.0、7.0,进行抑菌试验,采用1.3.8.3中提到的方法测定抑菌圈大小,指示菌为蜡状芽孢杆菌。用乳酸溶液、1 mol/L的NaOH将MRS液体培养基的pH值调至2.0、3.0、4.0、5.0、6.0、7.0做对照试验。
1.3.8. 5、 代谢产物热处理后的抑菌效果
将代谢产物在沸水浴中处理30 min,进行抑菌试验,用未处理的代谢产物作对照组。
1.3.8. 6、 代谢产物酶处理后的抑菌效果
取1 mL的代谢产物,用1 mol/L的NaOH、HCl将代谢产物的pH值分别调至各酶最适范围,加入蛋白酶K(0.5 mg/mL)、胃蛋白酶(0.5 mg/mL)、胰蛋白酶(0.5 mg/mL)、木瓜蛋白酶(0.5 mg/mL)、过氧化氢酶(0.5 mg/mL)适量,于37℃水浴2 h,然后调代谢产物pH值至初始值,进行抑菌试验,使用未经酶处理的代谢产物作对照组。
1.3.9 、乳酸菌菌株的鉴定
1.3.9. 1、 提取DNA
乳酸菌的基因组DNA的提取采用十六烷基三甲基溴化铵(cetyltrimethylammoniumbromide,CTAB)法[13]。
1.3.9. 2、 乳酸菌16SrDNA的聚合酶链式反应(poly-merase chain reaction,PCR)扩增与测序
扩增程序为:94℃预变性4 min、94℃变性45 s、56℃退火1 min、72℃延伸1 min,30个循环、72℃延伸10 min[14,15];模板:乳酸菌菌株基因组DNA;引物:27f(5’-AGAGTTTGATCCTGGCTCAG)和1495r(5’-CTA-CGGCTACCTTGTTACGA)[16]。
扩增程序完成后,对PCR扩增产物进行琼脂糖凝胶电泳检测验证,之后纯化目标条带并送至上海桑尼生物科技有限公司测序。
1.3.9. 3 、同源性分析
使用核酸基于局部比对算法的搜索工具(basic local alignment search tool,BLAST)技术,将上一步测得的PCR扩增产物序列对比NCBI网站里的GeneBank数据库中的序列信息,检索得到与所测序列同源性最高的已知分类地位的菌种。
1.3.9. 4、 数据统计分析
使用SPSS22统计软件进行显着性分析。
2 、结果与分析
2.1 、乳酸菌的分离纯化及形态学观察
从传统发酵浆水中分离出乳酸菌6株。革兰氏染色特性、菌落形态及细胞形态是细菌种属鉴定的重要依据,不同的细菌种属会得到不同的革兰氏染色结果,且其在培养基表面呈现出的菌落形态及显微镜下观察到的细胞形态也不同。本研究纯化后得到的菌株的菌落形态及革兰氏染色特性如表1所示。
表1 浆水样品中分离出的各乳酸菌的菌落形态及革兰氏染色结果

从表1可以看出,传统发酵浆水中分离纯化得到的乳酸菌菌落均呈圆形、白色,表面多光滑湿润。革兰氏染色观察,发现菌株均呈杆状,为长杆状或短杆状,与武帅帅、李良凤等在浆水菜中观察到的可培养乳酸菌的菌体形态相似[17,18]。图1为菌株SJ-3的显微图像。
图1 菌株SJ-3的革兰氏染色(×1000)
Fig.1 Gram staining of strain SJ-3(×1000)
2.2 、乳酸菌的生物学特性
2.2.1、 乳酸菌的生长曲线及产酸能力
6株乳酸菌的生长曲线见图2。
图2 6株乳酸菌的生长曲线
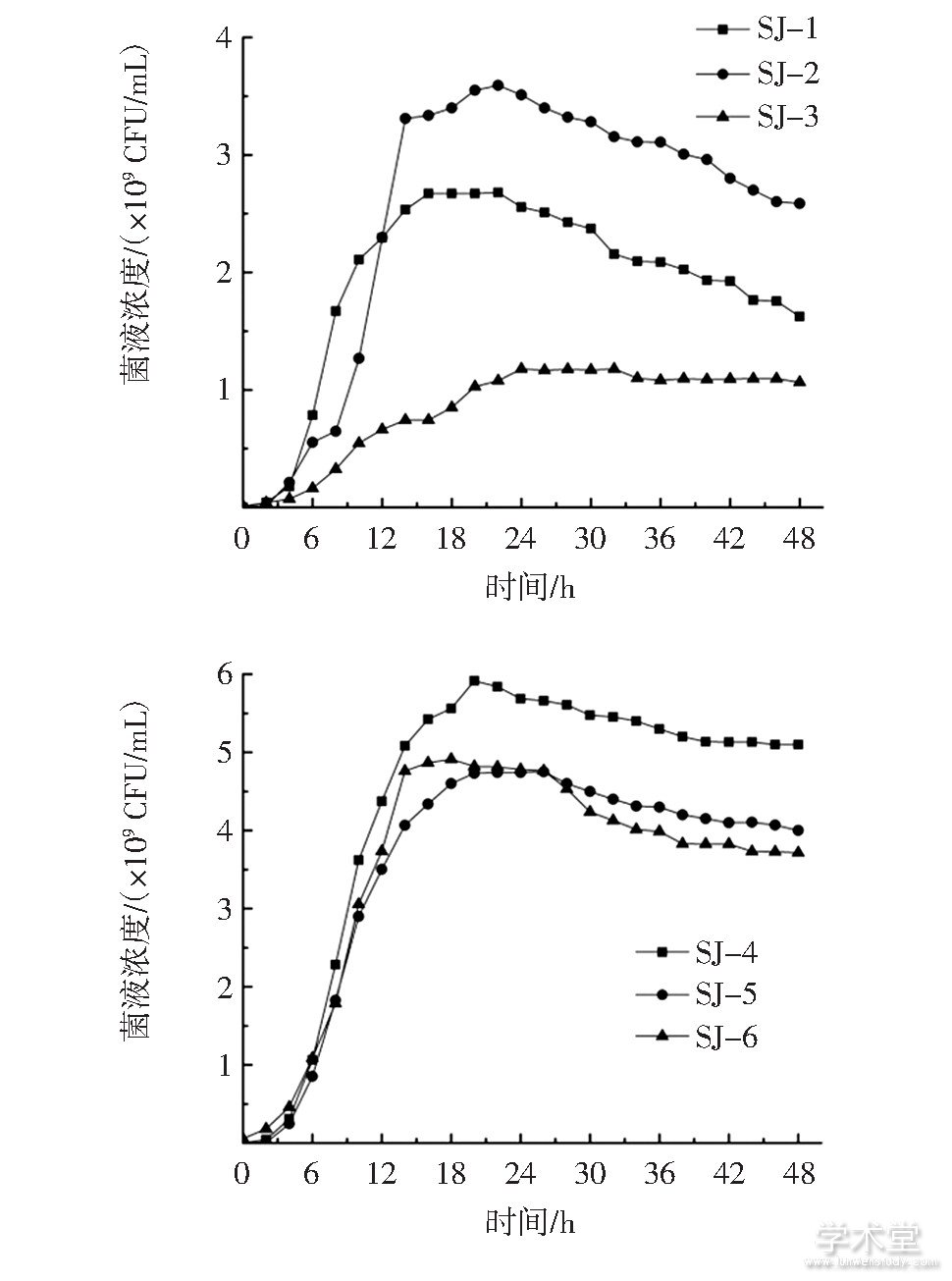
Fig.2 Growth curves of 6 strains
由图2可知,随着培养时间增加,6株菌的生长趋势相似。0~6 h SJ-3处于迟滞期,其他5株乳酸菌在0~4 h处于迟滞期;SJ-1、SJ-5在4 h~16 h处在对数生长期,SJ-2、SJ-6在4 h~14 h为对数生长期,SJ-3、SJ-4分别在6 h~20 h和4 h~18 h处于对数生长期。SJ-2、SJ-6于14 h后进入稳定期,SJ-1、SJ-5在16 h后进入稳定期,SJ-3、SJ-4则分别在20 h和18 h后进入稳定期。在相同培养时间内,菌株SJ-4的菌液浓度最大、繁殖能力最强,其次为菌株SJ-5、SJ-6,而菌株SJ-3的生长速率明显较慢。
6株乳酸菌的pH值测定结果见图3。
图3 6株乳酸菌的pH值曲线
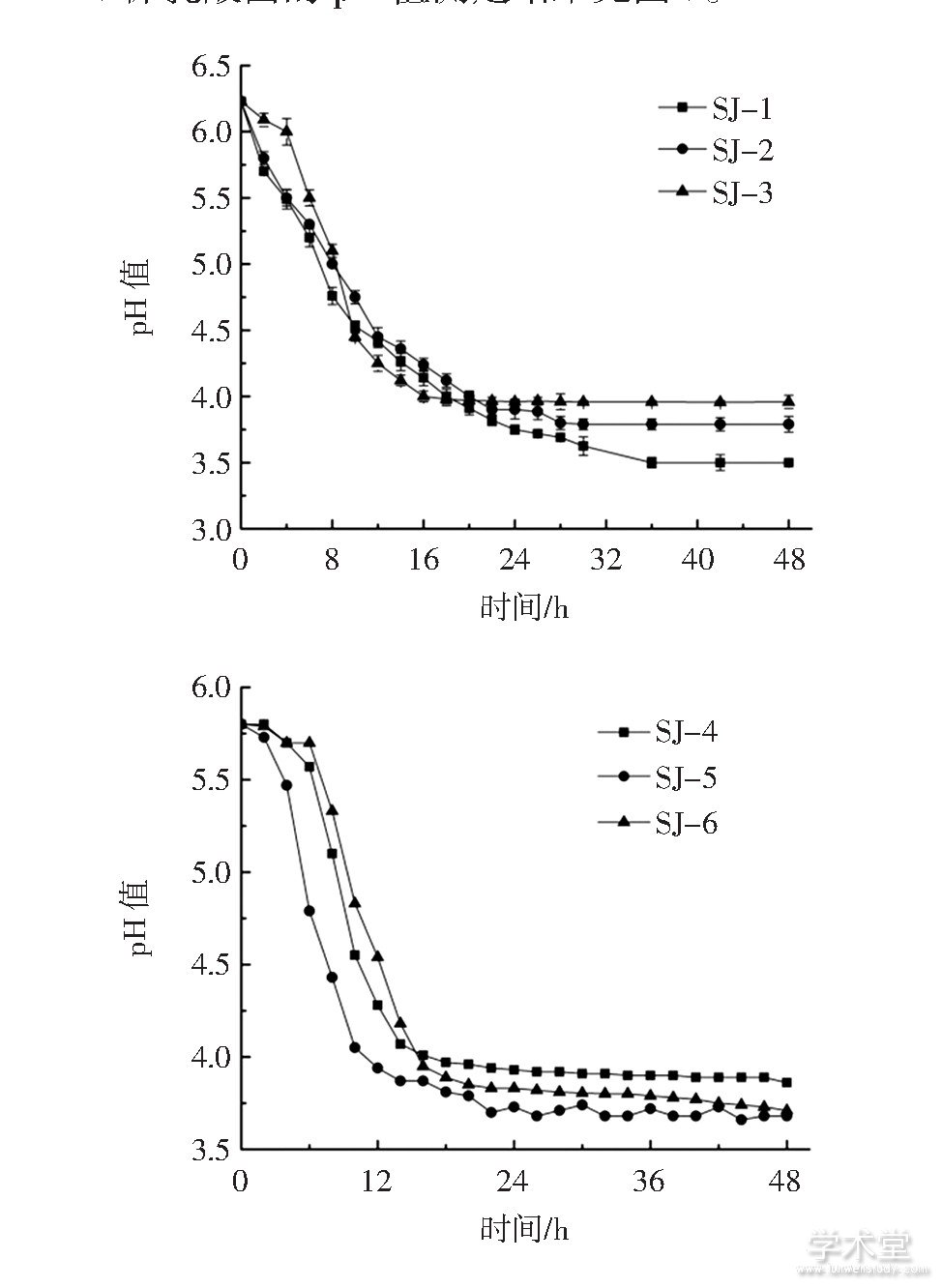
Fig.3 pH value curves of 6 strains
由图3可以看出,菌株SJ-1、SJ-2、SJ-3、SJ-4、SJ-5培养液的pH值在2 h~14 h内迅速下降,SJ-6培养液的pH值在8 h~16 h内迅速下降,随后pH值下降缓慢直至趋于平稳,最终pH值分别达到3.50、3.78、3.86、3.68、3.71。综合比较发现,六株乳酸菌中SJ-1的产酸能力较强。
2.2.2、 乳酸菌的耐酸耐胆盐能力
6株乳酸菌的耐酸能力见图4。
图4 6株乳酸菌的耐酸能力
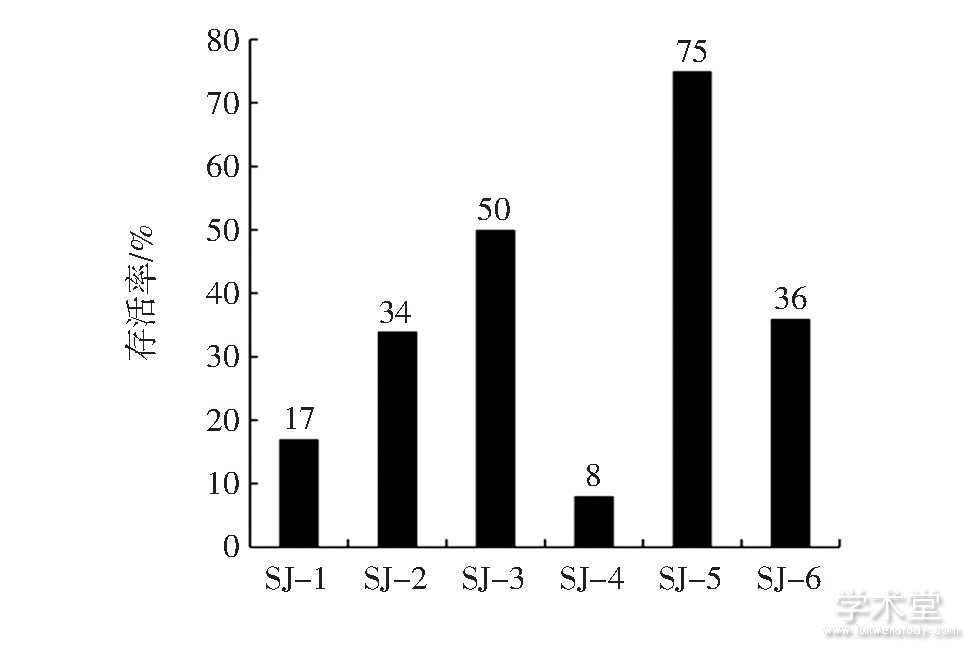
Fig.4 Acid resistance of 6 strains
6株乳酸菌都能耐受pH3.0的人工胃液,其中SJ-3、SJ-5的存活率在50%以上,SJ-2、SJ-3、SJ-5、SJ-6的存活率在30%以上,除SJ-4以外,其他菌株的存活率都在10%以上,其中SJ-5的存活率最大,可达75%。选择在pH3.0人工胃液中存活率在10%以上的5株乳酸菌做不同胆盐浓度下的生长测试。
5株乳酸菌的耐胆盐能力见图5。
图5 5株乳酸菌的耐胆盐能力
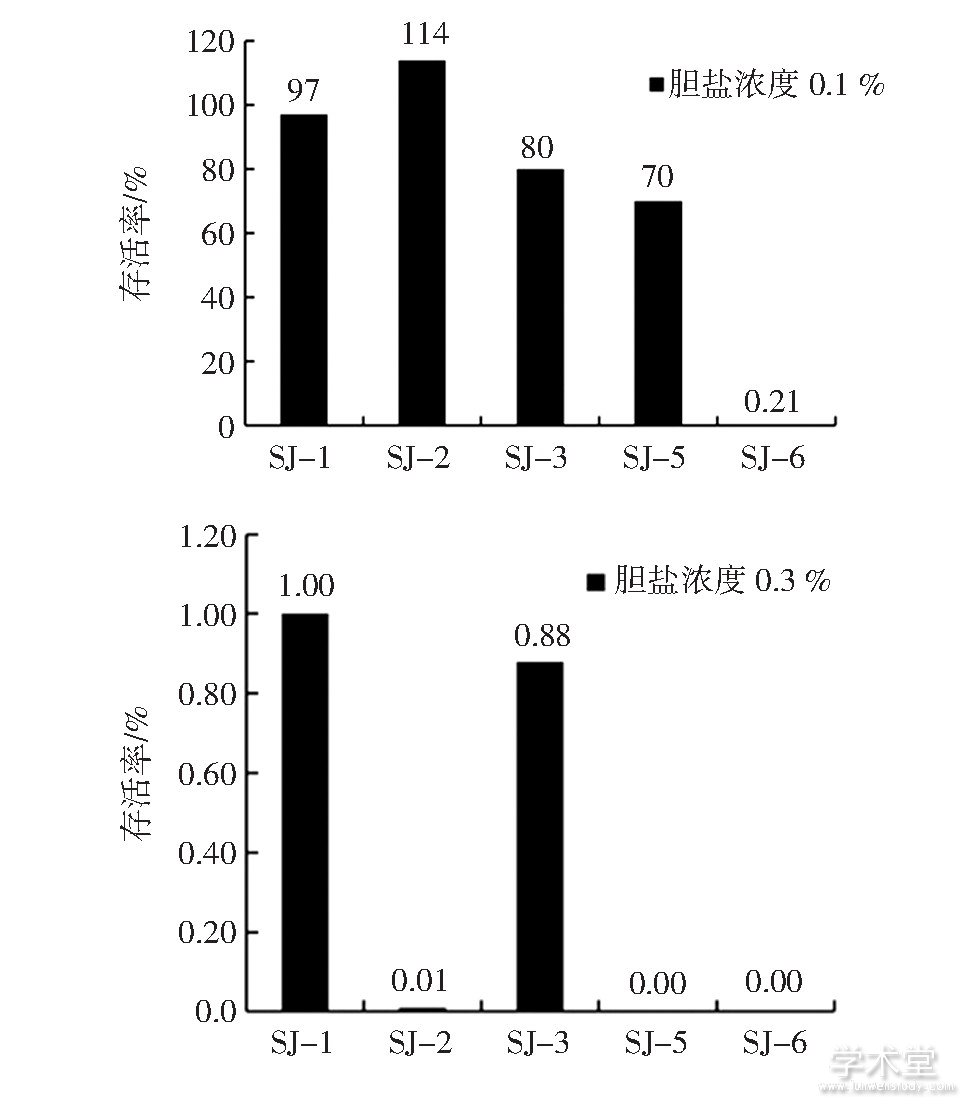
Fig.5 Bile resistance of 5 strains
由图5可知,5株乳杆菌对0.1%胆盐有一定的耐受力,除SJ-6的存活率仅有0.21%,其他4株菌的存活率均在70%以上。当胆盐浓度升高至0.3%时,乳酸菌的存活率明显降低,SJ-1、SJ-2、SJ-3的存活率分别只有1.00%、0.01%和0.88%。
2.3、 具有抑菌活性乳酸菌的筛选
牛津杯法测定抑菌圈大小见图6,6株乳酸菌代谢产物的抑菌活性结果如表2所示。
从表2可以看出,6株乳酸菌的代谢产物的抑菌效果。从表2可知,6株乳酸菌对指示菌均显示了抗菌活性。对蜡状芽孢杆菌和枯草芽孢杆菌,SJ-1显示了较强的抑菌活性,抑菌圈直径分别约为24.2、17.3 mm;SJ-3对大肠杆菌的抑菌圈直径约为10.4 mm,表现出较强的抑菌活性;SJ-6相比其他5个菌株对金黄色葡萄球菌的抑菌活性显着更高,抑菌圈直径约为13.8 mm。对表2中的结果进行综合分析可知,SJ-6对金黄色葡萄球菌的抑菌圈直径是最大的,SJ-1和SJ-6对枯草芽孢杆菌的抑菌圈直径也没有显着差异,因此SJ-6抑菌效果更好。
图6 牛津杯法测定抑菌圈大小
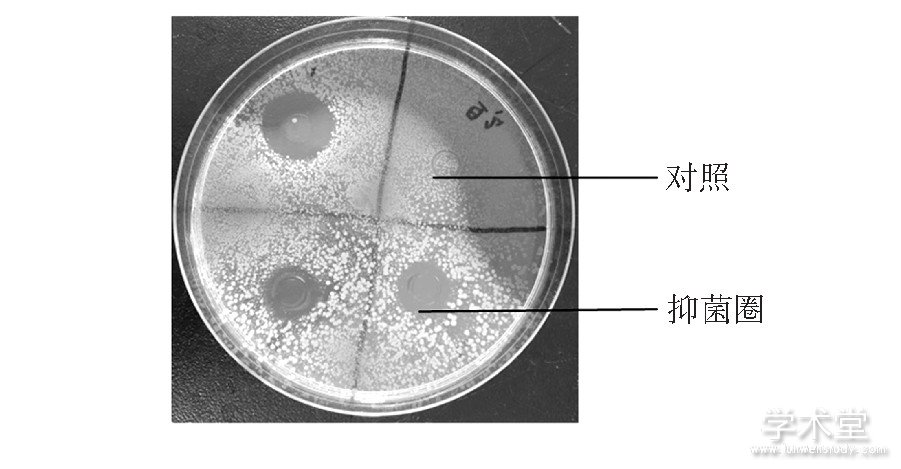
Fig.6 Determination of the size of the zone of inhibition by the Oxford cup method
表2 乳酸菌代谢产物的抑菌圈直径
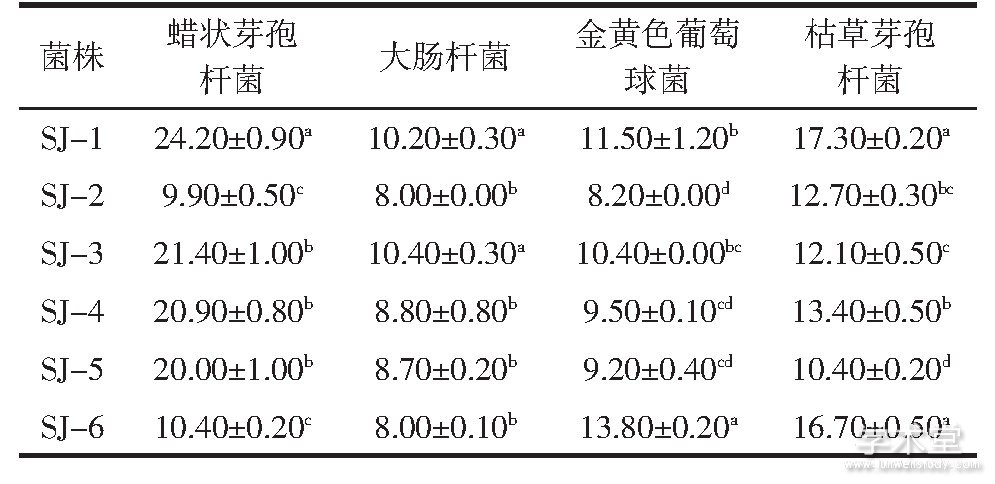
注:肩标不同小写字母表示差异显着(P<0.05);肩标相同小写字母标注表示差异不显着(P>0.05)。
2.4、 代谢产物酸碱处理后的抑菌活性测定
以蜡状芽孢杆菌为指示菌,不同pH值代谢产物的抑菌活性见表3。
表3 乳酸菌代谢产物调不同p H值后的抑菌圈直径
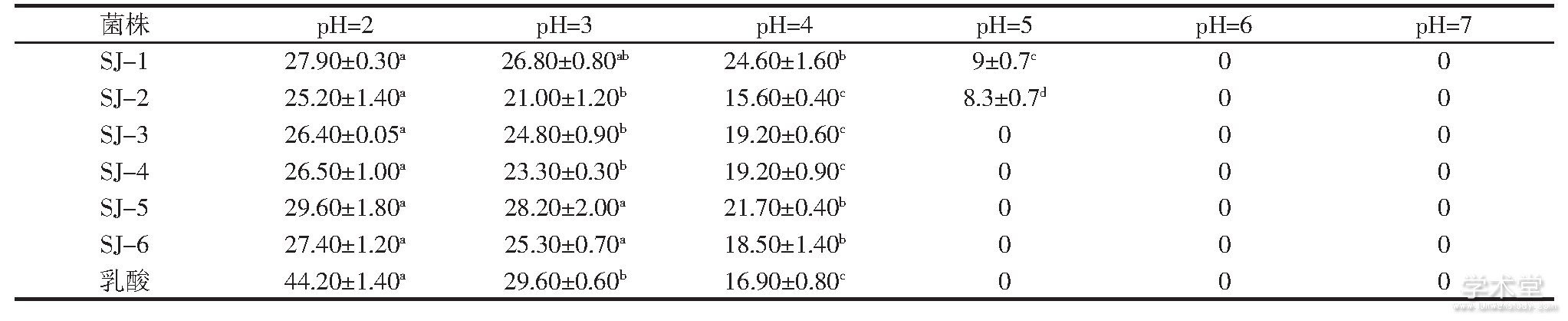
注:肩标不同小写字母表示差异显着(P<0.05);肩标相同小写字母标注表示差异不显着(P>0.05)。
分析表3数据可知,pH值大小会对乳酸菌代谢产物的抑菌活性产生显着影响。当pH值小于7时,代谢产物抑菌活性随pH值的升高而降低,当pH值为2.0、3.0、4.0时,6株乳酸菌的代谢产物均对蜡状芽孢杆菌表现出有抑菌活性,当pH值升高至5时,SJ-3、SJ-4、SJ-5、SJ-6与对照组的乳酸均失去抑菌活性,只有SJ-1、SJ-2的代谢产物仍保持抑菌活性。
从试验结果可以看出,SJ-3、SJ-4、SJ-5、SJ-6这4株菌代谢产物中包含有机酸类抑菌成分,或可能含有依赖有机酸产生抑菌作用的其他成分。而SJ-1、SJ-2代谢产物中除有机酸外仍含其他抑菌成分。
2.5、 代谢产物热处理后的抑菌活性测定
以蜡状芽孢杆菌为指示菌,SJ-1、SJ-2代谢产物在100℃下保持30 min的抑菌活性见表4。
表4 乳酸菌代谢产物热处理后的抑菌圈直径

注:肩标相同小写字母标注表示差异不显着(P>0.05)。
分析比较表4数据可知,代谢产物在沸水浴中处理30 min后,SJ-1、SJ-2菌株的抑菌圈大小没有发生明显的改变,表明热处理不会对其抑菌活性产生影响,抑菌成分具有良好的热稳定性。
2.6、 代谢产物酶处理后的抑菌活性测定
以蜡状芽孢杆菌为指示菌,酶处理后的菌株SJ-1、SJ-2代谢产物抑菌活性如表5所示。
表5 乳酸菌代谢产物酶处理后的抑菌圈直径

从表5可以看出,经过氧化氢酶处理后,菌株SJ-1、SJ-2代谢产物抑菌活性分别降低了12%和29%,说明代谢产物中包含过氧化氢作为抑菌成分;排除过氧化氢的干扰后,代谢产物仍具有抑菌活性,因此判定代谢产物中还含有其他成分的抑菌物质。代谢产物经蛋白酶K处理后,抑菌活性分别降低了31%、43%;胃蛋白酶处理后分别降低了14%、40%;木瓜蛋白酶处理后分别降低了15%、30%;胰蛋白酶处理后降低了13%、35%。说明菌株代谢产物中的抑菌物质对蛋白酶敏感,所以极有可能是一种蛋白类抑菌物质。
2.7、 乳酸菌16SrDNA序列分析
对乳酸菌SJ-1、SJ-2进行扩大培养、提取基因组DNA、扩增16SrDNA保守序列,对扩增产物进行琼脂糖凝胶电泳检测,验证得两菌株的保守序列大小相同,约为1 500 bp,结果见图7。
将测得的2株菌的PCR扩增产物序列与NCBI在线数据库比对发现,SJ-1与发酵乳杆菌(Lactobacillus fermentum)的16SrDNA的相似性达100%、SJ-2与的植物乳杆菌(Lactococcus plantarum)16SrDNA的相似性达99%,表6即为基因序列的比对结果。
图7 来源于浆水样品的2株乳酸菌的16SrDNA扩增产物
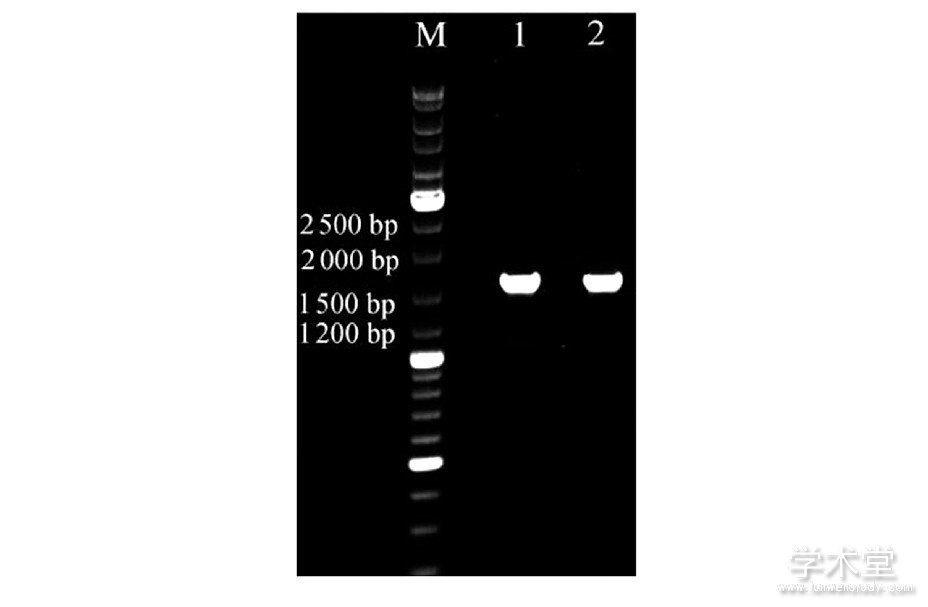
Fig.7 16SrDNA amplification products of 2 strains of lactic acid bacteria derived from Jiangshui celery
1、2依次为SJ-1、SJ-2的16Sr DNA扩增产物。
表6 分离菌株16SrDNA基因序列与GenBank已知菌序列的相似性比较

3、 结论与讨论
本研究从浆水中分离出6株乳酸菌,观察其形态特征,研究其生长曲线、产酸能力、耐酸耐胆盐能力,并从中筛选具抑菌活性的菌株。结果表明:分离纯化得到的乳酸菌菌落均呈圆形、白色、表面多光滑湿润,呈革兰氏阳性,在显微观察下菌体呈长杆状或短杆状。在相同培养时间内,菌株SJ-4的繁殖能力最强;菌株SJ-1最终pH值最低,产酸能力最强;菌株SJ-3、SJ-5表现出较好的耐酸能力,大部分的菌株对0.1%的胆盐表现出较好的耐受力,但当胆盐浓度升至0.3%,乳酸菌存活率大幅下降。菌株SJ-1、SJ-2代谢产物排除酸抑制作用和过氧化氢抑制作用及热处理后依然维持较高的抑菌活性,而经蛋白酶处理后,抑菌活性明显降低。表明其中存在一种蛋白质类的抑菌物质。对菌株SJ-1、SJ-2进行16SrDNA分子生物学鉴定,菌株SJ-1属于发酵乳杆菌属(Lactobacillus fermentum strain)、SJ-2属于植物乳杆菌属(Lactobacillus plantarum strain)。
近年来,国内外有不少关于产蛋白质类抑菌物质乳酸菌的研究报道,如LGG(Lactobacillus rhamnosus GG)、ZJ19[19]和KCA386[20],对李斯特氏菌、枯草芽孢杆菌和多数乳酸菌有抑制作用。本实验从甘肃传统浆水中筛选出2株具有抑菌活性的乳酸菌,探究了其抑菌菌株SJ-1(Lactobacillus fermentum strain)、SJ-2(Lactobacillus plantarum strain)产生的蛋白类抑菌物质,能对常见的金黄色葡萄球菌、蜡状芽孢杆菌等致病菌、腐败菌产生抑制效果,使其有可能作为病原微生物与食物腐败菌的天然屏障[21]并广泛应用到食品防腐保鲜加工业中。后续需要继续分离纯化菌株SJ-1、SJ-2所产生的抑菌物质,并充分评估其生物学活性和安全性,以期能够开发出新型的天然防腐剂。
参考文献
[1]孟宪刚,张丽珂,周鸽鸽,等.传统发酵食品:浆水研究概况及发展前景展望[J].食品工业科技, 2010,31(10):402-404
[2]张培.浆水制备工艺和营养成分分析方法的研究[D].兰州:兰州大学,2014
[3]张勇,吕嘉枥,闫亚梅,等.传统发酵浆水中乳酸菌和酵母菌的分离与鉴定[J].中国食品学报, 2017,17(6):179-186
[4]李雪萍.浆水中可培养微生物多样性及特性的研究[D].兰州:兰州交通大学,2014
[5]张晓辉,杨靖鹏,王少军.等.浆水中细菌多样性分析及乳酸菌的分离鉴定[J].食品科学, 2017,38(4):70-76
[6]赵树欣.应重视对我国传统发酵食品的研究:兼论发酵食品中的功能成分[J].中国食物与营养, 2004,9(1):27-29
[7] JEUN J, KIM S, CHO S Y, et al. Hypocholesterolemic effects of Lactobacillus plantarum KCT3928 by increased bile acid excretion in C57BL/6 mice[J]. Nutrition, 2009, 26(3):321-330
[8] WANG Y, XU N, XI A, et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-vholesterol diet[J]. Applied Microbiology and Biotechnology, 2009, 84(2):341-347
[9] ELIZABETH C, GERALD F. Food fermentations:role of microorganisms in food production and preservation[J]. International Journal of Microbiology, 1999, 50(2):131-149
[10] ADAMS M R, NICOLAIDES L. Review of the sensitivity of different pathogens to fermentation[J]. Food Control, 1997, 8:227-239
[11]王俊国.降胆固醇益生乳杆菌的筛选及其降胆固醇作用的研究[D].呼和浩特:内蒙古农业大学,2008
[12] Reid G, McGroarty J A, Angotti R, et al. Lactobacillus inhibitor production against Escherichia coli and coaggregation ability with uropathogens[J]. Can J Microbiol, 1988, 34(3):344-351
[13] MOORE E R B, AMSCHEIDT A, KRUGER A, et al. Simplified protocols for the preparation of genomic DNA from bacterial cultures[J].Molecular microbial ecology manual, 1999, 1(1):1-15
[14]刘孝永,裘纪莹,孙欣,等.泡菜中两株乳酸菌的分离鉴定及其混合培养初探[J].山东农业科学, 2012, 44(9):85-89
[15] SCARPELLINI M, MORA D, COLOMBO S, et al. Development of genus, species. specific PCR analysis for identification of Carnobacterium strains[J]. Current Microbiology, 2002, 45(1):24-29
[16] YU Jie, DU Xiaohua, WANG Weihong, et al. Phenotypic and genotypic characteristics of lactic acid bacteria isolated from sour congee in Inner Mongolia of China[J]. The Journal of General and Applied Microbiology, 2011, 57(4):197-206
[17]武帅帅,冯云霄,康倩,等.不同地区浆水菜中可培养乳酸菌的组成分析[J].基因组学与应用生物学, 2017,36(3):952-959
[18]李良凤.浆水中益生菌群的研究及浆水发酵工艺的研究[D].西安:陕西科技大学,2013
[19]王净净,顾青. 1株分泌细菌素屎肠球菌ZJ19的筛选和鉴定[J].中国食品学报,2014,14(1):380-383
[20]闵钟熳,朱光泽,岳喜庆.不同来源产细菌素乳酸菌的分离筛选及鉴定研究[J].食品研究与开发,2009,30(4):36-39
[21] Zacharof M P, Lovitt R W. Bacteriocins produced by Lactic Acid Bacteria a review article[J]. APCBEE Procedia, 2012, 6(2):50-56
乳酸菌可以促进蛋白质、钙、铁等营养物质的吸收,有利于促进肠道益生菌的增殖,抑制有害菌的生长,能改善人体免疫力和提高抵抗力,有预防肠癌、保护肝脏、美容养颜等作用。...
乳酸菌(lactic acid bacteria)是一类革兰氏染色呈阳性的兼性厌氧细菌,在形态和生理特征方面不完全相同,能代谢多种碳水化合物并产生乳酸。...
肠道微生物在人类健康与疾病中起着重要作用, 肠道微生物的代谢功能被认为是疾病发展的一个促进因素, 其产生的生物活性物质对宿主的生理、病理过程有重要影响。...