摘 要: 细胞外囊泡(EV)是细胞在静息或应激状态下释放的各种具有脂质双层膜结构的囊泡总称。根据EV的生成方式、大小或功能不同,可以分为外泌体、微囊泡和凋亡小体等不同亚群。EV的体积小、密度低、分离难度大,而且不同的分离方法得到的EV理化性质不同。目前对EV的认识尚不充分,鉴定方法也缺乏统一标准,是制约EV研究和应用转化的最主要因素。该文就EV的分类、产生机制、特征以及EV的分离和鉴定方法进行综述,为EV的研究提供参考。
关键词: 细胞外囊泡; 外泌体; 微囊泡; 分离; 鉴定;
Abstract: Extracellular vesicles(EV) are a variety of membrane vesicles consisting of lipid bilayers released by cells in a resting or stress state. EV can be divided into different subgroups, such as exosomes, microvesicles and apoptotic bodies according to the formation mode, size or function. It is difficult to isolate EV because of its small volume and low density. Moreover, the physical and chemical properties of EV vary after the isolation by different methods. Currently, insufficient understanding of EV and lack of uniform criteria for identification are the main factors restricting the research and translational application of EV. In this article, the classification, biogenesis mechanism and characteristics of EV, as well as the isolation and identification methods of EV were reviewed to provide reference for EV research.
Keyword: Extracellular vesicle; Exosome; Microvesicle; Isolation; Identification;
细胞外囊泡(EV)是细胞在静息或应激状态下释放的各种具有脂质双层膜结构的囊泡总称,囊泡的直径从数十纳米至数微米。几乎所有活细胞均可释放EV,它们存在于各种生物流体中,如血液、唾液、尿液以及细胞外环境等。
越来越多的证据表明,EV中包含母细胞相关的蛋白质(如CD9、CD63、CD81、MHC-I等)、脂类、核苷酸[包括DNA、信使RNA(mRNA)、微小RNA(miRNA)、环状RNA(cirRNA)及其他非编码RNA]和糖等多种生物活性物质,通过靶细胞内化、受体-配体间相互作用或脂质膜融合等方式,广泛参与细胞之间的信息传递,对维持各种生理过程至关重要,如免疫监视、凝血、干细胞维护、组织修复等。此外,有研究发现EV还参与传染病和炎症、神经系统疾病和癌症等多种病理过程,可用于监测疾病进展和治疗反应等,同时由于它们具有递送生物活性物质的功能,可开发成为新的药物载体。这些EV的存在为多方位、多角度揭示疾病发生、发展机制提供了丰富的生物学信息,有望成为生物医学研究和应用开发的技术平台[1]。近年来研究发现,间充质干细胞(MSC)来源的EV具有与MSC相似的生物学效应,如减少细胞凋亡、减轻炎症反应、促进血管生成、抑制纤维化、提高组织修复潜力等,而且易提取、改造,与干细胞移植相比致瘤风险低,在损伤修复的生物学治疗中具有广阔应用前景[2]。
鉴于EV具有重要生物学功能、广阔的研究和应用前景,近年来对EV的研究呈指数性增长,作为一个新兴领域受到学者的广泛关注。然而,由于EV的体积非常小,对其分离、观察和鉴定具有一定的挑战性,寻找高效的EV分离和鉴定方法是研究的前提。本文就上述问题进行文献综述,为EV的研究提供一定的参考。
一、EV的分类、产生机制及特征
根据EV的生成方式、大小或功能不同,可以分为起源于内吞途径的外泌体、质膜释放的微囊泡和细胞凋亡产生的凋亡小体3种亚群[1]。

3种EV亚群的产生机制不同。外泌体起源于细胞的内涵体系统[2]。首先细胞膜内陷形成初级内涵体,内涵体膜再次内陷形成多个腔内小泡,此时包含多个腔内小泡的内涵体即次级内涵体也叫做多囊泡体。多囊泡体是真核细胞重要的蛋白运输与分拣中心,当多囊泡体与胞膜融合后,其内的管腔状囊泡凹陷,以内出芽方式形成直径为30~120 nm颗粒状小囊泡,并释放入细胞外环境,即外泌体。微囊泡是细胞质膜直接以“出苞”的方式向细胞外突出形成的大囊泡,直径为100~1000 nm。凋亡细胞的胞膜内陷,分割包裹核碎裂形成的染色质块(核碎片)和胞质,然后通过出苞或起泡等方式,从细胞脱落形成一些大小不等的囊泡,即凋亡小体。此外,凋亡细胞内线粒体、内质网等细胞器和胞质成分被内质网膜包裹形成自噬体,与凋亡细胞膜融合后,排出体外也可形成凋亡小体,直径800~5000 nm。这3种EV亚群的特征见表1。本文中EV主要指外泌体和微囊泡。
EV的组成成分并非随机的,研究表明,细胞在不同的状态分泌的EV内含物不同,每一个EV都会携带特定的分子信息,包装的独特分子构成决定了要传递给受体细胞的细胞外信号的类型,而且由一个复杂的分选系统来决定那些分子能够进入细胞外囊泡[3]。4种不同的机制可用于描述这种“货物”装载方式:转运需要的内涵体分选复合物(ESCRT)机器及相关蛋白质、大量脂质、高阶聚化反应、通过神经酰胺分离成微区。
表1 3 种EV亚群的主要特征

二、分离方法
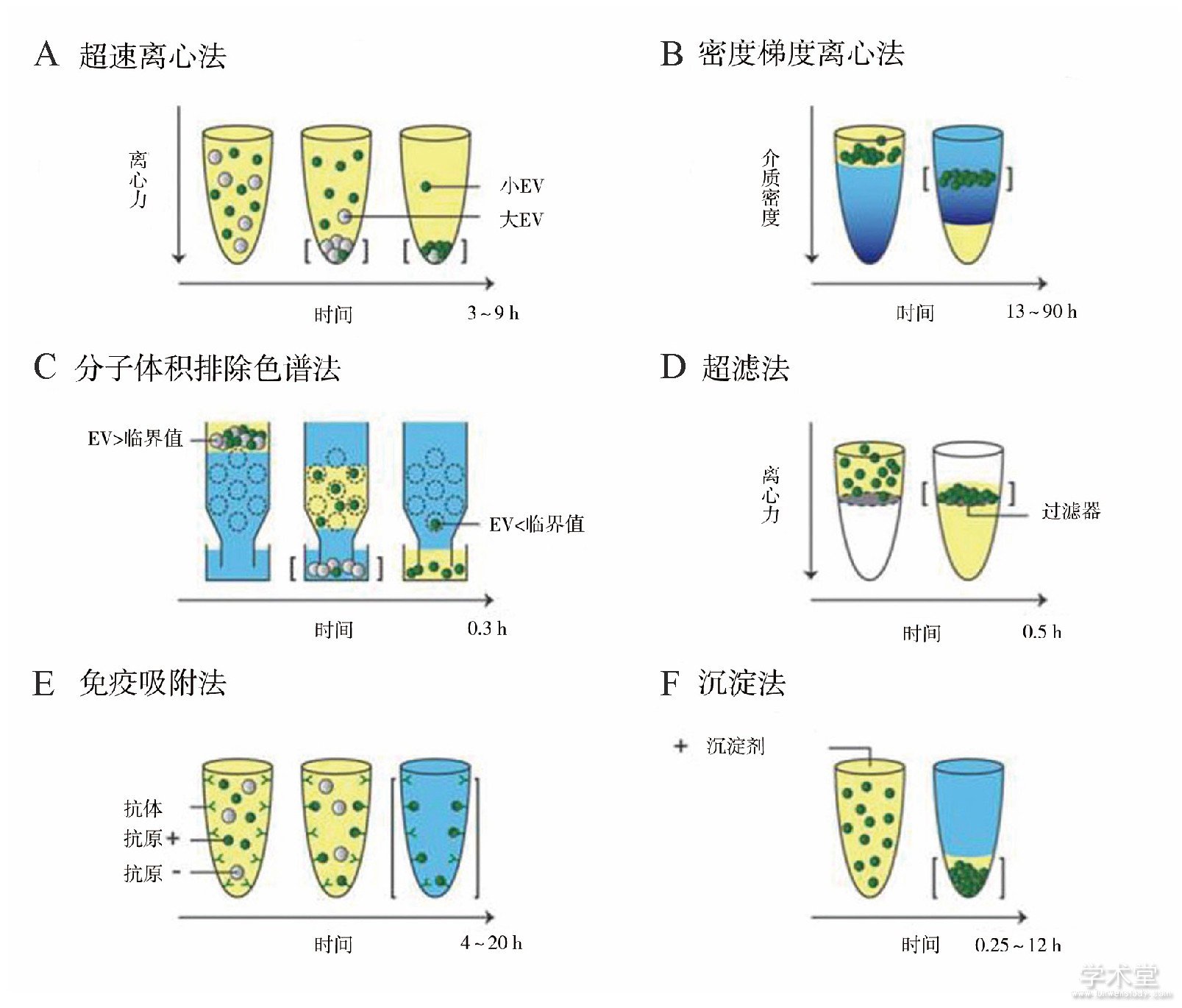
EV的体积小、密度低,分离难度大,而且不同的分离方法得到的EV理化性质不同,这导致了EV研究存在大量不可控性和难重复性,是制约EV研究和应用转化的最主要因素[4]。利用EV的物理和生物化学性质,已经开发了许多分离技术,如超速离心法、密度梯度离心法、免疫吸附法、沉淀法、基于微流控的分离技术等[5]。但是,在所有已知的方法中,还没有同时满足快速、简便、高效及提取的EV形态、纯度、产量和生物活性均符合后续实验要求的方法。目前商品化的沉淀试剂盒提取外泌体速度快,产量高,但是价格较为昂贵,试剂残留较多,有一定的细胞毒性,对后续的功能试验影响较大。只有将现有的提取方法进行整合,才能有效降低样本中的杂质[4]。目前普遍应用的提取外泌体的方法主要是针对外泌体内生物活性物质的研究,一旦将其应用于临床治疗,寻找有效提高外泌体纯度和产量的方法亟待解决。图1、表2汇总了目前常用分离方法的工作原理和优缺点。
除了上述方法外,还有一些学者尝试用离子体共振生物传感器、纳米脂质探针系统、微流控系统、基于胆固醇含量的热辅助声流体分离囊泡的技术、旋转超滤技术、免疫修饰的超顺磁性纳米颗粒等技术,为快速、高效和高纯度的EV分离和洗脱提供新的途径,进而有益于外泌体的应用[6]。
EV的稳定性较好,易于保存。常用的保存方法是将其重悬于无菌磷酸盐缓冲液(PBS)溶液中,冻存在-80℃的条件下,可保存1年,且不改变其形态和生物学特性。-20℃条件冻存可稳定保存6个月[7]。最新研究表明,低pH的酸性环境有利于EV的稳定保存,并且能够提高EV的产量[8]。
表2 分离EV常用方法比较
图1 分离EV常用方法的工作原理
三、鉴定方法
目前对EV(主要是外泌体)的鉴定方法包括形态学、粒子大小、表面标志物等方面,分述如下:
1. 基于抗体的鉴定方法
鉴于EV是在细胞膜通路中产生的,因此与此通路相关的抗体靶向标记可以对其进行鉴定。其中包括四跨膜蛋白超家族(CD9、CD63和CD81)、AIP1/Alix、TSG101和CD326/EPCAM[9]。蛋白鉴定的方法可使用蛋白免疫印迹法。这一方法可与以下所述的一些技术结合使用,以确定EV的种群。
2. 透射电镜
透射电镜可用于观察EV的表面特征。将纯化的EV置于悬浮液中,放在显微镜样品格上,用醋酸铀和纤维素进行阴性染色后,透射电镜可清晰地显示EV的形态。镜下观察,EV呈现双层膜包裹的囊泡结构,常被描述为“杯子形状”,然而这也可能是处理样品时因烘干造成的假象。因此,这一方法不应作为EV的一个明确特征,也不能用于EV来源的鉴定。
在电镜检查准备中,相较单一的阴性染色,还可对上述抗原进行单一或双重染色,然后使用具有抗体特异性的不同大小的金纳米粒子(例如一个抗体6 nm,另一种10 nm)来进行二次染色。在电子显微图像中,这些纳米粒子可以清楚地区分不同大小的EV[10]。此外,还可用标准的组织电子显微技术进行鉴定,通过抗体和组织切片的结合,得到更准确的EV存在的评估方法[11]。
3. 根据粒子大小的鉴定方法
根据粒子大小对EV进行鉴定最常用方法之一是NanoSight纳米粒子跟踪分析技术(NTA)。这一技术是在光学显微镜上安装了高清摄像机,利用光散射和布朗运动的性质,通过斯托克斯-爱因斯坦方程(纳米颗粒在其悬浊液中单位时间内的移动速度与其本身的粒度、溶液的粘度和温度存在数量上的关系),对50~1000 nm直径范围内特定的外泌体和微囊泡进行逐个直接成像和观察,得到与之相关的高分辨率的粒度分布数据和浓度信息,可用于外泌体的半定量检测。与透射电镜不同,不需要干燥、固定以及冷冻等检测前处理,NTA可实现原位、更接近其原始状态下测试,对EV颗粒可提供结构与功能上的保护,保证了测量数据的真实性和有效性。
替代NTA的还有动态光散射技术(DLS)[12]。这两种技术都是基于粒子的布朗运动原理。然而,DLS是通过测量样本的激光散射来计算粒子的速度,而不是测量粒子在给定时间的运动距离。另外,IZON qNano能根据可调谐电阻脉冲传感技术测量粒子的大小和浓度[13]。
上述方法需要的样本量非常小,而且具有可靠、半定量、快速和易用等优点。值得注意的是,这些方法不能确定EV的来源,而且可能包括膜和其他细胞的碎片,或脂蛋白复合物。因此,这些技术应与其他更多的“定性”技术相结合,特别是电镜,来对EV进行鉴定。
4. 流式细胞仪
EV由于颗粒太小,低于常规流式细胞仪分析的阈值,因此不能准确区分粒子与噪声。外泌体荧光标记后可以被流式细胞仪识别,但由于“蜂拥效应”仪器本身无法准确地将粒子与噪音分开,故而粒子的多少不能被量化[14]。替代的方法是使用乳胶微球直接或以EV特异性抗体间接来绑定EV,这种抗体结合的乳胶微球可自行制作或商业化购买。然后,被绑定的EV还可以用其他荧光结合的特异性抗体进行标记。由于不清楚每个乳胶微球上绑定了多少粒子,因此粒子的数量仍不能直接获得,但这种方法用于分析EV的表面抗原[15]。
5. 荧光和共聚焦显微技术
EV可以用亲脂性膜结合染料(如PKH67、Di D等)进行标记,也可利用其表面的巯基对EV进行标记[16,17,18]。此技术不能真正对每个EV进行可视化,但可用于标记的EV能否被细胞摄取的研究。
6. 其他方法
其他检测单个EV的方法有原子力显微镜、场发射扫描电子显微镜、拉曼光谱分析、微核核磁共振、小角度X射线散射、反常SAXS和电阻脉冲传感等[19]。
上述鉴定方法可结合使用,根据国际EV协会于2014年发表的一个指导手册,建议鉴定外泌体首先需要通过蛋白免疫印迹法来鉴定EV的标志蛋白是否存在于样品中,然后通过电子显微镜来观察样品中EV的形态特征,通过NTA等手段来分析样品中EV的群体特征(粒子浓度、直径分布等)。其他方法可根据研究需要决定是否应用。
综上所述,EV作为广泛存在的、参与细胞间信息传递的生物活性物质,在生理、病理过程中发挥重要作用。作为近年来研究的新兴领域,EV的分类、产生机制、特征也逐渐被认识,然而,由于EV体积小、密度低,其分离、鉴定难度大,是制约研究和转化的重要因素。结合不同机理的分离和鉴定方法,以及开发更为高效、便捷的技术,是解决EV研究的重要途径。
参考文献
[1]Raposo G,Stoorvogel W.Extracellular vesicles:exosomes,microvesicles,and friends.J Cell Biol,2013,200(4):373-383.
[2]Huang L,Ma W,Ma Y,Feng D,Chen H,Cai B.Exosomes in mesenchymal stem cells,a new therapeutic strategy for cardiovascular diseases?Int J Biol Sci,2015,11(2):238-245.
[3]Kim HS,Choi DY,Yun SJ,Choi SM,Kang JW,Jung JW,Hwang D,Kim KP,Kim DW.Proteomic analysis of microvesicles derived from human mesenchymal stem cells.J Proteome Res,2012,11(2):839-849.
[4]Paolini L,Zendrini A,Di Noto G,Busatto S,Lottini E,Radeghieri A,Dossi A,Caneschi A,Ricotta D,Bergese P.Residual matrix from different separation techniques impacts exosome biological activity.Sci Rep,2016,6:23550.
[5]Coumans FAW,Brisson AR,Buzas EI,Dignat-George F,Drees EEE,El-Andaloussi S,Emanueli C,Gasecka A,Hendrix A,Hill AF,Lacroix R,Lee Y,van Leeuwen TG,Mackman N,M?ger I,Nolan JP,van der Pol E,Pegtel DM,Sahoo S,Siljander PRM,Sturk G,de Wever O,Nieuwland R.Methodological guidelines to study extracellular vesicles.Circ Res,2017,120(10):1632-1648.
[6]Cai S,Luo B,Jiang P,Zhou X,Lan F,Yi Q,Wu Y.Immunomodified superparamagnetic nanoparticles via host-guest interactions for high-purity capture and mild release of exosomes.Nanoscale,2018,10(29):14280-14289.
[7]Konala VB,Mamidi MK,Bhonde R,Das AK,Pochampally R,Pal R.The current landscape of the mesenchymal stromal cell secretome:a new paradigm for cell-free regeneration.Cytotherapy,2016,18(1):13-24.
[8]Ban JJ,Lee M,Im W,Kim M.Low pH increases the yield of exosome isolation.Biochem Biophys Res Commun,2015,461(1):76-79.
[9]Théry C,Ostrowski M,Segura E.Membrane vesicles as conveyors of immune responses.Nat Rev Immunol,2009,9(8):581-593.
[10]van Weering JR,Brown E,Sharp TH,Mantell J,Cullen PJ,Verkade P.Intracellular membrane traffic at high resolution.Methods Cell Biol,2010,96:619-648.
[11]Février B,Raposo G.Exosomes:endosomal-derived vesicles shipping extracellular messages.Curr Opin Cell Biol,2004,16(4):415-421.
[12]Sahoo S,Klychko E,Thorne T,Misener S,Schultz KM,Millay M,Ito A,Liu T,Kamide C,Agrawal H,Perlman H,Qin G,Kishore R,Losordo DW.Exosomes from human CD34(+)stem cells mediate their proangiogenic paracrine activity.Circ Res,2011,109(7):724-728.
[13]Coumans FA,van der Pol E,B?ing AN,Hajji N,Sturk G,van Leeuwen TG,Nieuwland R.Reproducible extracellular vesicle size and concentration determination with tunable resistive pulse sensing.J Extracell Vesicles,2014,3:25922.
[14]van der Pol E,van Gemert MJ,Sturk A,Nieuwland R,van Leeuwen TG.Single vs.swarm detection of microparticles and exosomes by flow cytometry.J Thromb Haemost,2012,10(5):919-930.
[15]Ostrowski M,Carmo NB,Krumeich S,Fanget I,Raposo G,Savina A,Moita CF,Schauer K,Hume AN,Freitas RP,Goud B,Benaroch P,Hacohen N,Fukuda M,Desnos C,Seabra MC,Darchen F,Amigorena S,Moita LF,Thery C.Rab27a and Rab27b control different steps of the exosome secretion pathway.Nat Cell Biol,2010,12(1):19-30;sup pp 1-13.
[16]Lugini L,Cecchetti S,Huber V,Luciani F,Macchia G,Spadaro F,Paris L,Abalsamo L,Colone M,Molinari A,Podo F,Rivoltini L,Ramoni C,Fais S.Immune surveillance properties of human NK cell-derived exosomes.J Immunol,2012,189(6):2833-2842.
[17]Tian T,Zhu YL,Zhou YY,Liang GF,Wang YY,Hu FH,Xiao ZD.Exosome uptake through clathrin-mediated endocytosis and macropinocytosis and mediating miR-21 delivery.J Biol Chem,2014,289(32):22258-22267.
[18]Roberts-Dalton HD,Cocks A,Falcon-Perez JM,Sayers EJ,Webber JP,Watson P,Clayton A,Jones AT.Fluorescence labelling of extracellular vesicles using a novel thiol-based strategy for quantitative analysis of cellular delivery and intracellular traffic.Nanoscale,2017,9(36):13693-13706.
[19]van der Pol E,Coumans FA,Grootemaat AE,Gardiner C,Sargent IL,Harrison P,Sturk A,van Leeuwen TG,Nieuwland R.Particle size distribution of exosomes and microvesicles determined by transmission electron microscopy,flow cytometry,nanoparticle tracking analysis,and resistive pulse sensing.JThromb Haemost,2014,12(7):1182-1192.
星形胶质细胞(astrocytes,AS)是中枢神经系统(central nervous system,CNS)中最丰富的胶质细胞类型,具有提供营养物质、调节细胞外离子浓度、协助神经元代谢等多种神经支持功能。...
外泌体是一类包载有生物活性分子如脂类、核酸、蛋白质等的膜性囊泡,直径大小约为30~100 nm,是已知的最小的胞外囊泡。外泌体可由绝大多数类型的细胞分泌产生,如肿瘤细胞、内皮细胞等;亦可存在于血液、脑脊液及乳汁等体液中。...
自噬与外泌体在细胞代谢中起着重要的作用。自噬是真核细胞中广泛存在的细胞内降解途径,自噬小体中含有蛋白质、受损的细胞器和侵入性病原体等,内容物会被转运至溶酶体并被溶酶体酸性水解酶降解。...
干细胞在治疗肝病相关研究中显示出了诱人的应用前景,其具有自我更新、多向分化、免疫调节等特性,在动物模型和临床试验中已经证实了干细胞具有改善肝功能的作用,是未来肝病治疗的新方向。...