
自 Wilmut 等获得体细胞核移植后代“多利”以来,体细胞核移植技术获得快速发展。Baguis 等( 1999) 采用体细胞核移植技术首次获得了克隆山羊。此外,Keefer 等用外源基因转染的体细胞为核供体,通过体细胞核移植方法获得转基因山羊。目前,利用体细胞核移植技术已成为制作转基因动物的有效手段。为了建立通过山羊乳汁获得抗菌肽( Antimicrobial peptides,ABP) 的方法,本研究利用在前期工作获得的中国林蛙皮肤 ABP 的真核表达载体 Tem-GFP-pBC1,转染山羊乳腺上皮细胞以获得便于检测并能在山羊乳腺特异表达 Tem-GFP 的转基因阳性细胞。本研究进一步开展通过体细胞核移植获得山羊乳腺特异表达 ABP 的转基因山羊的相关研究奠定基础。
1、 材料与方法
1.1 实验材料
1.1.1 实验用细胞 山羊乳腺上皮细胞( 由东北农业大学高学军教授馈赠)。
1.1.2 主要药品和试剂 SalI( TaKaRa) ; 脂质体 Lipofectamine 2000( invitrogen) ; 基因组 DNA 提取试剂盒( TaKaRa) ; RNA 提取试剂 RNAiso plus( TaKaRa) 。
1.1.3 重组质粒 Tem-GFP -pBC1 利用前期工作中构建的重组质粒 Tem-GFP-pBC1,即在提取中国林蛙皮肤抗菌肽 Temporin-1CEa mRNA 基础上,通过反转录获得其 cDNA。利用 cDNA、pEASY-T3 克隆载体和 GFP 基因构建获得山羊乳腺特异表达的重组质粒 Tem-GFP-pBC1。
1.2 实验方法
1.2.1 山羊乳腺上皮细胞的传代 采用常规方法,将冷冻保存的山羊乳腺上皮细胞经解冻复苏后,在二氧化碳培养箱中( 37 ℃,5% CO2,饱和湿度) 进行培养。当细胞达到 90%以上汇合时,进行传代培养。
1.2.2 山羊乳腺上皮细胞的转染及转基因阳性细胞的筛选 采用王春生等方法,用通过 SalI 单酶切后线性化的重组质粒 Tem-GFP-pBC1 或者空载体 pEASY-T3( 对照组) 对山羊乳腺上皮细胞进行转染,48 h 后,利用含有 400 μg / mL G418( 预筛选的最佳浓度) 选择培养基进行转基因阳性细胞筛选。

1.2.3 转基因细胞的鉴定 将上述获得的转基因阳性细胞进行传代培养,观察其细胞形态、生长曲线、冷冻复苏后增殖特点等。此外,根据基因组 DNA 提取试剂盒说明提取上述筛选获得的转 Tem-GFP-pBC1 的阳性细胞的基因组 DNA。采用根据 Tem-GFP -pBC1 序列设计的引物( 5’-TCAAGGAGGATG-GCAACA-3’和 5’-GTGGACAGGTAGT GGTTATC-3’) 对细胞基因组 DNA 进行 PCR 检测。
1.2.4 转基因阳性细胞的 Tem-GFP 基因 RT-PCR 检测 根据 Genbank 中山羊 GAPDH 基因序列和插入基因 Tem-GFP 序列,利用 Oligo6.0 和 Primer 6.0 软件,分别设计 1 对 RT-PCR 引物( GAPDH: 5’-AT-CACTG CCACCCAGAAGACT-3’和 5’-CATGCCAGTGAGCTTCCCGTT - 3’; Tem -GFP: 5’-TCAAGGAG-GATGGCAACA-3’和 5’-GTGGACAGGTAGTGGT TATC-3’) ; 采用 Trizol 法分别提取转染前后细胞的总RNA,并经反转录获得 cDNA; 。聚合酶链式反应: 采用 25 μL 反应体系进行,反应混合物包括 10× buffer2.5 μL( 含 MgCl2) ,cDNA1.5 μL,引物各 0.5 μL,dNTP 0.5 μL,Taq 酶 0.3 μL,ddH2O 19.7 μL。反应条件为: 94 ℃预变性 5 min,94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸30 s,30 个循环; 72 ℃延伸10 min 后保存于 4 ℃。扩增结束后,取 5 μL PCR 产物于 1.0%琼脂糖凝胶进行电泳,并用凝胶成像系统记录结果。
2、 结果分析
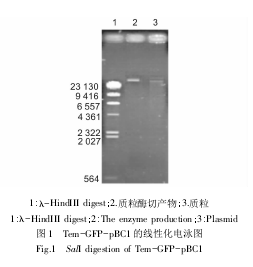
2.1 乳腺特异性表达载体 Tem-GFP-pBC1 的线性化
将乳腺特异性表达质粒 Tem-GFP-pBC1 经 SalI 单酶切进行线性化,并通过琼脂糖凝胶电泳进行鉴定,其结果,与未经SalI 单酶切的 Tem-GFP-pBC1( 阴性对照) 的双条带不同,Tem-GFP-pBC1 经 SalI 单酶切后,仅能观察到 1 条条带( 图 1) 。
2.2 转染 Tem-GFP-pBC1 的山羊乳腺上皮细胞
当传代培养的山羊乳腺上皮细胞( 图 2) 达到 90%以上汇合时,采用脂质体法转染经线性化的山羊乳腺特异表达载体 Tem-GFP-pBC1,其结果,在转染后的第 24 h,在荧光倒置显微镜下可观察到表达 GFP 的细胞,在转染后的第48 h,约有 60%细胞表达 GFP( 图 3) 。
2.3 转基因阳性细胞的筛选
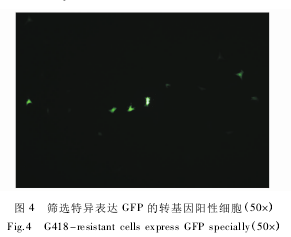
将上述经转染 48 h 的转 Tem-GFP-pBC1 阳性细胞,利用 G418 进行阳性细胞筛选,其结果,获得在荧光倒置显微镜下发出绿色荧光( 表达 GFP) 的转基因阳性细胞( 图 4) 。
2.4 转基因阳性细胞的鉴定
2.4.1 转基因阳性细胞的形态 在荧光倒置显微镜下,转基因阳性细胞( 图 5) 和传代培养的山羊乳腺上皮( 图 2) 一样,分散的细胞呈现梭形,而堆积存在的细胞呈现圆形或椭圆形。当细胞达到 90%以上汇合时,细胞的形态呈现圆形或椭圆形( 图 6) 。

2.4.2 转基因阳性细胞的生长曲线 将获得的转基因阳性细胞进行续培养时,于续培养后的第24 h 开始贴壁,前 4 d 生长缓慢,第 9 天时细胞汇合至约 90%,而第 10 天始趋于平稳,其生长曲线呈“S”形,符合细胞生长的生物学规律( 图 7) 。
2.4.3 转基因阳性细胞的冷冻复苏后的生物学特性 将冷冻保存的转基因细胞经复苏后进行续培养,并在荧光倒置显微镜下观察其形态,其结果,和正常传代培养的山羊乳腺上皮细胞一样,分散时呈现梭形,当到达 90%以上汇合时,呈现圆形或椭圆形( 图未显示) ; 当对复苏的细胞进行续培养时,培养后 24 h 开始贴壁,前 4 d 生长缓慢,第 9 天时细胞汇合达到 90%以上,10 d 后趋于平稳,整个过程呈现“S”型( 图 7) 。
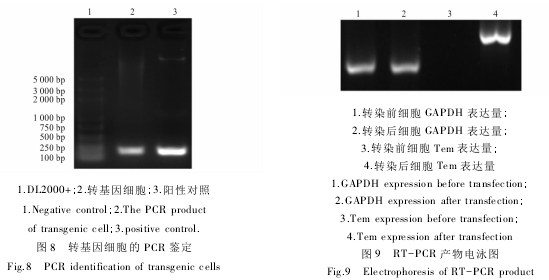
2.4.4 转基因阳性细胞的 PCR 鉴定 转染 Tem-GFP -pBC1 后,收集利用含 G418 的培养基筛选的具有正常增殖能力的山羊乳腺上皮细胞,提取其基因组,利用特异性引物进行 PCR 扩增,可得与阳性对照( Tem-GFP-pBC1 质粒) 相一致的约 240 bp 的目的条带( 图 8) 。
2.4.5 转基因细胞的 Tem-GFP 相对表达量的检测 将 RT-PCR 的产物进行琼脂糖凝胶电泳后,转染前后 GAPDH 基因表达量持平,未转染细胞没有检测到抗菌肽基因的表达,而转染细胞可以检测到与理论值一致的目的条带( 如图 9) 。
3 讨 论
ABP 是广泛存在于生物体内的一种由 20 ~ 60 个氨基酸构成的具有生物活性的小分子多肽由于 ABP 具有相对分子质量低、较好的水溶性、低抗原性和较强的热稳定性,且抗菌肽是通过增加原核细胞膜的通透性而诱发抑菌或杀菌,不易引起病原体对其产生耐药性等生物学特性。为了获取 ABP的方法,许多学者探索了直接利用昆虫、两栖类动物组织等提取 ABP 的方法,但是,存在操作复杂、产量低、成本高等缺陷,难以获得大量高纯度的 ABP。
自 Simons 等首次利用转基因小鼠的乳腺表达绵羊 β-球蛋白获得成功以来,该项技术已不断完善。以乳腺作为生物反应器大量生产生物活性蛋白变得可能。随着体细胞克隆技术的不断完善,通过外源 DNA 转染的体细胞为核供体的体细胞核移植转基因绵羊、牛、猪和山羊相继获得成功。上述结果表明,如果利用目的基因构建乳腺特异的表达载体,经转染体细胞后获得转基因阳性细胞,再通过体细胞核移植的方法就有可能获得目的基因在乳腺中特异表达的转基因动物。
为了建立通过山羊乳汁获得中国林蛙抗菌肽的方法,本研究在对前期工作中获得山羊乳腺特异表达的真核表达载体 Tem-GFP-pBC1 转染传代培养的山羊乳腺上皮细胞,并经 G418 筛选获得转基因阳性细胞。其结果,将线性化的 Tem-GFP-pBC1( 图 1) 转染传代培养的山羊成纤维细胞( 图 2,3)后,经 G418 筛选获得转基因阳性细胞( 图 4) ; 转基因阳性细胞和经冷冻复苏的转基因阳性细胞进行续培养后,其细胞形态( 图 5,6) 和生长曲线( 图 7) 均正常; 经 PCR 检测 Tem-GFP-pBC1 已整合入山羊乳腺上皮细胞的基因组中( 图 8) ,且与对照组相比,转基因细胞大量表达抗菌肽基因 Tem( 图 9) 。
上述结果表明,本研究获得了能够在山羊乳腺中特异表达 Tem-GFP 融合蛋白的转基因阳性细胞。能否利用该细胞通过体细胞核移植方法获得乳腺特异表达中国林蛙抗菌肽的转基因山羊有待于探讨。
乳腺发育过程涉及许多种细胞的参与及协同作用。乳腺细胞内大分子成分主要有糖类、脂类和蛋白质等三大类,它们也是乳汁主要组成成分。乳汁是乳腺生理活动的产物,乳汁中含有初生幼仔生长发育所必需的营养物质。乳汁成分复杂,都含有水、蛋白质、脂肪、糖、无...